芒果苷对HepG2细胞侵袭及转移的抑制作用及机制研究
2018-07-19喻丽珍年四辉李丽华
喻丽珍,年四辉,李丽华,王 涵
肝癌(HCC)是全球常见的恶性肿瘤之一,近年来其死亡率居及转移率居高不下,尤其是在发展中国家,其中50%以上发生在中国[1].目前,外科手术治疗仍然是肝癌治疗最有效的方法,但术后肿瘤的转移与复发是缩短患者生存期的主要原因,因此寻求有效的抑制肝癌转移的药物具有重要的临床意义.
芒果苷(mangiferin)又称知母宁、芒果素,芒果苷是一类从百合科植物知母、漆树科植物芒果等中分离得到的一种多酚羟基二苯并吡喃酮类化合物.近年来国内外对芒果苷的药理学研究主要包括抗肿瘤、抗氧化、调节脂代谢异常、抗糖尿病及其并发症、心血管保护以及抗高尿酸血症等[2],其抗肿瘤作用日益受到关注.本研究以肝癌HepG2细胞为研究对象,通过观察芒果苷对肝癌HepG2细胞迁移侵袭能力、细胞周期和细胞骨架等的影响,探讨芒果苷抗肝癌细胞侵袭转移的作用及可能机制,为其抗肿瘤的药物研究提供实验实验依据.
1 材料
1.1 细胞系及细胞培养
人肝脏肿瘤细胞株(HepG2),购于ATCC.HepG2细胞培养所用培养基为含10%胎牛血清的DMEM培养基,置于37℃、5%CO2培养箱中培养贴壁,传代周期为2~3d,取对数生长期细胞进行实验.
1.2 药物与试剂
芒果苷(成都曼思特生物科技有限公司,批号 must11110201);胎牛血清(GIBCO,批号:1619679);DMEM 培 养 基(GIBCO,批 号 :C11995500BT);胰酶(GIBCO,批号:1737903);青霉素-链霉素(GIBCO,批号:1558746);噻唑蓝(SIGMA,批号:M5655);二甲基亚砜(DMSO,Sin⁃opharm ChemicalReagentCo.Ltd,批 号 :T20070917);Actin-Tracker Green(碧云天生物技术公司,批号:C1003);细胞周期与细胞凋亡检测试剂盒(碧云天生物技术有限公司,批号:C1052);CyclinD1 Antibody(恩晶生物技术有限公司,批号:E1A0931-2);MMP2(Proteintech Group Inc,货号:10373-2-AP);山羊抗兔IgG二抗(MRbiotech,批号:115751).
1.3 仪器
电子天平:DENVER,型号:SI-403;电子显微镜:optical instrument factory in Chongqin,型号XSZ-D2;CO2培养箱:Shanghai bright Medical In⁃strument Co.Ltd,型号YCP-200;恒温水浴箱:CRYSTAL,型号SY-1210;高速冷冻离心机:美国科俊仪器公司;SH03014;Western电泳仪:美国Bio-Rad;曝光机:BIO-RAD,型号:Universal HoodⅡ;酶标仪:BioTek,型号:Synergy2;BD FACSCalibur流式细胞仪(BD,America);荧光倒置显微镜:ZEISS显微镜.
2 实验方法
2.1 分组及药物处理
待细胞长满时,弃上清液,PBS洗两次,加入DMEM培养基.将细胞分为6组:①对照组;②芒果苷25μmol/L组;③芒果苷50μmol/L组;④芒果苷100μmol/L组;⑤芒果苷150μmol/L组;⑥芒果苷200μmol/L组.①组加DMEM,②~⑥组加入相应浓度的芒果苷,于培养箱中培养24h.
2.2 细胞培养
人肝癌细胞HepG2用含10%胎牛血清的DMEM高糖培养基,置于37%、5%CO2饱和湿度的培养箱中培养,待细胞生长贴壁达到亚融合状态时,用0.25%的胰蛋白酶消化细胞备用.
2.3 MTT法检测HepG2的增殖活力
细胞经不同条件加药处理24h后,96孔板每孔加20μL MTT(5mg/ml),37℃孵育4h,去上清,每孔加150μL DMSO溶解结晶物,摇床摇15min,于490nm下测吸光度(OD)值.芒果苷对HepG2增殖的抑制率(%)=(空白组OD490-给药组OD490)/空白组 OD490*100%.
2.4 细胞划痕实验
取HepG2细胞经胰酶消化以2×104个细胞/孔接种于六孔板中,静置培养24h.细胞生长至70%左右更换用无FBS的DMEM饥饿12h,进行同步后处理使大部分细胞处于G0/G1期,使用10μL无菌枪头靠着直尺在单层细胞上划直线,PBS漂洗去除细胞,然后分组加药继续培养24h后,弃去培养液,PBS洗涤三遍后于倒置显微镜下观察细胞迁移到无细胞区域情况,拍照记录,每皿任取三张,每组六张片进行观察.
2.5 Transwell侵袭实验
采用Transwell小室法检测细胞的纵向迁移,将HepG2细胞用胰酶消化以1×105个细胞/孔接种于六孔板中,静置培养24h,更换培养基,用无血清的培养基饥饿细胞12h,使细胞处于同步化.消化收集细胞并进行计数,用不含FBS的DMEML将细胞稀释为密度1×105的悬液,待用.取已灭菌24孔培养板和底部带有8μm滤膜的细胞小皿,培养板孔内加含有10%FBS的培养基800μL;用缓冲液湿润小皿后放入培养板中使每个小室被培养液浸没,每个细胞小室内(上室)加入分组加药处理过的细胞悬液200μL,每小室内约含2×104个细胞,每组重复一个小室,置于培养箱培养24h后,取出24孔培养板,用镊子将小室取出,PBS漂洗小室,在小室翻转后的底部滴加4%多聚甲醛,固定60min,PBS洗3次,风干后在固定面滴加DAPI染核,浸没10min,PBS洗3次,将小室槽内细胞用棉签抹干净.将小室放于200倍镜下观察,并对迁移的蓝色细胞进行拍照,每组拍六张观察迁移状况.
2.6 细胞骨架染色观察
将HepG2细胞以胰酶消化接种于事先植入无菌盖玻片的24孔板中,经不同条件处理后,弃去培养液,PBS洗涤3次,每次5min,每孔加200μL预冷的4%多聚甲醛固定半小时,PBS洗3遍后每孔加含0.1%TritonX-100的PBS 200μL通透30min,PBS冲洗3次,每次5min.去除PBS后,避光滴加微丝绿色荧光探针染料,每片200μL,室温下避光孵育60min后,PBS洗涤3次,每次5min.将盖玻片勾出后倒扣于洁净载玻片,有细胞的一面朝下,荧光显微镜下拍摄,每组拍3张片.
2.7 细胞周期检测
细胞经不同条件处理后消化细胞和收集细胞悬液,1000 Rpm离心5min弃掉培养液,用预冷PBS洗涤细胞2次,离心去除PBS,加入预冷的75%的乙醇固定,4℃过夜.将乙醇固定的细胞悬液以1000 Rpm离心5min,去上清,PBS洗涤细胞,再离心,去除上清液,留下细胞沉淀,用PI染液按每个样(染色缓冲液0.5mL+20x碘化丙啶25μL+50xRNase A10μL)配制,加入细胞沉淀中,37℃孵育30min,在激发波长488nm处,用仪器测红色荧光,并检测光散射,采集10000个细胞数据,数据用FlowJo软件处理,分析不同周期细胞数量.
2.8 Westen blot检测CyclinD1和MMP9蛋白表达
细胞经不同条件培养后用预冷的PBS洗涤3次,裂解后的细胞离心(12000 Rpm,15min,4℃)后取上清液测定其蛋白浓度,与上样缓冲液混合于99℃下煮沸5min形成稳定的蛋白样品.取样20μg,SDS-聚丙烯酰胺恒压100V电泳分离蛋白,随后将凝胶上蛋白转移到硝酸纤维素膜上,用含5%脱脂奶粉的TBST封闭2h,一抗4℃孵育过夜.TBST洗涤3次后加入二抗(山羊抗兔,1:10000稀释)室温孵育90min,TBST洗涤3次后,加入ECL发光液曝光.利用凝胶自动分析成像软件Chemimage5500,以β-actin为内参进行分析.
3 统计学分析
应用SPSS 13.0统计软件进行相关数据分析,采用t检验进行统计分析,P<0.05为差异有统计学意义.
4 实验结果
4.1 芒果苷对肝癌细胞HepG2增殖的抑制作用
MTT法检测结果显示,芒果苷浓度≥25μmol/L能明显抑制HepG2细胞的增殖,且具有浓度依赖性,所以取芒果苷浓度为50μmol/L、100μmol/L、200μmol/L用于下一步的实验(表1).

表1 芒果苷作用24小时对HepG2细胞增殖的影响(`x±s,n=6)
4.2 芒果苷对肝癌细胞HepG2的迁移及侵袭的抑制作用
划痕实验用于观察细胞的迁移能力,结果如图1所示,加入芒果苷后,划痕区细胞数量明显减少,且具有浓度依赖性.Transwell小室迁移/侵袭实验结果显示,随着芒果苷浓度的增加,能明显抑制HepG2细胞的迁移及侵袭能力,且具有浓度依赖性(图1).

图1 芒果苷对HepG2细胞的迁移及侵袭的影响
4.3 芒果苷对肝癌细胞骨架的影响
研究表明,细胞骨架是细胞发生迁移的基础,在正常培养的HepG2细胞中,骨架蛋白-肌动蛋白F-actin表达明显,细胞骨架蛋白-肌动蛋白F-actin构成的微丝面积比较大,加入200μM的芒果苷后,HepG2细胞中由F-actin构成的微丝减少,骨架面积F-actin明显减少(图2).
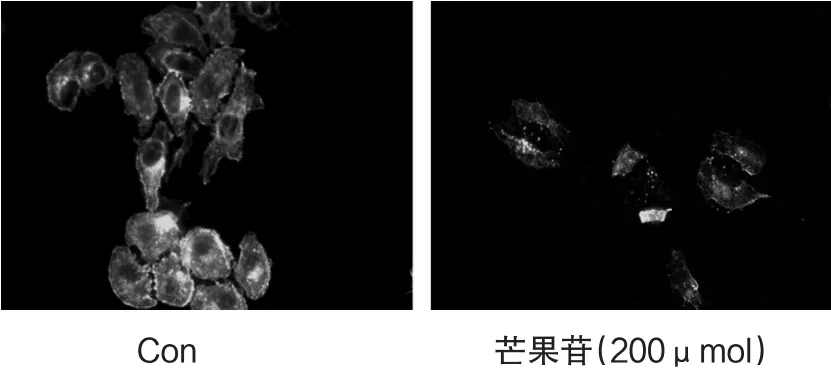
图2 芒果苷对HepG2细胞骨架的影响
4.4 芒果苷对肝癌细胞周期的影响
实验结果表明,芒果苷可以显著增加G1/G0期细胞,并减少S、G2/M期的细胞,与对照组相比有显著性差异(P<0.01)(图3).
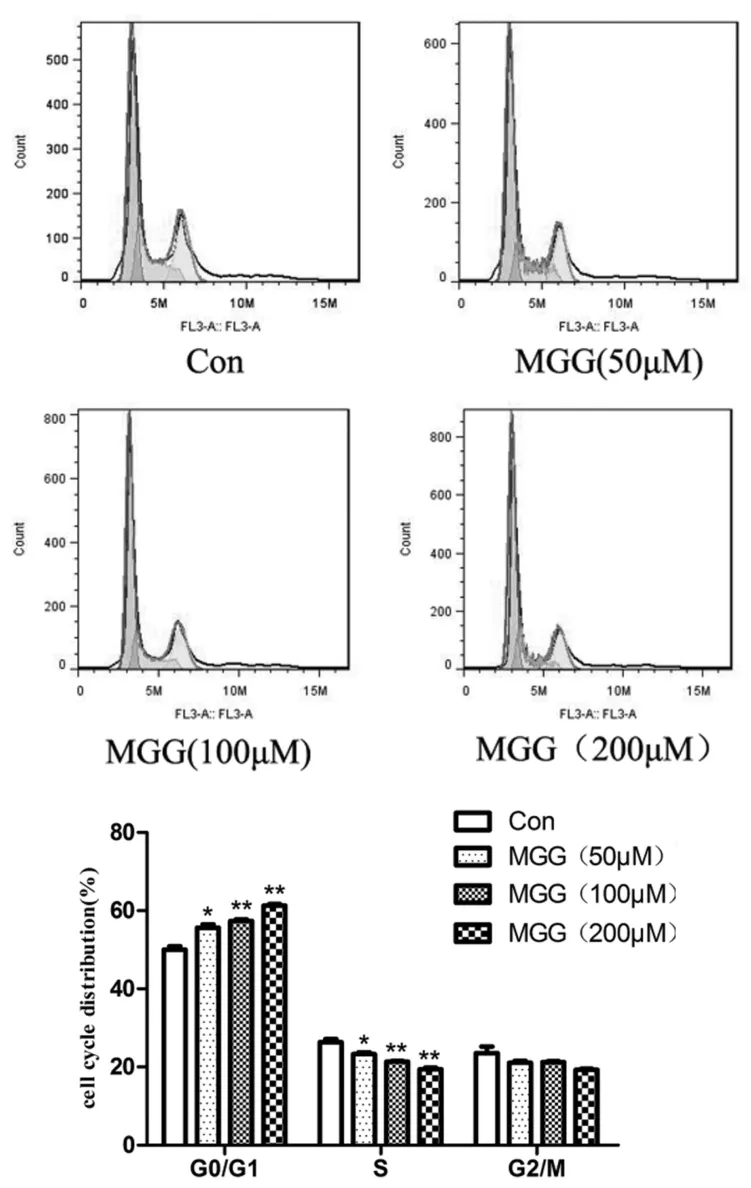
图3 芒果苷对HepG2细胞周期的影响
4.5 芒果苷对HepG2细胞中CyclinD1和MMP9表达的影响
Westen blot检测结果显示,芒果苷能明显抑制HepG2细胞CyclinD1和MMP9蛋白的表达,且具有浓度依赖性(图4).
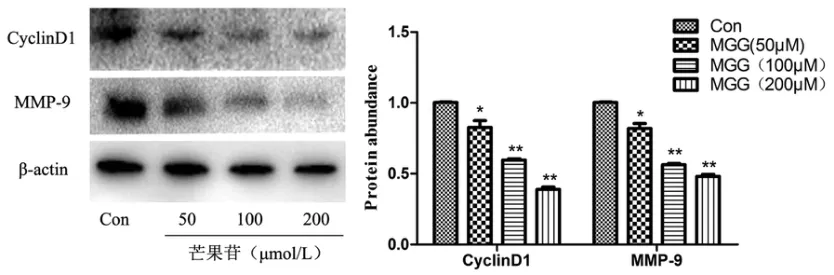
图4 芒果苷对HepG2细胞CyclinD1和MMP9蛋白表达的影响
5 讨论
原发性肝癌是临床上一种常见的恶性肿瘤,死亡率及转移率极高.肿瘤转移是肿瘤研究领域的瓶颈,癌症患者死于肿瘤转移的超过90%[3].肿瘤转移是恶性程度提高的标志,也是癌症治疗失败和患者死亡的主要原因,其分子机制复杂,涉及多步骤、多阶段、多基因的变化.各种原因造成细胞表型的改变使肿瘤恶性程度逐渐提高,最终使肿瘤细胞具有从原发部位脱离并在转移部位生长的能力,这个过程不仅牵涉到细胞本身的改变,也牵涉到细胞和宿主微环境的相互作用,其中一个重要过程就是肿瘤细胞对细胞外基质(ECM)的降解,任何可以影响这个过程的因素都可影响肿瘤的侵袭过程[4-5].蛋白水解酶对于细胞外基质的降解在肿瘤侵袭及迁移中发挥巨大的作用,MMP-9的作用更是至关重要,其主要功能是降解细胞外基质并重新设置细胞外基质的动态平衡,进而对肿瘤细胞的侵袭及迁移过程发挥正面影响[6].细胞骨架调控网络在肿瘤发生发展过程中起到关键的作用,细胞骨架纤维重塑过程需要肌动蛋白(F-actin)参与,F-actin通过改变细胞片状伪足及丝状伪足的形成,进而影响细胞迁移和侵袭过程[7].周期蛋白依赖性激酶(Cy⁃clin-dependent kinase)Cdk在细胞周期调控中起核心作用,其主要功能为进行启动、促进和完成细胞周期事件.研究表明:Cdk必须与周期蛋白(CyclinD)结合才有蛋白激酶活性[8-9].CyclinD1(G1/S-特异性周期蛋白-D1)是调节细胞从G1/G0期进入S期的周期蛋白,其主要功能是促进细胞由G1期进入S期从而促进细胞增殖过程.
本研究先采用MTT法筛选出无细胞毒性的芒果苷的浓度后,通过划痕实验、Transwell小室侵袭/迁移实验、细胞骨架分析,证实了随着芒果苷浓度的增加可以明显抑制肝癌细胞HepG2的侵袭、迁移及与细胞骨架重建.进一步通过western blot证实了随着芒果苷浓度的升高可以明显抑制肝癌细胞HepG2中CyclinD1和MMP9蛋白的表达,提示芒果苷可能通过影响细胞周期进程及胞外基质从而抑制肿瘤细胞的侵袭转移.在今后的研究中,我们将进一步深入研究芒果苷对肝癌的侵袭、转移能力的影响及作用机制,并且通过体内动物实验来进一步探究其药理效应,为肿瘤的临床治疗提供新的思路.
