耐高温葡萄糖异构酶的全细胞固定化条件研究
2018-07-18贾东旭王腾孙嘉诚金利群廖承军陈德水王红艳
贾东旭,王腾,孙嘉诚,金利群,廖承军,陈德水,王红艳
1(浙江工业大学,浙江省生物有机合成技术研究重点实验室,浙江 杭州,310014) 2(浙江华康药业股份有限公司,浙江 开化,324032)
D-葡萄糖和D-果糖分别是自然界分布最广和甜度最大的单糖,两者互为同分异构体,混合,可制得高果糖浆(high fructose corn syrup,HFCS)。根据果糖质量分数的不同,HFCS分为HFCS-90、HFCS-42和HFCS-55[1]。其中,HFCS-55的口感和甜度更适用于工业应用[2]。
葡萄糖异构酶(EC 5.3.1.5,glucose isomerase,GI),可催化D-葡萄糖异构化为D-果糖,是生产HFCS最重要的商业酶[3]。伴随HFCS日益膨胀的市场需求,需要研制热稳定性更好并可以循环使用的新型GI酶制剂。固定化酶(细胞)是20世纪崛起并已成功应用于多种酶的工业化实用技术,经固定化的酶或细胞的半衰期和操作稳定性会有很大提升,便于填充床连续反应和催化剂的回收再使用[4]。

GI异构化过程中,高温有利于推动反应平衡向果糖方向进行,本实验室已通过基因挖掘技术筛选到新型耐高温酶ThermusoshimaiGI(ToGI),于85 ℃保温48 h,仍保留80%以上酶活,热稳定性显著优于已有耐高温酶[9]。基于此,寻找适用于ToGI的固定化方法成为当务之急。有报道指出,三羟甲基磷[P(CH2OH)3](THP),是一种可以替代GLU使用的交联剂,其与氨基物质交联形成P—CH2—N键,该键在高温下非常稳定[8]。该交联剂已用于固定化脂肪酶[10]、α-葡萄糖苷酶[11]和β-半乳糖苷酶[12],各固定化产物的相对酶活或热稳定性较游离酶都明显提高。
此外,固定化材料的理化性质同样影响固定化产物的性能,廉价易得、对酶无损害、可提高酶稳定性、能延长固定化酶的使用周期等都应该是固定化材料的选择准则[13]。固定化过程中,各条件因素的变化也会影响固定化产物的催化性能[14]。因此,需要对影响固定化的关键因素,如细胞装载量、絮凝剂和交联剂的使用量进行研究。
本研究首次详细优化了THP交联固定耐高温ToGI的过程,首先确定固定化所用的最佳材料,如载体、絮凝剂和THP交联剂类型等;此后,进一步优化了固定化过程的条件因素,如絮凝和交联时间、金属离子摩尔浓度等,以确定最优固定化方法,最终实现高温连续制备高果糖浓度HFCS。
1 材料与方法
1.1 材料与试剂
表达ToGI的重组菌E.coliBL21 (DE3)/pET28b/ToGI由本实验室构建并保存[15]。
卡那霉素(Kan)购于上海生工生物工程股份有限公司;D-葡萄糖、80%(质量分数)四羟甲基氯化磷水溶液(THPC)、75%(质量分数)四羟甲基硫酸磷水溶液(THPS)、各种分子质量(600~70 000 Da)的聚乙烯亚胺(PEI)购于上海阿拉丁生化科技股份有限公司;D-果糖购于北京索莱宝科技有限公司;各种粒径(9.6~36.8 μm)的硅藻土(DE)购自百灵威科技有限公司;其他实验试剂为国产分析纯。
1.2 仪器与设备
高压蒸汽灭菌锅,上海博讯实业有限公司;超净工作台,苏州中亚净化设备有限公司;5 L立式发酵罐,上海保兴生物器材有限公司;高速冷冻离心机,美国Beckman公司;电热恒温水浴锅,德国Julobo公司;高效液相色谱,美国Waters公司。
1.3 试验方法
1.3.1 培养基与静息细胞的制备
LB液体培养基(g/L):蛋白胨10、酵母粉5、NaCl 10(固体培养基添加20 g/L琼脂)。
发酵培养基(g/L):蛋白胨15、酵母粉12、NaCl 10、甘油12、KH2PO41.5、(NH4)2SO45、K2HPO4(3H2O 2.3、MnCl23.8。
补料培养基(g/L):蛋白胨75、酵母粉50、甘油500、KH2PO46.75、(NH4)2SO45、Na2HPO43、H2O 3、柠檬酸3。
将重组菌E.coliBL21(DE3)/pET28b/ToGI接种至含100 μg/mL Kan的LB液体培养基,于37 ℃培养10 h,获得种子液;将100 mL种子液接种至装有3 L发酵培养基的发酵罐中,于37 ℃、500 r/min、1.33 vvm和0.05 MPa罐压条件下发酵3.5 h,过程中流加2 mol/L磷酸和25%(体积分数)氨水调节pH值至7.0;当发酵至罐内溶氧上升时,流加200 mL补料培养基;将发酵罐温度降至28 ℃,加入质量浓度为10 g/L的乳糖诱导表达10 h,离心收集湿菌体,即为含ToGI基因的湿菌体细胞(简称重组ToGI细胞)。
1.3.2 初始固定化方法
制备THP水溶液:按THPC和KOH摩尔比1∶0.995的配制原则[12],将15 g THPC(或32.6 g THPS)溶于90 mL ddH2O,再将3.4 g KOH溶于10 mL ddH2O,室温条件下将两者缓慢混合,制得THP水溶液。
在搅拌条件下,将5 g的重组ToGI细胞悬浮于50 mL Na2HPO4-NaH2PO4缓冲液(pH 7.0),先加入0.3 g Celite 545载体,再加入2 mL体积分数为4%的PEI(分子质量10 000 Da)母液,絮凝反应1.5 h,最后加入体积分数为0.5%的上述THP水溶液,交联反应2 h。然后抽滤,滤饼用蒸馏水洗涤后用轴向挤压机挤压成长条状,室温风干后,粉碎成颗粒,得到含耐高温ToGI固定化颗粒。
1.3.3 固定化载体、絮凝剂和交联剂的选择
以相对酶活为考察指标,进行如下实验,确定最佳固定化材料。
(1)确定最佳固定化载体。按1.3.2,选择不同粒径9.6、19.6和36.8 μm的DE作为载体进行固定化,然后进行酶活测定。
(2)确定最佳絮凝剂。取上述最优结果,分别选择分子质量为600、1 800、10 000和70 000 Da的PEI作为絮凝剂进行固定化,然后进行酶活测定。
(3)确定最佳交联剂。取上述最优结果,分别选择THPC和THPS作为前体物质制备THP用于固定化,然后进行酶活测定。
1.3.4 固定化条件研究
选用上述最优固定化载体、絮凝剂和交联剂,以酶活为考察指标,详细优化以下各条件,具体为:
(1)确定最佳细胞装载量。选用细胞装载量分别为3、4、5、6、7和8 g,其他同1.3.2,进行细胞固定化。
(2)确定Mn2+添加摩尔浓度。取上述最优结果,在加入载体后,分别加入3、5、10、15和20 mmol/L Mn2+,其他同1.3.2,进行细胞固定化。
(3)确定PEI最佳体积分数。取上述最优结果,选用PEI絮凝剂母液体积分数分别为1%、2%、3%、4%、5%和6%,其他同1.3.2,进行细胞固定化。
(4)确定最佳絮凝时间。取上述最优结果,选用絮凝时间分别为0、0.5、1、1.5、2和2.5 h,其他同1.3.2,进行细胞固定化。
(5)确定最佳THP体积分数。取上述最优结果,设定所用THP体积分数分别为0.5%、1%、1.5%、2%和2.5%,其他同1.3.2,进行细胞固定化。
(6)确定最佳交联时间。取上述最优结果,分别选用以下交联时间1、1.5、2、2.5、3和3.5 h,其他同1.3.2,进行细胞固定化。
1.3.5 GI酶活测定
参照贾东旭等[16],略做修改,测酶活体系包括:200 mmol/LD-葡萄糖、10 mmol/L Mg2+、1 mmol/L Co2+、0.25 g固定化产物(或细胞),用50 mmol/L PBS缓冲液(pH 7.0)补齐至5 mL。异构化反应于85 ℃反应20 min,置于冰上10 min终止反应,离心吸取上清液进行D-果糖的HPLC检测。酶活定义:每min生成1 μmolD-果糖所需的酶量定义为1个活力单位U。
1.3.6 HPLC分析D-果糖和D-葡萄糖
色谱柱Hypersil NH2柱(250 mm×4.6 mm,5 μm)(依利特分析仪器有限公司)。Waters 2414示差折光检测器。柱温30 ℃,流动相80%(体积分数)乙腈,流速1.0 mL/min,进样量10 μL。D-果糖和D-葡萄糖出峰时间分别为8.73和10.39 min。
1.3.7 固定化颗粒操作稳定性研究
20 mL催化体系包括:50 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 7.0)、1 100 mmol/LD-葡萄糖、8 mmol/L Mn2+、1 g固定化细胞颗粒。异构化反应于85 ℃反应2 h,反应液经离心,少量上清液经0.22 μm膜过滤后用HPLC检测D-果糖浓度;收集的THP固定化颗粒经缓冲液洗涤,用于下一批的生物转化。
2 结果
2.1 筛选固定化载体、絮凝剂和交联剂
2.1.1 确定最佳DE类型
工业应用的固定化载体应廉价易得、对酶活力无过多损害。在各种有机和无机载体中,较为常用的有树脂、壳聚糖、几丁质、DE和SiO2等[13]。其中,DE拥有吸附和抗溶胀的性能,可以改善固定化颗粒传质特性,是固定化GI最为常用的载体[15]。例如,张帆等以DE为载体,选择壳聚糖絮凝-GLU交联法固定ThermobifidafuscaGI所制成的固定化细胞酶活为2 579 U/g,酶活回收率达到70.5%[17]。本实验考察不同粒径DE对固定化细胞酶活的影响,结果如图1所示。当使用的DE粒径从9.6 μm增大至36.8 μm,固定化细胞的相对酶活提高了37.5%,并且,使用36.8 μm DE的固定化细胞酶活同样优于采用Celite 545的固定化产物的酶活。该现象的原因可能是高粒径载体的比表面积与负载量大,能够耦联更多的酶细胞[18]。本实验确定固定化DE的最佳粒径为36.8 μm。
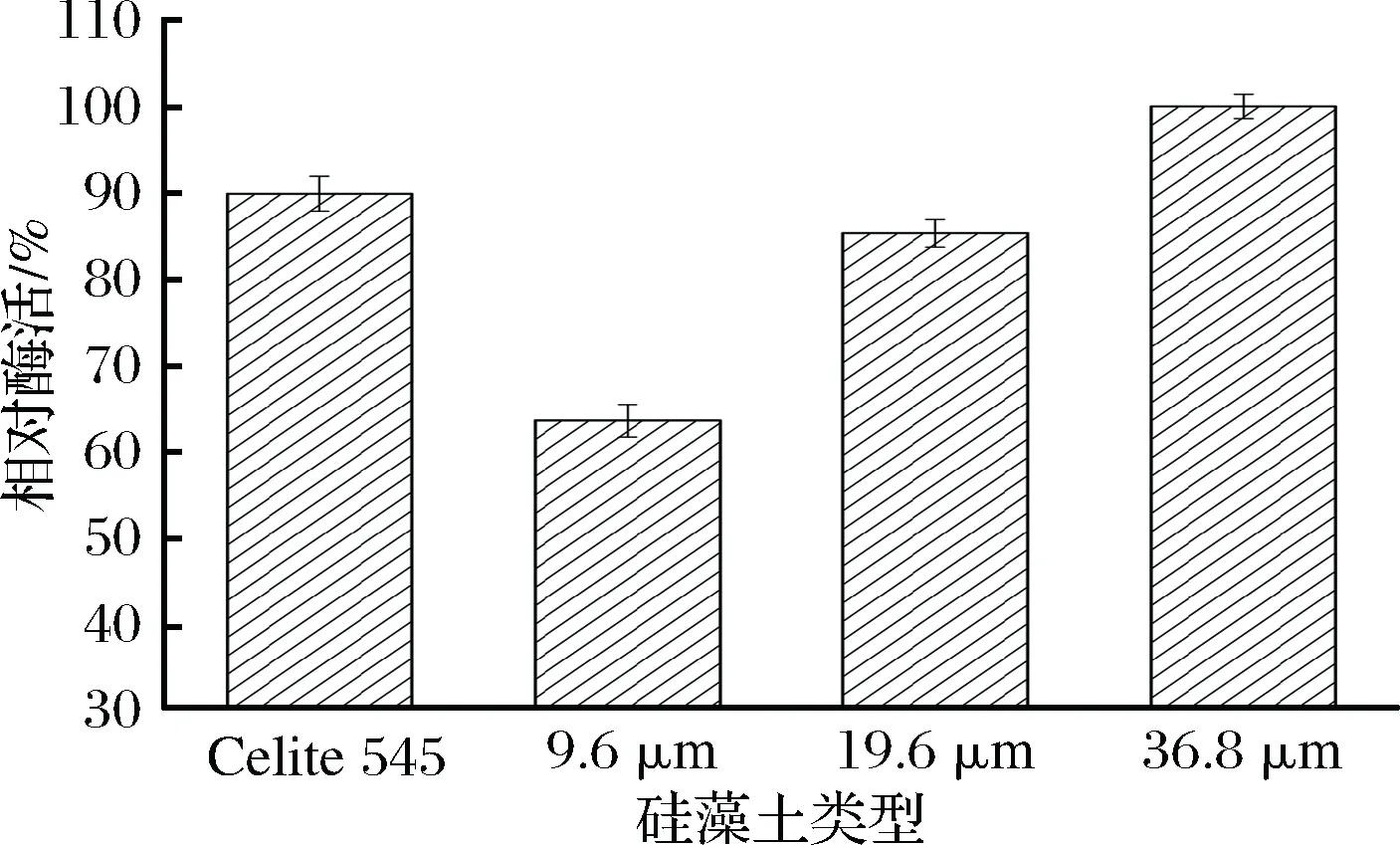
图1 不同粒径DE对固定化酶活的影响Fig.1 Effect of different diatomite on the activity of immobilized product
2.1.2 确定最佳PEI类型
固定化交联之前,先加入多胺类物质(PEI)作为絮凝剂,其伯胺基团会与后加的交联剂反应,从而提高固定化产物的稳定性[19]。例如,WILSON等在采用CLEAS法固定化脂肪酶时,先选用PEI进行絮凝,所制备的交联酶聚集体表现出较高的有机溶剂耐受性[20]。但是,市售PEI的相对分子质量不尽相同,因此,很有必要考察不同分子量的PEI作为絮凝剂对固定化产物酶活的影响。本实验结果如图2,当选用PEI分子质量增大至70 000 Da,固定化细胞可以获得最大相对酶活。原因是高分子量的PEI拥有更多分支[21],其与交联剂联合使用会使细胞表面形成的聚合物膜包裹更加紧密,从而获得更佳的固定化效果。本试验确定絮凝剂PEI的最佳分子质量为70 000 Da。
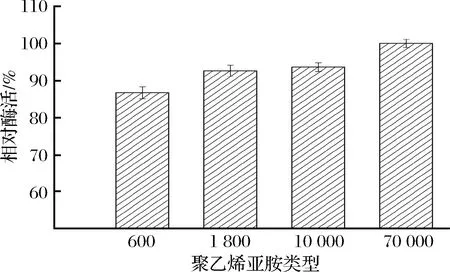
图2 不同分子质量的PEI对固定化酶活的影响Fig.2 Effect of PEI with different molecular weight on the activity of immobilized product
2.1.3 确定最佳交联剂
THP是由四羟甲基磷化合物与碱类物质(KOH)混合制备生成[12]。市场上能够买到的四羟甲基磷化合物有THPS和THPC,前者的单价较低。因此,本实验考察了两者用于固定化对产物酶活的影响。由图3可知,尽管两者的有效成分相同,但与THPS制备的交联剂相比,使用THPC制备的交联剂所获得的固定化细胞的相对酶活为95.7%。因此,结合固定化效果和成本两因素,最终确定使用THPS制备THP交联剂。另外,本实验还考察了THP与传统交联剂GLU的固定化效果比较,结果显示,经GLU交联的固定化细胞的相对酶活仅为85.4%,进一步说明THP与氨基物质发生Mannich反应生成的P—CH2—N键有利于结合更多细胞。
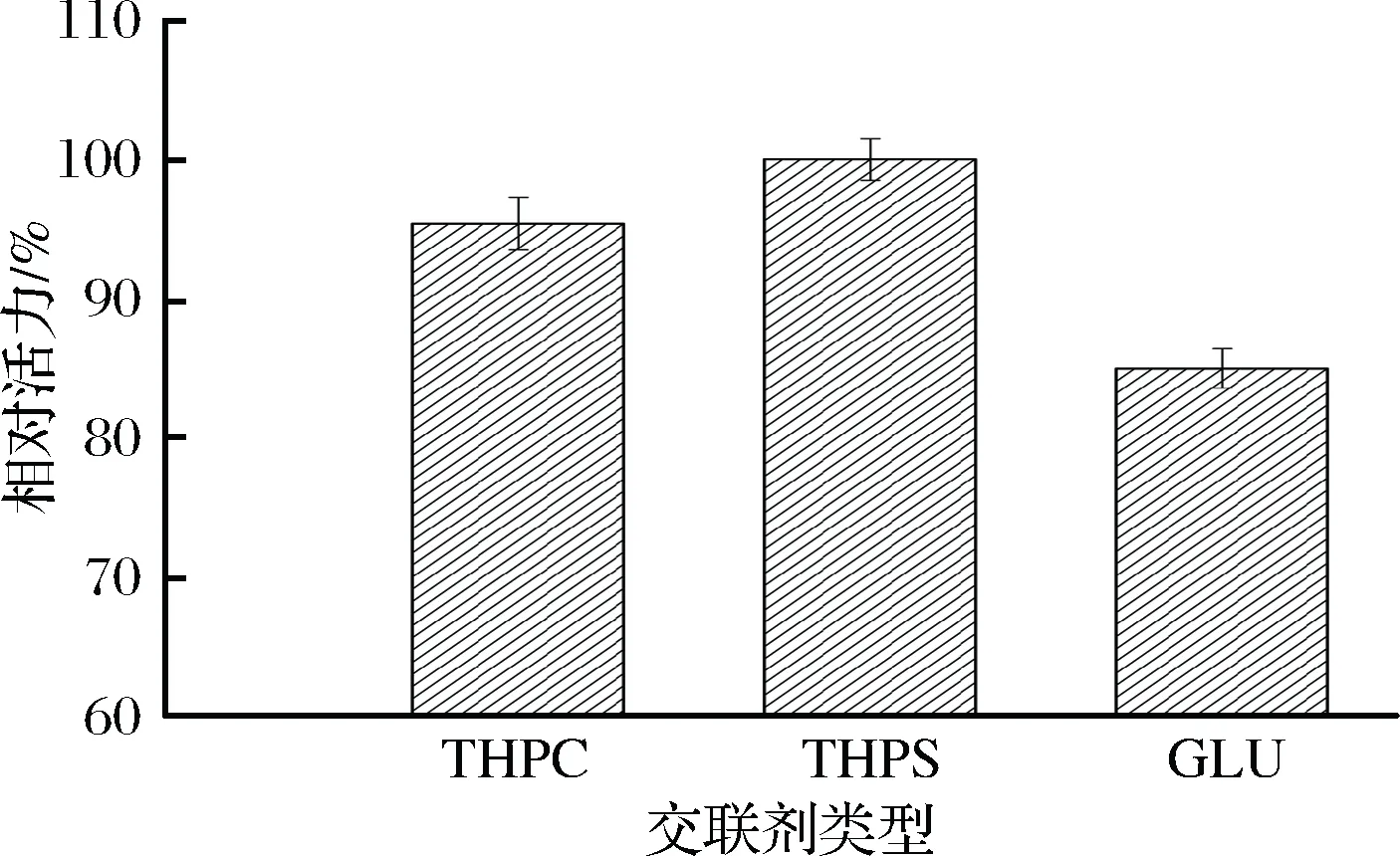
图3 不同交联剂对固定化产物酶活的影响Fig.3 Effect of different crosslinker on the activity of immobilized product
2.2 固定化条件研究
2.2.1 确定细胞装载量
载体的结合空间有限,当被过量含酶细胞占据时,底物和产物的扩散速率就会降低,这样就限制固定化产物的催化能力,导致酶活降低[22]。因此,当载体定量,为了达到最佳固定化效果,需要优化细胞装载量。本研究考察3~8 g细胞装载量对固定化酶活的影响,如图4所示。
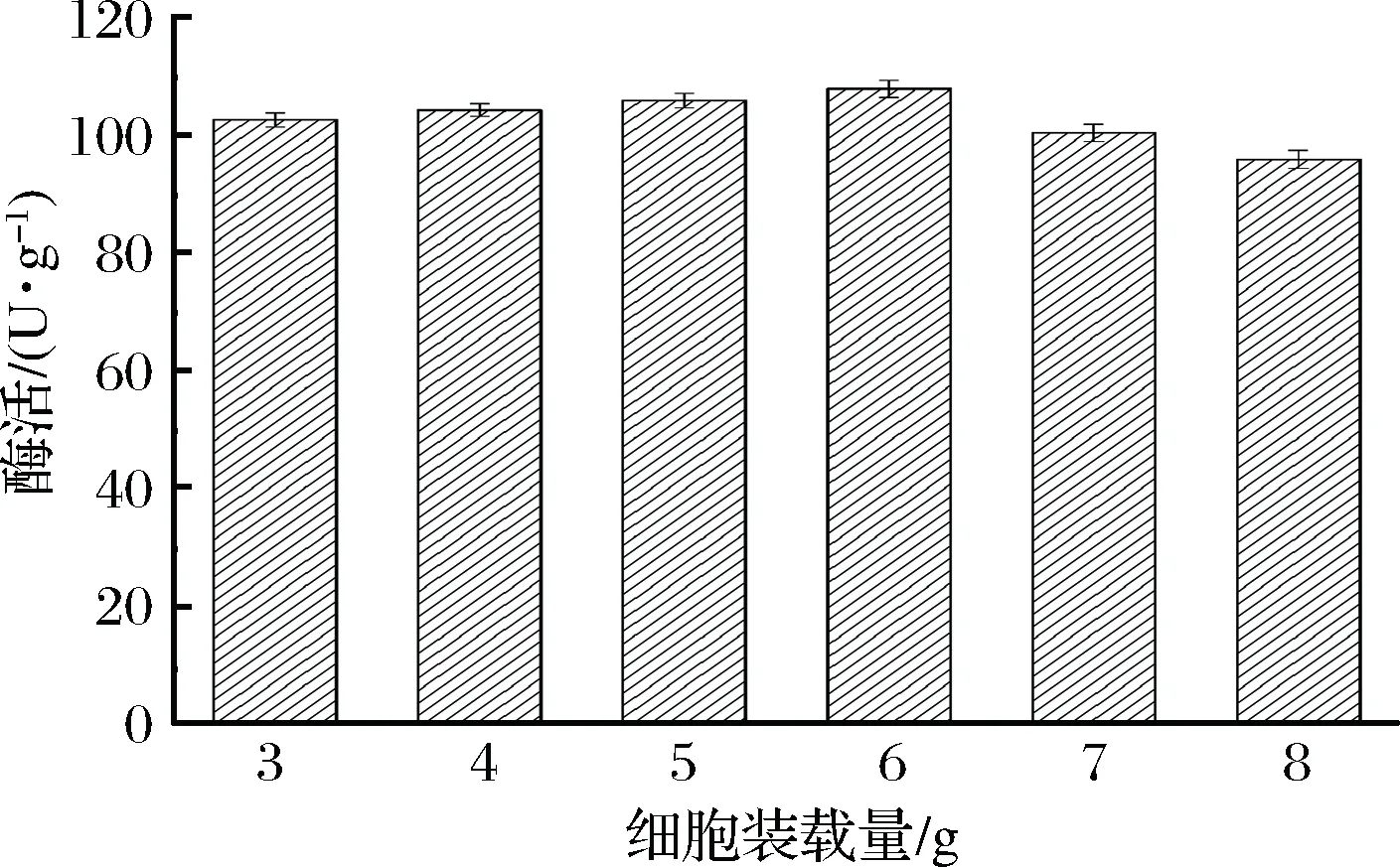
图4 不同细胞装载量对固定化酶活的影响Fig.4 Effect of different cell loading on the activity of immobilized product
当细胞量从3 g增加至6 g,固定化细胞的酶活随之上升,当细胞量为6.0 g时,酶活达到最大107.9 U/g。细胞量继续增加,酶活却呈现下降趋势,说明结合过量细胞导致载体通道堵塞,固定化产物酶活受到抑制[23]。因此,确定6 g细胞装载量为最佳。
2.2.2 确定固定时Mn2+添加量
GI的活力及稳定性与金属离子有关,如Mg2+、Co2+和Mn2+对保持酶的有序构象、提高酶稳定性和活力均有促进作用,而Fe3+、Ca2+则对催化反应起到抑制作用[7]。对于ToGI,本团队已经发现发酵时添加5 mmol/L Mn2+,能够显著提高ToGI酶活[9]。因此,在固定化过程中,本实验继续考察添加不同摩尔浓度的Mn2+对固定化细胞酶活的影响,实验结果见图5。当固定化过程中添加5 mmol/L Mn2+,固定化酶活升高至最大值110.3 U/g;当Mn2+摩尔浓度继续增加至20 mmol/L,酶活已逐渐下降至94.3 U/g。酶活提高幅度较小的原因可能是菌体发酵时添加的Mn2+[16]已与酶的金属结合位点饱和,固定化时继续添加Mn2+只能维持该状态。因此,可以在固定化时添加5 mmol/L Mn2+以提高固定化产品活力。
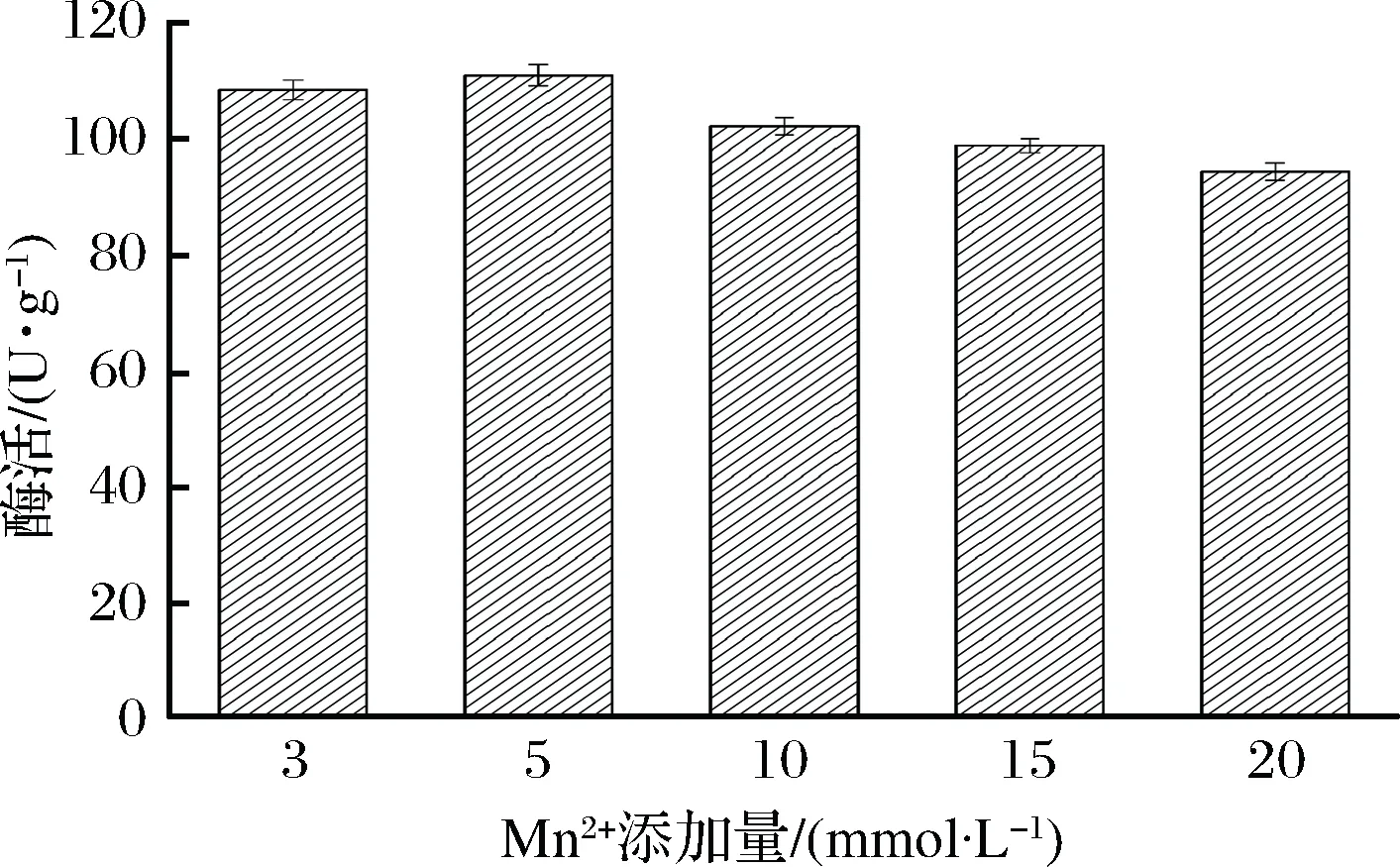
图5 Mn2+添加量对固定化酶活的影响Fig.5 Effect of different Mn2+ concentration on the activity of immobilized product
2.2.3 确定PEI体积分数
上述实验确定了絮凝剂PEI的最佳分子质量为70 000 Da,本实验随即考察了1%~6%的PEI母液体积分数对固定化细胞酶活的影响,结果如图6所示。当PEI母液体积分数处于1%~3%之间,固定化细胞酶活随之升高;当PEI母液的体积分数为3%时,固定化细胞酶活达到最高的118.7 U/g。该结果表明该体积分数对细胞的絮凝程度较合适,过高的PEI体积分数会使其自身发生粘连,造成传质阻力过大,对酶活产生不利的影响[15]。丁为龙等在固定化β-呋喃果糖苷酶时,选定PEI体积分数为2.0%[24];郑剑锋等通过PEI共沉淀技术制备海藻糖合酶交联聚集体,确定了最优PEI体积分数为1%[25]。本实验选定了较高的细胞装载量,所需的PEI体积分数仅为0.12%,说明本工艺具备一定的过程经济性。
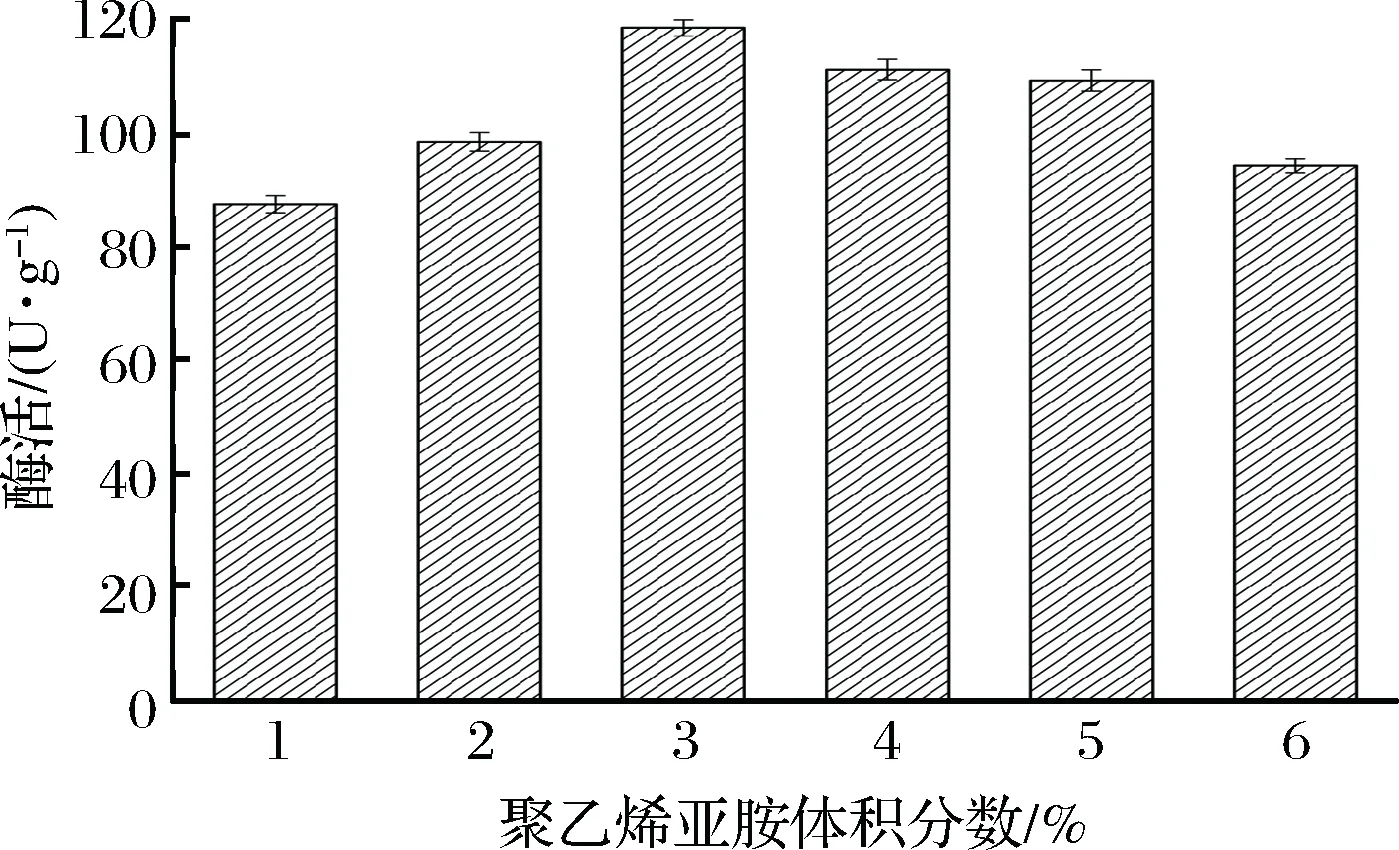
图6 聚乙烯亚胺体积分数对固定化酶活的影响Fig.6 Effect of different PEI concentration on the activity of immobilized product
2.2.4 确定PEI絮凝时间
确定了絮凝剂PEI的体积分数,还需要优化其絮凝时间。郑建永等在PEI/GLU交联法固定化重组酯酶细胞过程中,确定PEI最佳絮凝时间为1.0 h[26];海洪等在PEI对海藻酸固定化重组E.coli细胞的强化作用研究时,将细胞置于体积分数为0.2%~1% PEI溶液中间歇搅拌反应24 h,制得固定化细胞连续反应10批次,酶活无明显下降[27]。本研究考察了PEI絮凝时间对固定化ToGI重组细胞酶活的影响,选用的絮凝时间为0~2.5 h,结果如图7所示。
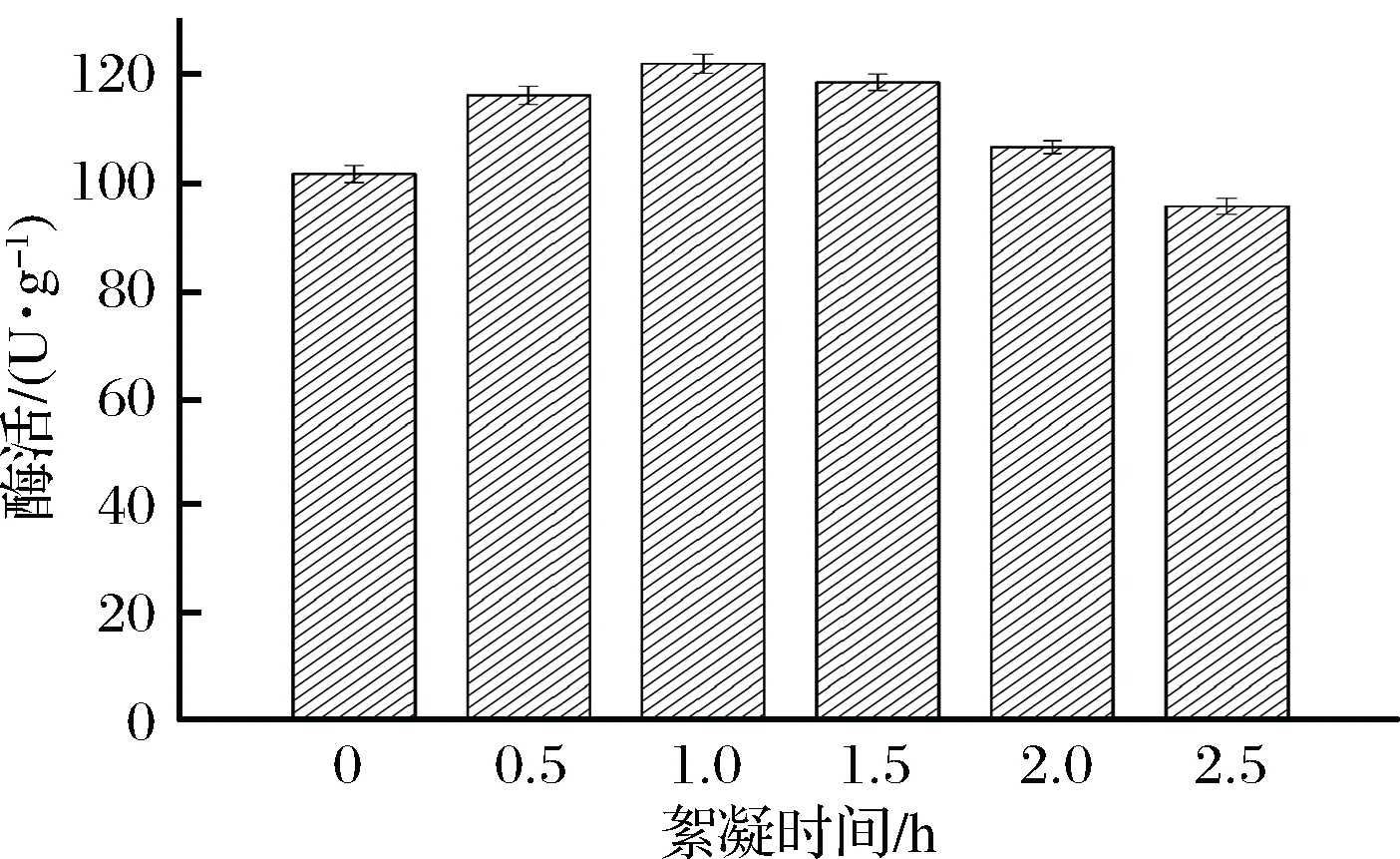
图7 不同PEI絮凝时间对固定化酶活的影响Fig.7 Effect of different PEI flocculation time on the activity of immobilized product
随着絮凝时间的增加,固定化产物酶活也上升。在絮凝时间为1.0 h时活力达到最高的121.7 U/g;继续增加絮凝时间,酶活开始下降,絮凝2.5 h,酶活仅剩95.3 U/g。该结果说明絮凝时间过长导致固定化产物结构过于紧密,传质阻力变大,降低固定化细胞酶活。因此,最终选择1.0 h为最佳絮凝时间。
2.2.5 确定THP交联体积分数
在固定化交联过程中,选取适当体积分数的交联剂可以与细胞和载体形成最大的活性交联体[28]。本实验通过调整THPS和KOH的添加量,将THP控制在体积分数为0.5%~2.5%范围内,以考察不同交联剂体积分数对固定化细胞酶活的影响。如图8所示,当THP体积分数从0.5%提高至1.5%,固定化细胞酶活升高至最大值127.3 U/g,继续提高THP体积分数,固定化酶活有所下降。该结果说明1.5%的THP体积分数刚好可以与载体和细胞上的氨基完全反应。梁欣欣以纯棉浴巾为载体、PEI为吸附剂、利用THP为交联剂固定脂肪酶,优化所得THP的添加量也为1.5%[10]。但是,THP由等摩尔THPS和KOH混合而成,合成大量THP必然需要提高KOH添加量,但过量OH-加速催化生成没有固定化能力的(HOCH2)3P=O(THPO),该物质会对固定化细胞的酶活产生不利影响[11]。因此,确定固定化时添加THP的最佳体积分数为1.5%。
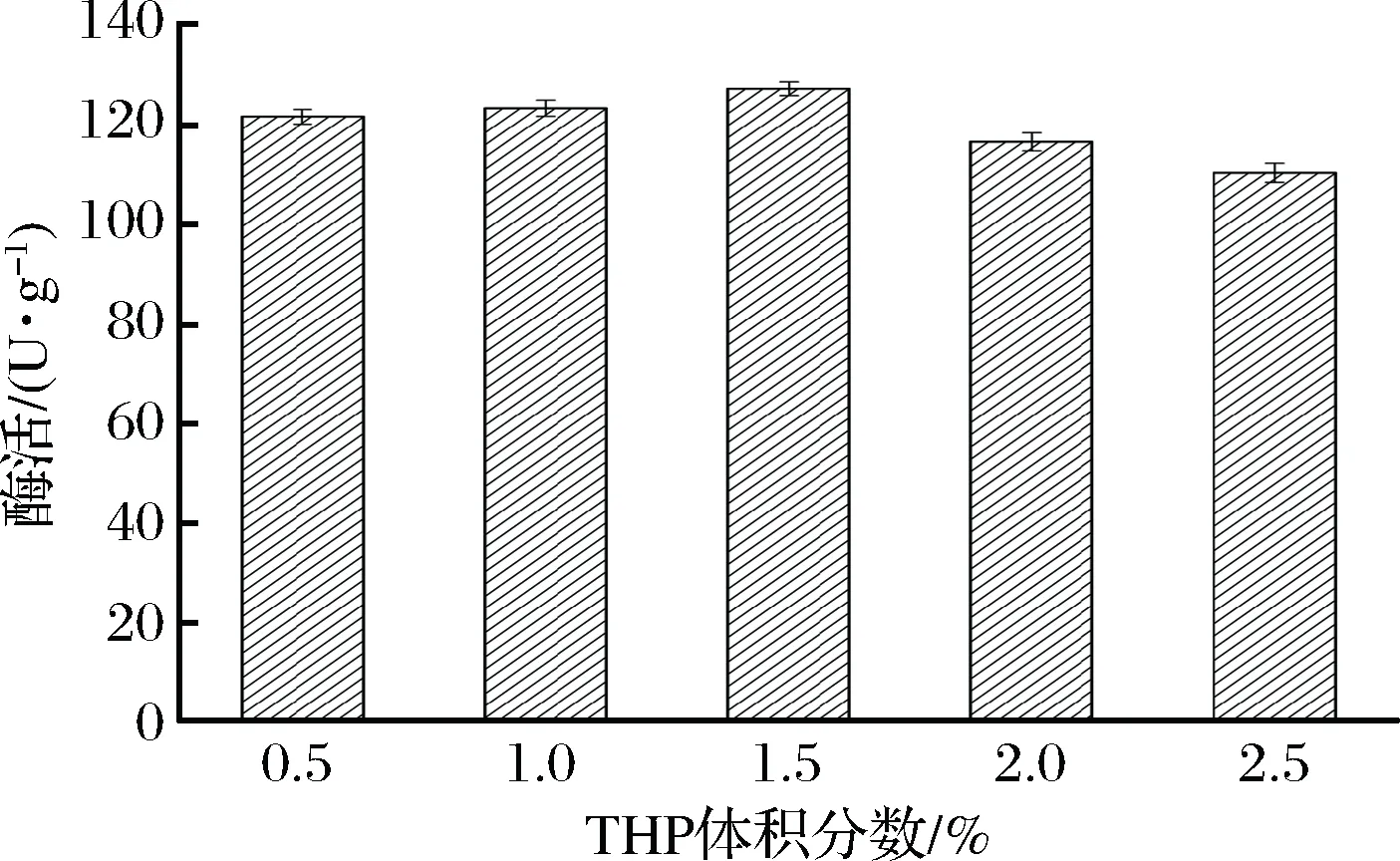
图8 不同THP体积分数对固定化酶活的影响Fig.8 Effect of different THP volume fraction on the activity of immobilized product
2.2.6 确定THP交联时间
交联时间对固定化效果的影响至关重要,交联反应是否彻底、固定化是否牢固均会影响最终产物的酶活[29]。因此,本研究考察了交联时间对固定化细胞酶活力的影响,见图9。

图9 THP交联时间对固定化酶活的影响Fig.9 Effect of different THP crosslinking time on the activity of immobilized product
由图9可知,随着交联时间的增长,THP固定化产物酶活呈现先升后降的趋势;当交联1.5 h时,固定化酶活出现峰值138.4 U/g。该结果说明交联时间的延长致使更多PEI和细胞表面的氨基基团形成交联,当所有活性基团均处于交联饱和状态后,酶活呈现峰值[28];过度交联会破坏酶的活性中心导致酶活降低。此外,THP易在空气中氧化生成副产物(HOCH2)3P=O(THPO),该物质可能也会导致酶活下降[11]。因此,结合实验结果,最终确定最佳的交联时间为1.5 h。
2.3 固定化细胞的操作稳定性研究
操作稳定性是评价固定化产品应用性能的关键指标[30]。按上述优化的固定化配方批量制备固定化细胞颗粒,考察其在85 ℃高温条件下连续催化D-葡萄糖制备高浓度D-果糖的生物转化情况。结果如图10所示。
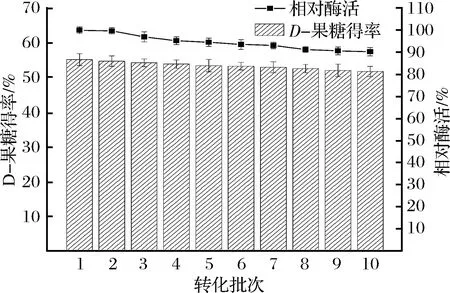
图10 THP固定化产品的操作稳定性Fig.10 The operational stability of immobilized biocatalyst
经过10个批次的转化,固定化细胞的酶活虽有下降,但仍保留91%以上初始酶活。整个转化过程中,D-果糖得率均维持在51.7%以上。段绪果等使用壳聚糖絮凝-GLU交联法固定ThermobifidafuscaGI,于70 ℃下重复使用8批次后,转化率为42.1%[14];刘芳等采用明胶GLU固定化乳糖酶和葡萄糖异构酶用于制备果糖,间歇操作6批次后,催化剂保留75%以上初始酶活[31]。与上述实例相比,本研究所用的固定化催化剂具备优良的高温稳定性,并可以极大地提升使用率,展示了良好的操作稳定性。
通过上述研究,应用固定化重组ToGI细胞,可以连续制备50%以上果糖质量分数的HFCS,有效提升了现有的转化工艺。但在使用固定化细胞作为催化剂的转化过程中,很容易将E.coli细胞内对人体有害的物质带入到产品中[32]。在后续研究中,为了更好满足食品工业的安全要求,需要将E.coli的重组酶表达体系更换为符合食品安全的枯草芽孢杆菌(Bacillussubtilis)表达系统,以实现安全、高效生产HFCS的目的。另外,B.subtilis表达系统还具备一定的蛋白质分泌功能[33],便于蛋白的分离纯化,再与固定化技术相结合,将制备的固定化酶颗粒用于生产,产物中不含任何细胞内成分,这对于提高食品安全质量极为有利。
3 结论
本研究详细研究了经THP交联固定化重组菌E.coliBL21 (DE3)/pET28b/ToGI的关键过程条件。选取不同载体、絮凝剂和交联剂,确定DE粒径36.8 μm、PEI分子质量为70 000 Da、交联剂合成前体为THPC。运用最优固定化体系,即0.3 g DE、5 mmol/L Mn2+、0.12% PEI絮凝1.0 h、1.5% THP交联1.5 h,细胞具有最高酶活138.4 U/g。于85 ℃和1 100 mmol/LD-葡萄糖条件下连续转化10批次,D-果糖得率均高于51.7%。以上研究说明该固定化产物满足制备高果糖浓度HFCS的要求,为进一步开展该酶在食品安全的表达系统中的表达与固定化研究奠定了基础。
