水稻纹枯病菌拮抗芽孢杆菌的筛选及鉴定
2018-07-17杨金松王爱军张再君
杨金松,王爱军,张再君*
(1.湖北省农业科学院粮食作物研究所,湖北武汉430064;2.粮食作物种质创新与遗传改良湖北省重点实验室,湖北武汉430064;3.四川农业大学水稻研究所,四川成都611130)
水稻纹枯病是由立枯丝核菌(Rhizoctonia solani)引起的一种土传性真菌病害,该病原菌可产生抗逆性强、在土壤中存活和传播中起关键作用的菌核结构,防控难度极大,严重发病时可造成水稻减产50%,现已成为制约我国南方水稻高产的第一大病害[1-2]。生产中长期单一使用化学药剂,不仅使病原菌产生抗药性、污染环境,高剂量的农药残留还会危及人类健康,同时对土壤中有益微生物也产生抑制作用[3]。生物防治对环境、生态和人类健康安全,因此在防治水稻纹枯病中发挥着越来越重要的作用。开发新的有益微生物资源是生物防治的前提。
芽孢杆菌(Bacillus spp.)能产生耐热抗逆的内生芽胞,不仅分泌多种抑菌化合物,还可以促进植物生长和诱导植物产生系统抗性。目前,性状优良的菌株资源已成功用于植物病害的防控[4-5]。李全胜等研究发现,枯草芽孢杆菌S12的发酵液对棉花黄萎病病原大丽轮枝菌具有明显的抑制效果[6];黄秋斌等研究表明,蜡样芽孢杆菌B3-7在大田条件下对小麦纹枯病菌具有良好的防治效果[7];乔俊卿等研究了枯草芽孢杆菌Bs916对番茄青枯病的防治作用,发现菌株Bs916可以影响番茄根表及茎内青枯病菌种群的数量,且对番茄植株具有促生作用[8]。
湖北是我国水稻种植大省,由立枯丝核菌(R.solani)引起的纹枯病是湖北水稻种植区的主要病害。为充分发掘利用水稻田已有的生防微生物资源,筛选出强拮抗水稻纹枯病菌的芽胞杆菌菌株,本研究从水稻田植株周围耕作层土壤中分离并筛选对立枯丝核菌具有抑制作用的芽胞杆菌菌株,为水稻纹枯病的防治和生防制剂的研发提供试验依据。
1 材料与方法
1.1 土样采集
采用5点取样法,采样点位于四川农业大学水稻试验田中,于水稻扬花期采集根际0~20 cm的土样用于分离芽孢杆菌菌株。每个种植小区采集5个点,混匀,共16份土样,保存于-20℃冰箱,备用。
1.2 供试靶标病原菌
供试靶标病原菌为水稻纹枯病强致病力菌株R.solaniAG1 IA,用于筛选生防芽孢杆菌菌株,由四川农业大学水稻研究所植物病理实验室提供。
1.3 培养基
LB培养基:称取10 gNaCl、10 g胰蛋白胨、5 g酵母膏、16g琼脂加入1000mL蒸馏水中溶解,115℃高压灭菌20 min。
LB培养液:LB培养基不加琼脂。
PDA培养基:称取马铃薯240 g去皮,切成1 cm左右方块,加1 000 mL蒸馏水煮沸10 min,过滤,加入葡萄糖10 g、琼脂15 g,115℃高压灭菌20 min。
1.4 芽孢杆菌的分离纯化
每份土样称取1 g置于无菌三角瓶中,加入无菌蒸馏水99 mL,混匀,80℃水浴处理10 min[9],制得土壤悬浮液。根据预试结果,采用10倍稀释法[10],将土壤悬浮液稀释105倍。取105倍稀释液0.5 mL均匀涂布于LB培养基上,重复3次。30℃恒温培养箱中放置2 d,挑取单菌落纯化培养24 h,置于60%甘油中保存,放于-20℃冰箱备用。以上试验均在无菌条件下操作。
1.5 拮抗芽孢杆菌的筛选
采用平板对峙培养法筛选对病原菌有拮抗作用的芽孢杆菌菌株。将靶标菌于PDA培养基上活化,打取菌落边缘直径为6 mm菌饼,倒置于PDA培养基中央,培养24 h后,在距菌饼20 mm处上、下、左、右分别对称点接4株待测芽孢杆菌菌株,重复3皿。于26~28℃培养箱内培养,4 d后观察芽孢杆菌抑菌情况,测量抑菌圈半径并拍照处理。
1.6 拮抗芽孢杆菌菌株的鉴定
1.6.1 形态特征与生理生化特性。参照《常见细菌系统鉴定手册》[11]。
1.6.2 拮抗芽孢杆菌菌株基因组DNA的提取及检测。将纯化的芽孢杆菌菌株接种于LB液体培养基中,150 r/min培养16 h,取1 mL菌液,10 000 r/min离心1 min收集菌体。采用离心柱型细菌基因组DNA提取试剂盒[生工生物工程(上海)有限公司提供]提取菌株DNA,1%琼脂糖凝胶电泳对DNA质量进行检测。
1.6.3gyrB序列分析。以“1.6.2”节中提取的拮抗芽孢杆菌菌株DNA为模板,gyrB-1(TTGRCGGHRGY GGHTATAAAGT)、gyrB-2(TCCDCCSTCAGARTCW CCCTC)为正、反向引物进行PCR扩增菌株的gyrB片段[12],1%琼脂糖凝胶电泳对PCR产物进行检测,送成都擎科生物科技有限公司进行测序。采用BLAST程序,将测序所得序列与GenBank中核酸数据库序列进行同源性比对,利用DNAstar软件中的MegAlign程序将比对结果同源性较高的芽孢杆菌登记菌株序列与所得序列构建系统发育树。
2 结果与分析
2.1 拮抗菌株的筛选结果
从16份土样中共筛选到96株芽孢杆菌菌株,通过平板对峙试验,得到1株抑菌带宽度>5 mm的菌株 Q9-0-1(图 1),5株 4~5 mm的菌株,14株3~4 mm的菌株,26株2~3 mm的菌株,50株0~2 mm的菌株(表1)。
2.2 菌株Q9-0-1的鉴定
2.2.1 菌株Q9-0-1的形态学与生理生化特征。将拮抗芽孢杆菌菌株Q9-0-1在LB琼脂平板上培养24 h后的菌落形态为不规则形,直径2 mm左右,显微黄色,表面有突起或褶皱,产生椭圆形芽孢。其生理生化指标测定结果见表2。

表1 拮抗芽孢杆菌菌株筛选结果
2.2.2 菌株Q9-0-1的gyrB序列分析。PCR扩增后,得到了1 200 bp左右清晰的条带(图2)。经测序,得到了大小为1 080 bp的碱基序列。将所得序列与GenBank中核酸数据库序列进行同源性比对,结果表明,拮抗菌株Q9-0-1与Genbank登记的B.pumilus(AUEM104)、B.pumilus(AUEM12)、B.pumilus(AUES82)、B.pumilus(KYC24)、B.pumilus(ATCC 27142)、B.pumilus(LNXM12)、B.pumilus(NMTD17)、B.pumilus(MZGC1)和B.pumilus(KYC18)9 株菌株的同源性达99%。选取这9株菌株与菌株Q9-0-1构建系统发育树,由图3可知,Q9-0-1与菌株B.pumilus(LNXM12)处于最小分支,亲缘关系最近。结合其形态特征与生理生化测定结果,将其鉴定为短小芽孢杆菌(B.pumilus)[11]。

表2 菌株Q9-0-1的生理生化特性

图1 芽孢杆菌菌珠Q9-0-1(右)对立枯丝核菌的拮抗效果
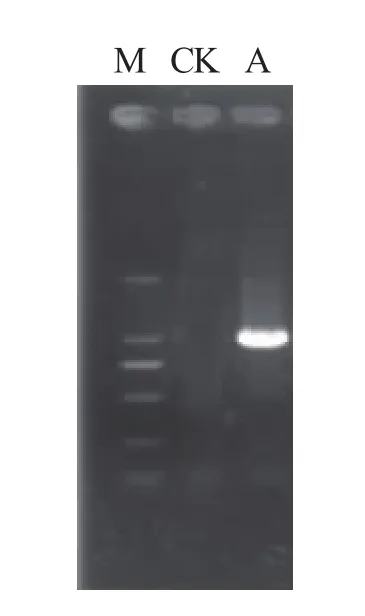
图2 芽孢杆菌菌珠Q9-0-1PCR扩增条带

图3 菌株Q9-0-1的系统发育树
3 讨论
土壤中含有大量的有益微生物资源,部分可以通过人工培养分离获得。本研究从水稻根际分离到96株芽孢杆菌菌株,通过对水稻纹枯病菌的拮抗筛选,得到49株抑菌带宽度大于2 mm的菌株,占分离总数的51%,这些菌株都可以进一步开发利用,有望应用于农作物的生产中。
对细菌的分类鉴定是细菌研究的重要基础性工作之一,16SrDNA序列分析是对细菌进行分子鉴定的标准方法[13]。但是,由于16SrDNA序列具有高度的保守性,其分析鉴定细菌的方法有一定的局限性,难以分辨亲缘关系较近的种[14]。gyrB基因编码DNA促旋酶的β亚单位蛋白,在不改变氨基酸序列前提下,其特有的遗传密码子兼并性可使DNA序列发生较多的变异,gyrB基因序列较非蛋白编码基因16S rDNA更能精确区分和鉴定芽孢杆菌的近缘种。Wang等使用16SrDNA序列分析了8个枯草芽孢杆菌群的系统发育,无法准确区分相似度在98%以上的亚群,而采用gyrB基因序列可精确区分其亚群[15]。
利用有益微生物对植物病虫害进行防控已经成为目前农业生产的趋势,芽孢杆菌属细菌,其因独特的生物学特性更具有广泛的应用前景,已有多种芽孢杆菌制剂成功用于农作物病虫防治中。张学君等报道了生防菌B3制剂对小麦纹枯病具有较好的田间防效[16];枯草芽孢杆菌可湿性粉剂(百抗)可用于水稻纹枯病、三七根腐病、烟草黑胫病的防治,并已推广至多个省份,施用面积达4 667 hm2[17]。本研究筛选到的短小芽孢杆菌Q9-0-1菌株在室内平板条件下对水稻纹枯病菌有较强的拮抗作用,可进一步验证其田间防治效果,为生物农药的开发利用提供了一种有效的菌种资源。
