慢性犬阻塞性睡眠呼吸暂停并发心房颤动模型的构建及对心房电生理和超微结构的影响
2018-07-17孟庆军贾索尔肖克热提王雪生周贤惠汤宝鹏
张 玲, 孟庆军,贾索尔·肖克热提, 李 杨, 王雪生, 周贤惠, 汤宝鹏
(新疆医科大学第一附属医院心脏起搏与心电生理科, 乌鲁木齐 830054)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种上气道阻塞引起的疾病,可引起明显的气道甚至气管的阻塞,是许多心血管疾病的危险因素并和糖尿病、脑卒中等多种疾病相关[1-3]。已有研究显示心房颤动和OSA明显相关[4-9]。OSA可能促进房颤的诱发和维持[10-11], OSA也是房颤转复和射频消融失败的独立因素[5,9]。但其发病机制至今仍未完全阐明,围绕OSA展开的临床和基础研究成为了研究的新热点。如何科学地复制稳定、可靠、接近临床病理生理状态的动物模型成为关键问题。本实验拟通过模拟睡眠呼吸暂停患者的病理生理过程(如上气道塌陷、间歇缺氧)建立OSA相关房颤的慢性动物模型并探讨其对心房电生理及显微结构的影响。
1 材料与方法
1.1实验动物的选择成年比格犬12只,体质量10~15 kg,雄性,由南京亚东实验动物研究中心提供【许可证号SCXK (苏) 2013-0001】。实验设计和操作已通过新疆医科大学第一附属医院使用管理伦理委员会批准(许可证号:IACUC-20130514001)。
1.2实验仪器与试剂LEAD-7000多道电生理记录仪(四川锦江电子科技有限公司),DF-4A型心脏电生理刺激仪(苏州中国东方电子仪器厂),BeneviewT5多功能监护仪(深圳迈瑞生物医疗电子股份有限公司),Aaeon7200A呼吸麻醉机(北京谊安医疗系统股份有限公司),i-STAT300血气分析仪(美国雅培公司)。戊巴比妥钠(Sigma公司,生产批号CAS57-33-0);鹿醒宁注射液(吉林省华牧动物保健品有限公司,规格2 mL:250 mg,生产批号CAS151207);陆眠宁注射液(盐酸赛拉嗪注射液,吉林省华牧动物保健品有限公司,规格2 mL:500mg,生产批号CAS151207);舒泰50注射液(注射用盐酸替来他明盐酸唑拉西泮,法国维克有限公司,生产批号500000000038072)。
1.3犬慢性阻塞性睡眠呼吸暂停动物模型的建立
1.3.1 动物麻醉及准备 所有犬在进行实验前均适应性饲养至少1 w,实验前12 h禁食,6 h禁饮。予以舒泰0.05 mL/kg和速眠新(0.1mL/kg)肌注诱导麻醉,3%的戊巴比妥钠溶液2 mL/h通过输液泵维持麻醉。仰卧位插入气管插管,用以夹闭造成呼吸暂停[12-13]。股静脉插管维持静脉通道,肝素盐水静滴,避免血栓形成。股动脉连于压力换能器,监测血压及采血气,右侧颈静脉用4 F电极插入进右房以测量有效不应期(ERP)。通过lead7000电生理仪持续监测标准体表肢体心电图(Ⅰ、Ⅱ、Ⅲ、aVR、aVL、aVF)。
1.3.2 阻塞性睡眠呼吸障碍模型的建立 实验前予以舒泰0.05 mL/kg和速眠新(0.1 mL/kg)肌注诱导麻醉。仰卧位插入内径7.5 mm气管插管,用绷带固定于上颌。观察睫毛反射消失进行实验。实验中给予3%的戊巴比妥钠溶液2 mL/h维持麻醉(图1)。实验中呼吸暂停通过呼气末用橡皮塞堵住气管插管完成。干预开始,设定第1周的封堵时间为1 min,通气时间为9 min;第2周的封堵时间为1 min,通气时间为8 min;第3周的封堵时间1 min,通气时间为7 min;第4周的封堵时间1 min,通气时间6 min;第5~12周封堵时间1 min;通气时间5 min,直至实验结束。每天在持续麻醉下连续进行4 h,一共持续3个月[14]。
1.4血气分析动脉血气从颈动脉中抽取,分别于造模前,第1、2、3个月末气管夹闭前及夹闭1 min即将结束的即刻采集动脉血测量pH值,二氧化碳分压(PCO2)和氧分压(PO2)。所有的血液样本均在采样后1 min之内测量。

1.5电生理测量分别于干预前及3个月末行颈静脉穿刺下电生理检查,麻醉状态下行右侧颈静脉穿刺,进行电生理检查,测量ERP和房颤诱发率。
心内电生理图的监测下,将电极插至右心房,心内电生理图上出现大A小V波,表示电极插入成功,将电极固定,以高出基础心率20%的频率起搏,测定心房起搏阈值,脉宽设置为0.5 ms。每次气管夹闭前以起搏阈值10倍为输出电压,通过程序刺激S1S2测定心房ERP, S1S2间期每次降低10 ms,接近ERP后逐渐以1 ms降低直至ERP测出。后在气管插管夹闭的1 min期间进行固定间期S1S2刺激,S1S2间期为气管夹闭前ERP数值,每次刺激间隔2 s,直至出现传导反应或AF,后将S1S2间期继续缩短5 ms再行程序刺激直至1 min结束。AF定义为快速而不规则的心房激动,同时,心室呈不规则反应,R-R间期绝对不等,持续超过1 s[12]。所有犬均在高位右房接受程序刺激以测量ERP和AF持续时间。
1.6组织学处理在持续OSA造模12 w后,处死动物,取心肌组织以多聚甲醛固定保存,石蜡切片,利用HE染色、显微镜观察组织的结构和形态改变。透射电镜标本的制备:犬处死后立即取心肌及神经标本,用锋利双刃刀片切成小于1 mm3小块,迅速置于戊二醛和四氧化锇中固定1 h,常规漂洗,丙酮梯度脱水,包埋,采用超薄切片机切片,铅铀双重染色,于透射电镜(JEM-100 CXII)下观察。
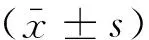
2 结果
2.1动物生命体征的观察OSA建模过程中,所有犬均可发现口唇及舌明显发绀,呼吸暂停并胸腹反常呼吸运动。恢复自主呼吸后,出现呼吸加快,数个呼吸后口唇及舌恢复红润。慢性模型犬非实验阶段早期出现厌食,精神欠佳,营养补充及适应1 w左右,活动正常,反应灵敏,食欲恢复,无体质量减轻,精神状态好,活泼好动。
2.2血气分析结果第1个月末与未干预时,第2个月末与第1个月末,第3个月末与第2个月末气管插管阻塞前的血气比较,PCO2值显著升高,PO2、pH值显著降低(P<0.05)。气管阻塞后各时间段之间比无明显差异(P>0.05)。造模前、第1个月末,第2个月末,第3个月末、气管阻塞后与气管阻塞前比较均出现PCO2值显著升高,PO2、pH值显著降低(P<0.01)。随着造模时间的延长,呼吸暂停的程度逐渐加重。以上结果表明呼吸暂停模型构建成功,见表1。
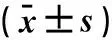
表1 干预前及干预第1、2、3个月末后的动脉血气分析
注: 与呼吸暂停前比较,*P<0.05; 与基础状态比较,◇P<0.05; 与第1个月末比较,△P<0.05; 与第2个月末比较,▲P<0.05。
2.3电生理指标结果在慢性OSA犬模型组,基线状态几乎无房颤发生,随着OSA时间的延长,房颤持续时间明显延长(图2)。OSA造模3个月后较基础状态相比出现ERP的缩短和房颤持续时间的延长(图3)。房颤的持续时间采用连续测量1 h的房颤总持续时间。
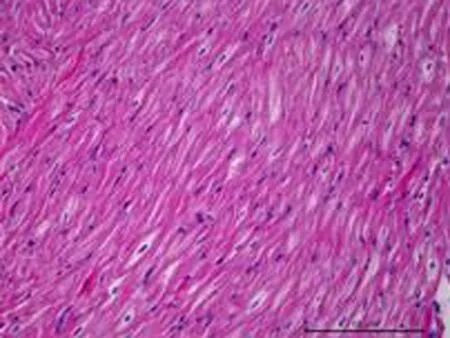
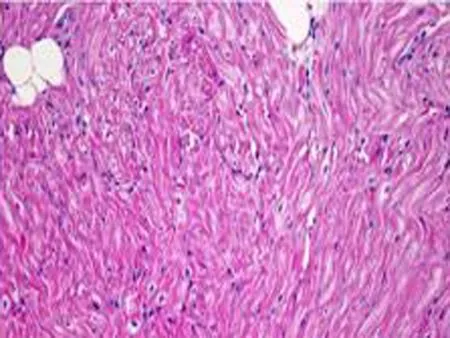
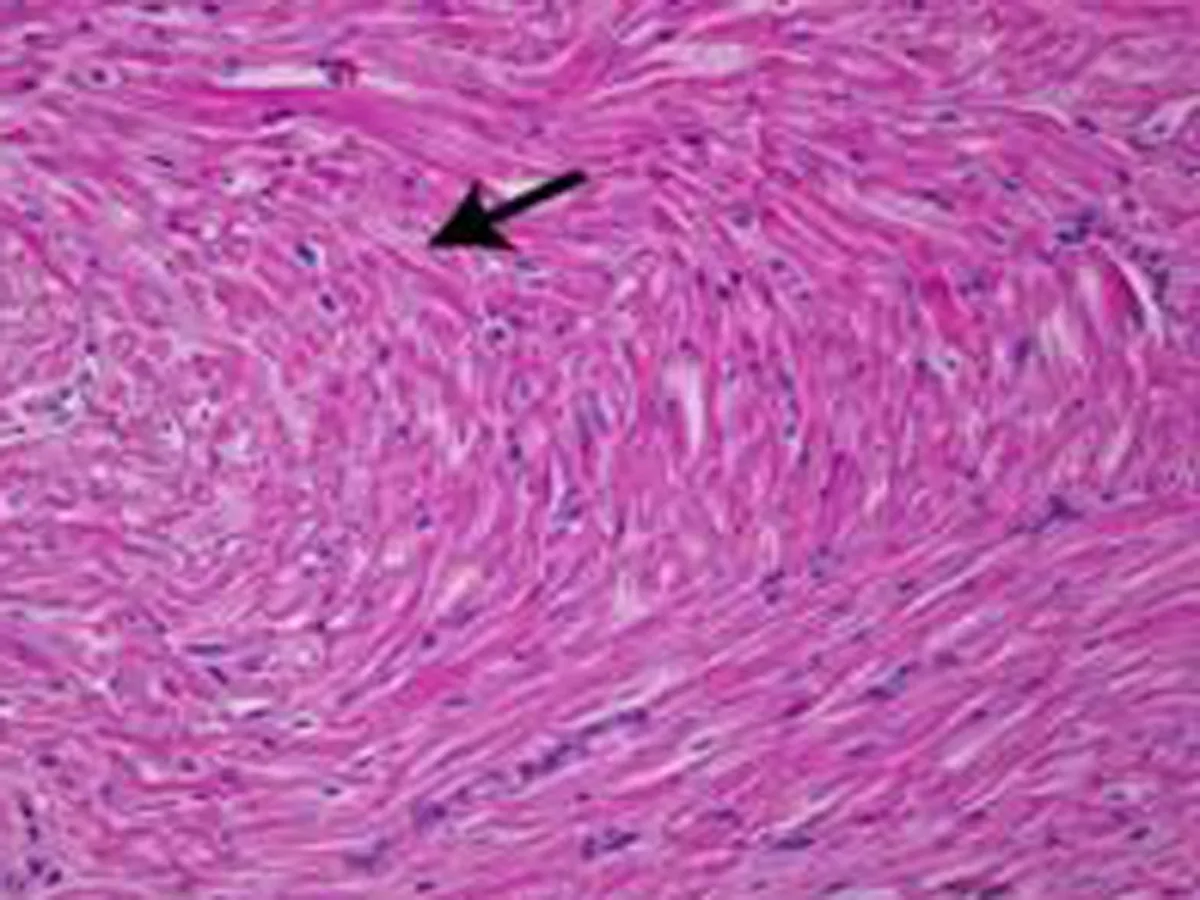
2.4组织学的影响1个月后OSA组即可出现心房肌细胞排列紊乱(图4),随着OSA时间的延长,心房肌结构紊乱明显加重。3个月后可见部分心肌纤维断裂、溶解,坏死部位肌间质线粒体聚集,线粒体大小、形态不一,部分线粒体肿胀,脊膜结构不清晰,部分线粒体萎缩、体积缩小(图5)。
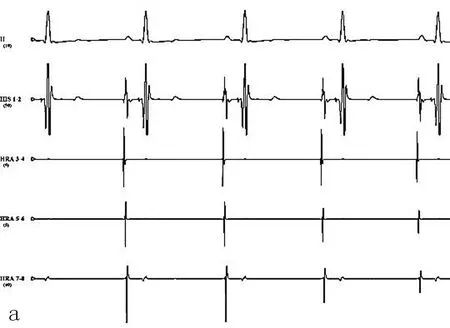
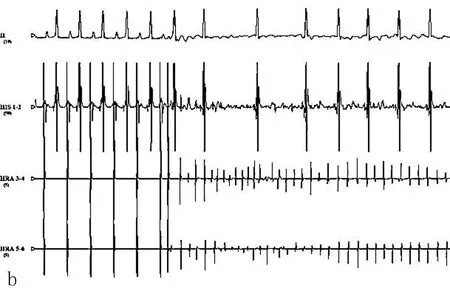
图2 犬在基础状态下电生理图(a)和给予阻塞性呼吸暂停+程序刺激后诱发房颤图(b)
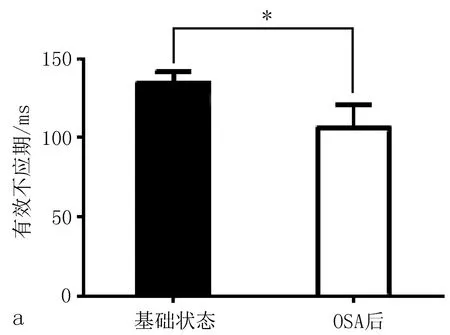

图3 慢性OSA犬模型组,OSA造模3月后较基础状态相比出现ERP的缩短(a)和AF持续时间的延长(b)。
基线状态
1个月末
2个月末

3个月末
图41个月后心房肌细胞即可出现明显排列紊乱,随着OSA时间的延长,心房肌结构紊乱明显加重。

a: 正常心房肌细胞 可见肌纤维排列整齐,肌节结构完整完整,肌纤维间线粒体形态规则、排列齐。

b: OSA造模3个月后部分心肌纤维断裂、溶解,坏死部位肌间质线粒体聚集,线粒体大小、形态不一,部分线粒体肿胀,脊膜结构不清晰,部分线粒体萎缩、体积缩小
图5正常心房肌细胞及OSA造模3个月后心肌细胞
3 讨论
3.1OSA与心房颤动的关系及OSA并发房颤的机制OSA可由反复呼吸道阻塞引起胸内压降低伴左室跨壁压和后负荷增加,伴低氧血症和高碳酸血症,心房扩张结构重构,炎症反应及氧化应激,自主神经张力异常等[15-16],最终引起房颤的发生及维持[17]。房颤患者中OSA的发病率约为35%[11],表明可能促进房颤的发生并参与其维持。但OSA的病理生理机制及OSA伴发房颤的机制尚不清楚。
本实验中动脉血气分析证实有低氧血症和高碳酸血症,pH值降低,且随着OSA 造模时间的延长而逐渐加重。与之前的研究结果一致[12,14],证明造模成功。Ghias等[13]在犬的急性OSA模型中发现在房颤发生前,神经丛活性明显增强,在神经丛消融和给予神经阻滞剂后房颤诱发率明显降低。提示自主神经张力变化是决定房颤发生与否及ERP变化的重要机制。我们实验中也发现呼吸暂停的同时伴随心率减慢及血压降低,在通气的即刻出现血压的骤升和心率增快,提示伴随自主神经张力的明显变化。而这种效应受麻醉深度的影响很大,如麻醉过深神经过度抑制则无电生理指标明显变化,说明相对恒定的麻醉深度且麻醉不宜过深是实验成功的保证。
ERP反映心房有效不应期,ERP延长则房颤不易发生,缩短则更易发生房颤。在本模型中ERP随着呼吸暂停时间的延长逐渐减低,而房颤持续时间则逐渐增加,证实OSA对房颤的发生起着促进作用。并在一些情况下,房颤持续5~10 min以上仍然难以自行终止,给予超速刺激仍难以终止,而给予吸氧后却能迅速终止房颤。提示OSA的治疗有利于房颤的终止。
以往的研究尚无慢性OSA模型的心房肌病理改变的相关研究,我们的研究显示慢性犬OSA模型心房肌结构明显紊乱,部分心肌纤维断裂、溶解,部分线粒体肿胀,脊膜结构不清晰,部分线粒体萎缩、体积缩小。提示OSA引起的组织超微结构的改变是房颤发生的结构基础。
3.2OSA模型的建立建立稳定而适合电生理研究的OSA动物模型是研究疾病病理生理机制及药物干预及其他治疗的基础和条件。基于前期学者们的研究结果,本研究选用犬建模,经验证动物模型稳定,操作简单,可重复性佳。研究建立犬慢性OSA基础上的房颤模型是符合建模标准的,为进一步研究OSA基础上的房颤研究奠定了基础。本研究借鉴Zhao等[14]的方法通过反复给比格犬气管插管,并连续呼吸暂停的方法构建了呼吸暂停模型,以研究慢性OSA模型的电生理特点。慢性OSA模型实验过程中我们观察到动物口唇及舌发绀伴胸腹式反常呼吸运动,呼吸暂停后恢复通气前出现血氧饱和度降低及氧分压降低及二氧化碳分压增加。造模过程中分别对基础,造模1个月、2个月、3个月的动物进行血气测定,证实犬的血氧饱和度逐渐下降,PO2,pH值明显降低,PCO2值明显升高,呼吸暂停次数逐渐增大,这些特征和人OSA的发展过程一致。尤其是反复麻醉和插管并未造成呼吸道的明显感染,实验结束动物清醒后觅食及反应良好,动脉抽血血气及颈静脉穿刺插管电生理检查后无明显出血,无感染。说明模型造模成功,慢性模型稳定,设施相对简单,便于研究开展实施。
根据已有的文献尚无统一的OSA动物模型,以往曾有报道通过低压氧舱造缺氧动物模型[18],或将动物放入密闭容器中,通过持续间歇给予低氧,低通气[19-20],模拟OSA患者的低氧血症,但其需要高压氧仓设备及较难反应正常环境中缺氧情况,且无法模拟OSA状态下反复缺氧-复氧状态。有学者通过气管切开造口并设置气管内活瓣[14],规律打开关闭气道造模,但其阻塞部位在环状软骨之下的气管而非上气道,而OSA 发病机制中的重要机制是上气道狭窄。而适用于电生理研究的动物模型研究较少,我们已完成了兔急性呼吸暂停模型诱发房颤的实验研究,另外学者们进行过犬呼吸暂停模型对犬电生理及心功能的影响的相关研究[21-22],均有模型稳定,重复性好的特点。通过我们的实验方法可构建稳定的慢性OSA伴发房颤犬动物模型,对犬损伤小,设备相对简单,可重复性好,为OSA相关病理生理学研究及OSA相关房颤的病理生理机制研究及可能的治疗策略提供了可靠的模型。
3.3模型的局限性本模型为OSA的进一步电生理、病理生理、药理研究提供了一个稳定的实验模型,但具体的机制研究尚欠缺。此外,本模型是一种麻醉状态下的模型,且白天OSA而夜晚自主呼吸,与临床OSA患者仍有一定差距。
