梗阻性肾病肾组织中磷酸化黏着斑激酶的表达及意义*
2018-07-11陈志李冰晟何垚王朝晖张波杜勇超刘雨杭陈湘
陈志,李冰晟,何垚,王朝晖,张波,杜勇超,刘雨杭,陈湘
(中南大学湘雅医院,湖南 长沙 410008)
肾间质纤维化是梗阻性肾病最显著的病理学特征[1-3],探讨梗阻性肾病引起肾间质纤维化的可能机制和靶点对于梗阻持续存在的情况下如何保护肾功能、在梗阻解除后如何减缓肾间质纤维化、对其他病因肾病的治疗具有意义[1,4-7]。黏着斑激酶(focal adhesion kinase, FAK)可以作为跨膜蛋白亚基整合素β1的胞内连接酶发生自身磷酸化(pFAK)而被激活[8-10],而FAK的下游涉及与纤维化过程相关的多条通路,且由于FAK介导多种脏器纤维化[11],笔者推测FAK可能在梗阻性肾病肾间质纤维化中发挥作用。肌成纤维细胞的形成被认为是肾间质纤维化的关键环节,而α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)作为肌成纤维细胞的标志物[12],在肾间质纤维化研究中被广泛关注[13-14]。本研究通过复制单侧输尿管梗阻(unilateral ureteral obstruction,UUO)的SD大鼠模型,并检测不同时间模型组及假手术组大鼠肾脏中pFAK的表达,及与整合素β1、α-SMA的相关性。
1 材料与方法
1.1 实验动物和分组
健康雄性无特定病原体(specific pathogen free,SPF)级雄性SD(Sprague Dawley)大鼠18只(湖南斯莱克景达实验动物有限公司),体重200~220 g,寄养于中南大学实验动物学部SPF级屏障设备内。温度(22±2)℃,相对湿度(55±2)%,明暗交替12/12 h。大鼠自由摄取水及饲料。大鼠适应性饲养1周后,随机分为假手术组、3 d模型组及14 d模型组3组,每组6只。在所有的实验操作过程中,遵循实验动物的使用原则。
1.2 复制动物模型
模型组行单侧输尿管结扎术:大鼠适应性饲养1周后开始建模,禁食24 h后,以5%水合氯醛0.4 ml/100 g腹腔注射将大鼠麻醉,以俯卧位固定于大鼠手术台,局部剃毛备皮,皮肤消毒,选择左侧背部脊柱旁0.8 cm肾区纵行切口,依次切开各层组织至腹内,游离肾脏、输尿管,将左侧输尿管用玻璃分针挑起,用双丝线结扎左侧输尿管上段靠近肾盂处,于两线之间剪断输尿管。均匀喷涂庆大霉素后依次缝合肌肉、皮下组织及皮肤,络合碘消毒皮肤,酒精拭去切口周围血渍。在手术后,密切关注各组小鼠的情况变化。假手术组:手术入路方式同模型组,游离出左侧输尿管后不结扎。在手术后,密切关注各组小鼠的情况变化。假手术组假手术操作14 d后,2个模型组分别在大鼠输尿管结扎术后3 d和14 d后处死。
1.3 指标检测
1.3.1 免疫组织化学(简称免疫组化)检测pFAK、整合素β1(CD29)、α-SMA 设计不同的时间处死大鼠,切取左侧肾脏组织,一部分10%多聚缓冲甲醛溶液固定24 h,制备切片,免疫组化检测CD29,pFAK,α-SMA的表达。石蜡切片脱蜡去水后滴加适量的胰酶稀释液,置于37℃恒温箱中30 min行抗原修复。PBS液充分洗涤后将切片置入3%过氧化氢溶液,室温及避光下孵育25 min,阻断内源性过氧化物酶。均匀地滴加用3% BSA覆盖组织,室温下封闭30 min。在切片上滴加PBS与按一定比例配好的一抗,湿盒内4℃孵育过夜。后将玻片洗涤后滴加与一抗,相应种属的二抗(HRP标记)覆盖组织,室温孵育50 min。洗涤甩干后在滴加DAB显色液显色。Harris苏木素复染细胞核后脱水封片。用图像分析软件Image Pro Plus 6.0进行分析,根据公式累计光度值/像素点=平均光密度值(optical density, OD),计算OD值,比较各组差异。
1.3.2 Western blot检测 CD29、pFAK、α-SMA 左侧肾脏皮质,一部分放置入冻存管中,液氮保存,利用WB法分别检测假手术组,3 d、14 d模型组的表达情况。组织块用PBS洗涤后剪成小块匀浆,转移离心管振荡并冰浴30 min。11 372 r/min离心10 min,收集上清为样品。BCA法测蛋白浓度后电泳,每孔加50 ng蛋白样品电泳,浓缩胶电压80 V,分离胶电压150 V。电泳结束后转膜,300 mA恒流转膜0.5 h或25 V恒压转膜过夜,将转有蛋白的膜置于5% BSA封闭1 h后,置于Ⅰ抗(CD29,pFAK,α-SMA抗用封闭液1∶1 000稀释,GAPDH作内参照按1∶5 000稀释)中,置4℃冰箱中振荡过夜,1×TBS洗3次,每次10 min。置HRP标记的Ⅱ抗(用封闭液1∶5 000稀释)中孵育2 h,1×TBS洗3次,每次10 min,将ECL-A及ECL-B 1∶1体积比混合,与膜孵育3 min后,吸尽残液,保鲜膜将膜包裹完全,置入暗匣内曝光。使用显影和定影试剂显影和定影。将曝光的底片进行扫描并导出保存图片,图像处理软件整理去色,以GAPDH作为内参,Alpha软件处理系统计算分析目标带的光密度值。条带相对灰度值=目的条带灰度值/同个样品GAPDH灰度值。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,两两比较用SNK-q检验,变量的相关性用Linear correction分析,P<0.05为差异有统计学意义。
2 结果
2.1 各组CD29、pFAK、α-SMA的染色及OD值比较
免疫组化检测结果显示,α-SMA的表达主要在间质,而pFAK及CD29在肾小管上皮细胞及间质均有表达,见图1~3。随着建模时间的延长,pFAK、CD29及α-SMA表达量逐步升高,差异有统计学意义(P<0.05)。见表1。
2.2 各组pFAK、α-SMA及CD29的蛋白表达情况
假手术组肾组织pFAK、α-SMA及CD29表达量低,随着建模时间的延长,pFAK、CD29及α-SMA表达量逐步升高,差异有统计学意义(FpFAK=45.398,PpFAK=0.000;FCD29=23.713,PCD29=0.000;Fα-SMA=43.428,Pα-SMA=0.000)。各组间pFAK、α-SMA及CD29两两比较,差异均有统计学意义(P<0.05)。见图4和表2。
2.3 各组pFAK与α-SMA和CD29的相关性
pFAK与α-SMA成正相关,差异有统计学意义(r=0.852,P=0.000),pFAK与CD29呈正相关,差异有统计学意义(r=0.800,P=0.000)。见图5、6。

图1 各组肾脏组织pFAK的表达 (×400)

图2 各组肾脏组织CD29的表达 (×400)
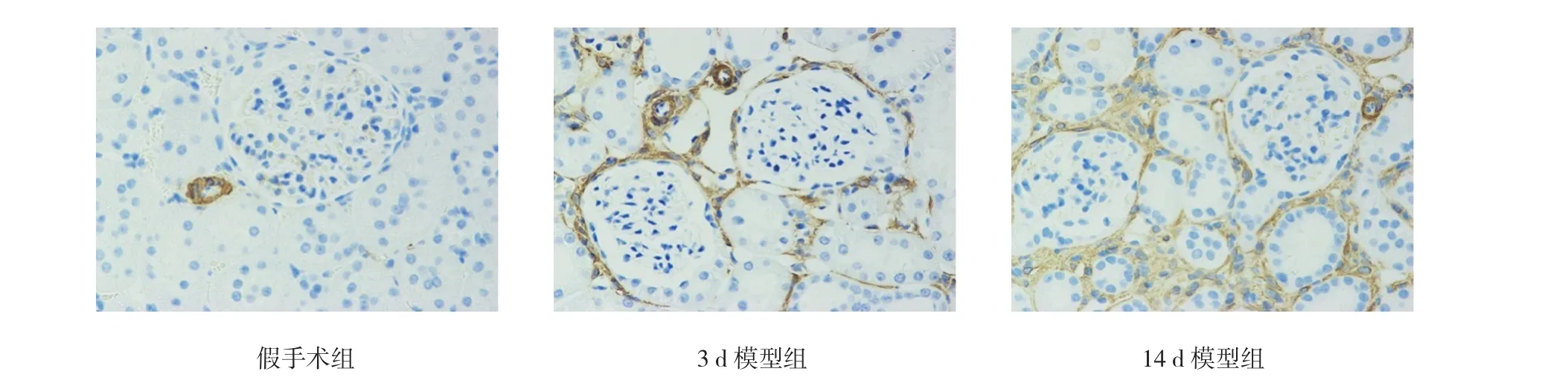
图3 各组肾脏组织α-SMA的表达 (×400)
表1 各组pFAK、CD29、α-SMA表达的OD值 (n=6,±s)

表1 各组pFAK、CD29、α-SMA表达的OD值 (n=6,±s)
注:1)与假手术组比较,P<0.05;2)与UUO 3 d模型组比较,P<0.05
pFAK CD29 α-SMA假手术组 0.001 3±0.000 4 0.001 0±0.0010 0.002 1±0.001 0 3 d模型组 0.004 2±0.000 41)0.003 2±0.00081)0.009 0±0.002 01)14 d模型组 0.007 8±0.000 52)0.018 3±0.00222)0.019 4±0.001 42)组别

图4 各组肾脏组织CD29、pFAK、α-SMA的蛋白表达
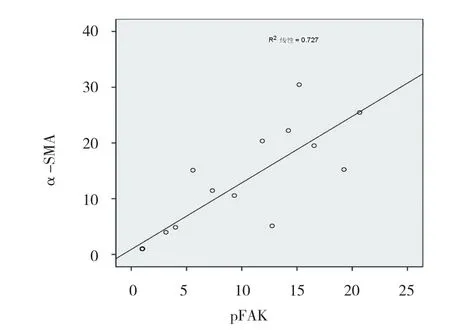
图5 pFAK与α-SMA的相关性
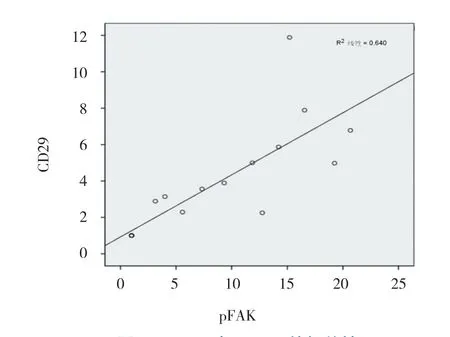
图6 pFAK与CD29的相关性
表2 各组肾脏组织CD29,pFAK,α-SMA的蛋白表达(n=6,±s)

表2 各组肾脏组织CD29,pFAK,α-SMA的蛋白表达(n=6,±s)
注:1)与假手术组比较,P<0.05;2)与3 d模型组比较,P<0.05
组别 pFAK CD29 α-SMA假手术组 1 1 1 3 d模型组 7.02±3.591)3.00±0.661)8.52±4.511)14 d模型组 16.29±3.262)7.07±2.612)22.21±5.252)
3 讨论
FAK是一种酪氨酸激酶,被磷酸化以后活化。FAK可与整合素β1或作为细胞因子受体RTKs(受体酪氨酸激酶)下游激酶在Tyr397位点被磷酸化,进而激活其他的磷酸化位点[15]。Tyr397磷酸化的FAK可以与多种含SH2结构域的蛋白质分子相结合,如src家族、细胞信号抑制因子、生长因子连接蛋白、多种激酶等,从而产生各种生物学效应[16]。
本实验通过体内实验UUO大鼠模型发现梗阻性肾病肾组织pFAK表达升高,且随处理时间增加而升高。且发现在梗阻性肾病肾间质纤维化模型中pFAK的表达与α-SMA表达呈正相关。α-SMA是ACTA2基因编码的蛋白质,是参与细胞运动,结构和完整性的高度保守的蛋白质[17]。肌成纤维细胞的生成是纤维化过程的重要环节,研究显示肌成纤维化能力是成纤维细胞的4~6倍,而α-SMA通常被看成肌成纤维细胞形成的标志物[12]。本实验通过体内实验UUO大鼠模型发现梗阻性肾病肾组织α-SMA表达升高,且基本趋势为随处理时间增加而升高,从免疫组化图片可看到α-SMA主要表达于肾小管周围间质,这些均与现有研究一致,辅证造模成功,及梗阻性肾病的确存在肌成纤维细胞生成增加这一纤维化过程中的重要环节。而在梗阻性肾病肾间质纤维化模型中pFAK的表达与α-SMA表达呈正相关,提示FAK在在梗阻性肾病肾间质纤维化过程中发挥促进作用,有可能是通过促进形成肌成纤维细胞而发挥作用。
通过相关性分析,同样发现在梗阻性肾病肾间质纤维化模型中pFAK的表达与整合素β1(CD29)表达呈正相关。整合素是广泛的细胞表面黏附和信号分子,由α-亚基和β-亚基组成,将细胞内骨架连接到细胞外基质,并双向跨膜传递信号。在整合素家族成员中,整合素β1是最关键的,因为整合素β1可以与不同α亚基配对,使其成为不同刺激因子的受体。整合素β1可以作为力传感器,将机械刺激转化为生化信号[18]。在正常条件下,整合素对维持细胞内稳态至关重要,可以启动多条信号通路,其中一些信号通路主要与细胞迁移和细胞黏附相关,而另一些信号传递调节细胞分化、增殖、存活和凋亡。整合素β1介导细胞外基质合成,纤维化相关细胞转化激活[18-19],与包括阻塞性肾病等不同病因所致多种肾脏纤维化有关[20-22]。逆行压力增加引起的肾小管上皮及间质细胞的机械拉伸在阻塞性肾病过程中被认为是非常显著的,本研究显示UUO模型中整合素β1表达上调,且在梗阻性肾病肾间质纤维化模型中pFAK的表达与整合素β1表达呈正相关,结合文献,提示FAK可能是作为整合素β1的下游[10-11],在梗阻性肾病肾间质纤维化过程中发挥促进作用。
