SIRT3与NANOG在前列腺癌中表达情况的初步研究
2018-07-09李荣全亦周夏伟梁上海交通大学生物医学工程学院上海200030
李荣,全亦周,夏伟梁上海交通大学生物医学工程学院(上海,200030)
前列腺癌是男性常见的恶性肿瘤,在北美等发达国家前列腺癌发病率和死亡率占据男性恶性肿瘤的第一位和第三位[1]。随着我国国民生活水准的提高、 饮食变化及寿命的延长,前列腺癌新增患者每年以6~7万人次的速度增加[2]。随着病程恶化,部分病人发生前列腺癌转移。肿瘤干细胞依赖于活跃的基因网络,通过对称分裂使其具有自我更新能力,也可通过随机事件或者响应环境信号进行不对称分裂或分化[3]; 有科研人员认为,肿瘤干细胞是肿瘤生长和进化的驱动程序,可维持肿瘤细胞增殖和肿瘤进程的恶化[4],提出肿瘤干细胞可能是肿瘤的源头细胞,也是治疗肿瘤的重要靶点。因此针对前列腺癌的研究,很多研究人员将关注点放在前列腺癌干细胞上,以期更好地探索前列腺癌的发生发展进程,最终为患者提供更好的治疗效果[5]。
目前,报道较多的肿瘤干细胞的标志物为CD44,OCT4,NANOG等[6],在前列腺癌干细胞研究中,Gong等[7]提出NANOG可能有助于前列腺癌干细胞维持自我更新,可作为未来前列腺癌干细胞分离和鉴定的一个标志; Jeter等[8]提出NANOG可促进前列腺癌干细胞特性,促进前列腺癌对雄激素缺乏的抵抗力。此外,本实验室前期研究发现一种依赖于 NAD+的组蛋白去乙酰化酶,SIRT3,可在前列腺癌中抑制PI3K-Akt通路引起c-MYC的不稳定,抑制前列腺癌细胞增殖[9]。
因此,本研究在前列腺癌细胞系和前列腺癌病人样本中检测SIRT3与NANOG表达水平,挖掘二者相关性,以期SIRT3能够为未来前列腺癌干细胞的研究奠定基础。
1 材料与方法
1.1 材料
人源前列腺癌细胞系LNCap,22RV1,C42B,DU145和PC3由ATCC中心提供。前列腺癌病人样本石蜡切片由萧山第一人民医院提供。
DMEM培养基购于美国Hyclone公司,胎牛血清购于美国Gibco公司,驴血清和二抗购于美国Jackson Lab公司,BCA蛋白浓度测定试剂盒和蛋白酶抑制剂购于美国Thermo公司,SIRT3和NANOG抗体购于美国Cell Signaling公司,H2O2购于上海生工生物技术有限公司,DAPI和抗荧光淬灭封片剂购于中国碧云天公司,RIPA细胞裂解液购于美国Millipore公司,NC膜购于美国GE公司。
1.2 方法
1.2.1基因芯片数据库挖掘
本研究涉及的基因芯片数据库主要为Oncomine和cBioportal,根据肿瘤种类搜索分析相关基因表达情况和相关性。
1.2.2免疫荧光染色
前列腺癌病理石蜡切片经过二甲苯和梯度酒精脱蜡后,在湿盒里滴加3 % H2O2于组织上避光孵育10 min,PBS清洗三次。使用10 %驴血清封闭1 h后,一抗4 °C孵育过夜; 第二天回收一抗,室温孵育荧光二抗和DAPI 1 h。在方形载玻片上滴加适量抗荧光淬灭剂,盖上圆玻片,用透明指甲油封片,室温下晾干,拍照分析。
1.2.3细胞培养
将人源前列腺癌细胞系培养在含10 %胎牛血清和1 %青链霉素的DMEM培养基里,将细胞培养皿放置在含37 °C,5 % CO2的恒温培养箱里。
1.2.4免疫蛋白印迹(Western Blot)
RIPA裂解细胞后收集细胞蛋白样本,使用BCA蛋白定量试剂盒测定蛋白浓度。取30 μg蛋白,加入适量6 × Loading Buffer,95 °C热激变性5 min后进行SDS-PAGE电泳分离。电泳分离后将蛋白样品转移至0.45 μm NC膜,转膜结束后,将NC膜放入含有5 %脱脂奶粉的1 × TBST溶液中封闭1 h。加入相应一抗,摇床4 °C孵育过夜,第二天回收一抗,用1 × TBST溶液清洗三次; 加入对应二抗,摇床室温孵育1 h,用1 × TBST溶液清洗三次。配置显影液将其加到NC膜上,并在凝胶成像系统中曝光显色,再进行后续分析。
1.2.5数据分析
使用Image J进行免疫蛋白印迹定量分析,使用Graphpad Prism和SigmaPlot进行数据分析,组内比较时使用t检验,相关性分析使用回归分析,P<0.05认为具有统计学意义,*代表P<0.05,**代表P<0.01,***代表P<0.001。
2 结果
(1)通过挖掘肿瘤基因芯片数据库Oncomine检测前列腺癌病人样本, 本实验室前期研究发现相比于正常前列腺组织, SIRT3在前列腺癌病人样本中表达较低[9]; 本研究使用同样方法检测NANOG在前列腺癌病人样本中表达情况。如图1, 本研究发现相比于正常前列腺组织, NANOG在前列腺癌病人样本中mRNA水平较高, 其中正常前列腺人群样本为29, 前列腺癌病人样本为131。此外, 我们调研文献发现Miyazawa等[10]在前列腺癌病人样本中通过免疫组织化学染色检测NANOG表达情况:发现相比于正常组织, NANOG在前列腺癌病人样本中表达较高, 见图1。
(2)本研究继续挖掘肿瘤基因芯片数据库cBioportal检测SIRT3和NANOG在前列腺癌病人样本中表达情况, 如图2所示。
二者在mRNA水平上表达呈一定程度负相关关系, 经回归分析R值为-0.47。此外, 通过免疫荧光染色在前列腺癌病理石蜡切片中检测SIRT3和NANOG表达, 如图3所示。我们发现在正常前列腺组织中SIRT3表达较高, 而在前列腺癌病人组织中NANOG表达较高。进一步揭示SIRT3与NANOG表达在前列腺癌组织中呈负相关的关系。
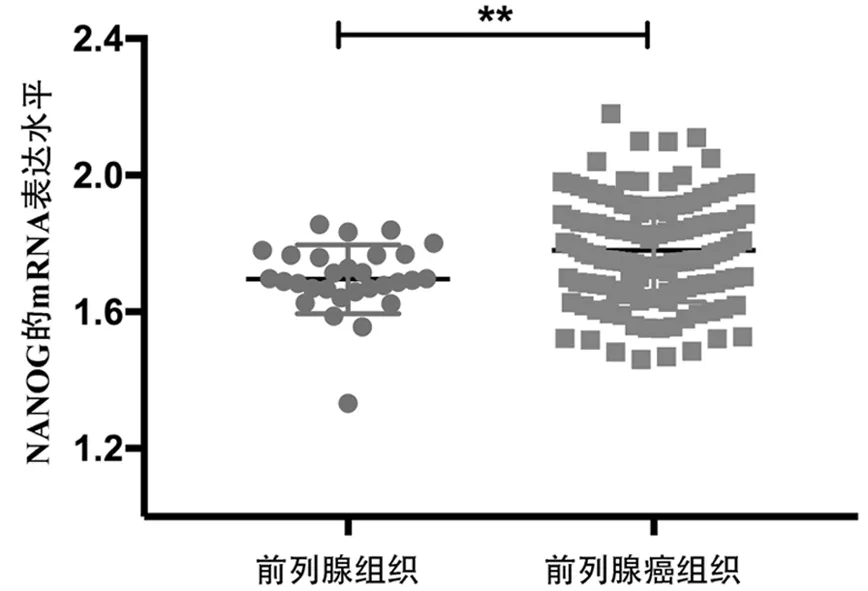
图1 Oncomine数据库中NANOG在正常前列腺和前列腺癌病人样本中mRNA表达水平(Taylor Prostate Statistics,n=160,**P<0.01,Student's t-test)。Fig.1 The mRNA level of NANOG in prostate gland and prostate carcinoma samples selected from oncomine (Taylor Prostate Statistics, n=160, **P<0.01, Student's t-test).
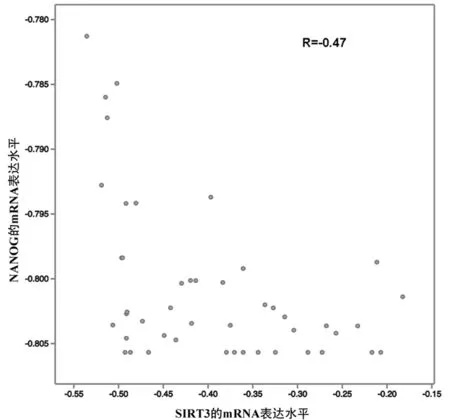
图2 SIRT3和NANOG在前列腺癌病人样本中mRNA表达水平相关性(Neuroendocrine Prostate Cancer (Trento/Cornell/Broad 2016),cBioportal数据库,n=45,Regression Analysis)
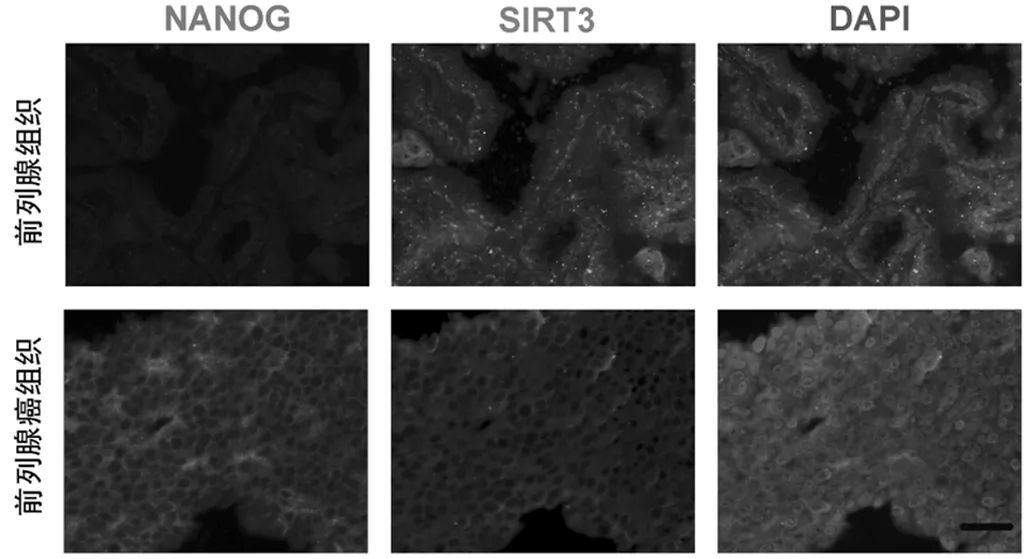
图3 SIRT3和NANOG在前列腺组织以及前列腺癌样本中的表达情况(Bar=50 μm)
(3)更深入地研究,在前列腺癌细胞系LNCap,22RV1,DU145,PC3和C42B中通过Western Blot检测SIRT3和NANOG本底蛋白表达水平,如图4所示。经过线性回归分析,SIRT3和NANOG本底蛋白表达水平呈负相关关系,且R2为0.357 5,如图4(b)所示,经线性回归分析,二者具有一定相关性。
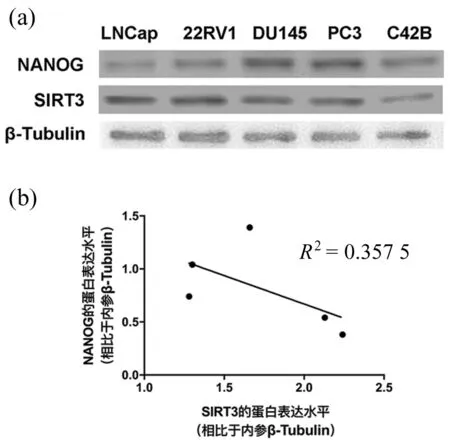
图4 SIRT3和NANOG在前列腺癌细胞系中蛋白表达情况Fig.4 The protein level of SIRT3 and NANOGin prostate cancer cells
3 讨论
将肿瘤干细胞进行体外移植可产生相同的癌组织, 因此肿瘤干细胞是形成不同分化程度的肿瘤细胞和促进肿瘤细胞增殖的根源, 肿瘤干细胞理论认为, 肿瘤组织是不均一的, 肿瘤组织中只有很少一部分肿瘤细胞具有治瘤的潜能[11]。而前列腺癌临床特征为前列腺组织不均一、 激素治疗可杀死大部分癌细胞而总有一小部分癌细胞存活下来, 随着时间推移, 这些存活下来的细胞可长出新的具有耐药性和高转移潜力的肿瘤细胞[12]。因此前列腺癌干细胞为临床上经雄激素治疗无效后, 产生的雄激素非依赖性和前列腺癌复发转移等现象提供了合理的解释, 针对前列腺癌干细胞的研究和治疗也显得尤为重要。
前列腺癌干细胞标志物是存在于干细胞表面和细胞内的抗原小分子。近年来, 科研人员提出肿瘤干细胞标志物NANOG在前列腺癌进程中扮演重要角色。Miyazawa等在前列腺癌病人样本中通过免疫组织化学染色检测四种肿瘤干细胞表面标志物——NANOG, OCT4, CD133和NESTIN, 发现NANOG表达最高, 并且随着Gleason分级越高NANOG表达越高[10]; Jeter等[13]提出NANOG可通过动态抑制AR/FOXA1信号轴重组前列腺癌细胞去势抵抗。此外, 结合本实验室前期研究发现SIRT3破坏癌基因c-MYC稳定性抑制前列腺癌细胞增殖, 其中c-MYC已被报道参与调控前列腺癌干细胞进程:Li等[14]提出SREBP-2与c-MYC相互作用激活c-MYC转录活性促进前列腺癌细胞干性维持, 进而促进肿瘤转移; Yun等[15]提出DAB2IP可抑制c-kit-PI3K-Akt-mTOR通路上调c-MYC蛋白表达, 进而激活ZEB1调节前列腺癌细胞干性特性; Vyas等[16]提出c-MYC参与莱菔硫烷抑制前列腺癌干细胞特性维持的过程。而作为调控干细胞的重要基因, c-MYC和NANOG二者之间亦有诸多报道:Marzi等[17]提出NANOG, KLF4和 c-MYC转录回路参与肝癌细胞重编程进程; c-MYC和NANOG都可参与诱导形成多功能干细胞[18-19]。基于此, 本研究通过挖掘基因芯片数据库和应用免疫荧光染色和免疫蛋白印迹等实验方法检测分析前列腺癌病人样本和前列腺癌细胞系里SIRT3与NANOG表达情况, 分析揭示二者表达负相关的关系, 提示SIRT3可能参与前列腺癌干细胞干性维持、 体内成瘤等众多进程, 为未来临床治疗前列腺癌提供新的思路。在后续的实验中需进行深入的功能研究, 探索SIRT3在前列腺癌干细胞临床应用中的价值。
[1] Siegel R L, Miller K D, Jemal A. Cancer Statistics,2017[J]. CA Cancer J Clin,2017,67(1):7-30.
[2] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-32.
[3] Mateo F, Fernandez P L, Thomson T M. Stem cells in prostate cancer [J]. Arch Esp Urol,2013,66(5):475-86.
[4] Jaworska D, Krol W, Szliszka E. Prostate cancer stem cells: research advances [J]. Int J Mol Sci,2015,16(11):27433-27449.
[5] Feitelson M A, Arzumanyan A, Kulathinal R J, et al. Sustained proliferation in cancer: Mechanisms and novel therapeutic targets [J]. Semin Cancer Biol,2015,35(Suppl):S25-S54.
[6] Vlashi E, Pajonk F. Cancer stem cells, cancer cell plasticity and radiation therapy [J]. Semin Cancer Biol,2015,31:28-35.
[7] Gong C, Liao H, Guo F J, et al. Implication of expression of Nanog in prostate cancer cells and their stem cells [J]. J Huazhong U Sci Med,2012,32(2):242-246.
[8] Jeter C R, Liu B, Liu X, et al. NANOG promotes cancer stem cell characteristics and prostate cancer resistance to androgen deprivation [J]. Oncogene,2011,30(36):3833-3845.
[9] Quan Y Z, Wang N T, Chen Q Q, et al. SIRT3inhibits prostate cancer by destabilizing oncoprotein c-MYC through regulation of the PI3K/Akt pathway [J]. Oncotarget,2015,6(28):26494-26507.
[10] Miyazawa K, Tanaka T, Nakai D, et al. Immunohistochemical expression of four different stem cell markers in prostate cancer: High expression of NANOG in conjunction with hypoxia-inducible factor-1alpha expression is involved in prostate epithelial malignancy [J]. Oncol Lett,2014,8(3):985-992.
[11] Wang T, Shigdar S, Gantier M P, et al. Cancer stem cell targeted therapy: progress amid controversies [J]. Oncotarget,2015,6(42):44191-206.
[12] Wang Z A, Shen M M. Revisiting the concept of cancer stem cells in prostate cancer [J]. Oncogene,2011,30(11):1261-71.
[13] Jeter C R, Liu B, Lu Y, et al. NANOG reprograms prostate cancer cells to castration resistance via dynamically repressing and engaging the AR/FOXA1signaling axis [J]. Cell Discov,2016,2:16041.
[14] Li X, Wu J B, Li Q, et al. SREBP-2promotes stem cell-like properties and metastasis by transcriptional activation of c-Myc in prostate cancer [J]. Oncotarget,2016,7(11):12869-84.
[15] Yun E J, Baek S T, Xie D, et al. DAB2IP regulates cancer stem cell phenotypes through modulating stem cell factor receptor and ZEB1[J]. Oncogene,2015,34(21):2741-2752.
[16] Vyas A R, Moura M B, Hahm E R, et al. Sulforaphane Inhibits c-Myc-Mediated Prostate Cancer Stem-Like Traits [J]. J Cell Biochem,2016,117(11):2482-2495.
[17] Marzi I, Cipolleschi M G, D’Amico M, et al. The involvement of a Nanog, Klf4and c-Myc transcriptional circuitry in the intertwining between neoplastic progression and reprogramming [J]. Cell Cycle,2013,12(2):353-364.
[18] Takahashi K,Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors [J]. Cell,2006,126(4):663-676.
[19] Sotthibundhu A, McDonagh K, von Kriegsheim A, et al. Rapamycin regulates autophagy and cell adhesion in induced pluripotent stem cells [J]. Stem Cell Res Ther,2016,7(1):166.