生后不同间隔时间异氟烷处理对大鼠成年后认知功能的影响
2018-07-09邓城旗杨静房晓燕郝济伟张庆红孟令超唐家广李萌萌
邓城旗,杨静,房晓燕,郝济伟,张庆红,孟令超,唐家广,李萌萌
随着医疗技术的发展,越来越多的婴幼儿接受手术麻醉。目前研究显示,全身麻醉药物对生后发育期大脑可产生短暂或长期的影响[1-3]。2016年底,美国食品与药品管理局(FDA)发布警示:3岁以下儿童或妊娠后3个月的孕妇在手术或操作过程中反复或长期使用全身麻醉和镇静药物可能会影响儿童的大脑发育[4]。对于那些需要多次手术麻醉的婴幼儿,调整手术间隔时间能否减弱或消除多次麻醉对认知功能造成的影响目前尚不明确。本课题组既往研究发现,多次异氟烷处理对发育期大鼠随后的认知功能存在一定影响,延长间隔时间可缓解短期的认知损害[5-6]。本研究进一步观察了生后多次异氟烷处理对发育期大鼠成年后空间认知功能的影响,探索能否通过改变手术治疗的间隔时间保护成年后的认知功能,以期为临床制定合理的诊疗方案提供参考。
1 材料与方法
1.1 实验动物及分组 生后7d的SD大鼠48只,购自北京协和医院动物实验室,合格证编号:11401300014294。采用随机数字表法将大鼠分为Naive组、G6h组、G2h-1d和G2h-3d组,每组12只,雌雄比为5:7。实验前测量幼鼠体重,然后置于透明有机玻璃麻醉诱导盒中,Naive组幼鼠自由呼吸空气6h;G6h组幼鼠采用异氟烷处理6h;G2h-1d组幼鼠采用异氟烷处理,每次2h,每次间隔1d,共处理3次;G2h-3d组幼鼠采用异氟烷处理,每次2h,每次间隔3d,共处理3次。
本实验方案通过本院动物伦理委员会批准,动物处置过程中所有操作均符合动物伦理学标准。
1.2 异氟烷处理[5]应用实验动物麻醉机(美国MATRX公司),以3%异氟烷(山东鲁南贝特,生产批号64140302)诱导,1.5%异氟烷与30%氧气混合吸入维持麻醉。监测幼鼠呼吸频率,每15min夹尾确认其存活,采用ALC-HTP动物恒温系统(上海奥尔科特)维持幼鼠体温在36.5±0.5℃,开启CO2吸附器吸收废气。
1.3 检测指标及方法 于大鼠生后7、21、98d测量体重,观察其发育情况。麻醉后每组取1只幼鼠采集心脏血进行血气分析;然后饲养至成年。在91、98、119d分别进行旷场实验、八臂迷宫及Morris水迷宫行为学测试。应用EthoVision XT软件跟踪轨迹系统(荷兰Noldus公司)记录大鼠的行为学表现。
1.3.1 旷场实验[7]将大鼠放置于场地中央,实时摄像记录其5min的行为,应用EthoVision XT软件分析中央区域(半径≤5cm)耗时、周边区域(半径>5cm)耗时、角落区域耗时、穿梭中央区域次数、速度及总路程,以评价大鼠的探索、焦虑及自主行为等。
1.3.2 八臂迷宫测试[5,8]用于评估大鼠的空间记忆能力。采用成年大鼠迷宫(长425mm,宽145mm,高225mm)进行测试,分为以下3步。①适应阶段:大鼠放入迷宫中央平台适应2min后,依次打开八臂阀门,让其自由摄食;②训练阶段:随机选取四臂的前、中、后放置巧克力,待大鼠吃完或10min后将其取出,乙醇去除异味,每日1次,连续5d;③测试阶段:选定训练时的四臂末端放入巧克力,以大鼠吃完或耗时10min作为测试结束,每日2次,间隔1h以上,连续5d,共10次。记录大鼠在迷宫中表现,包括错误次数[指大鼠进入不曾放过食粒的臂,也称参考记忆错误(reference memory error,RME),反映动物的长期记忆]、重复错误次数[指在同一次测试中大鼠再次进入已经吃过食粒的臂,也称工作记忆错误(working memory error,WME),反映动物的临时记忆]、入臂总次数(指动物吃完所有食物进入臂的总次数)和入臂总耗时(指动物吃完所有食粒所用时间或10min测试结束)。
1.3.3 Morris水迷宫测试[5,9]用于评价大鼠与空间学习记忆相关的脑区功能,测试分为以下3步。①环境适应:大鼠在水迷宫实验室自由摄食饮水,每日2h;②定位航行训练:水温维持在26±1℃,将大鼠头朝池壁放入水中,随机取东、西、南、北4个方向之一,每日4次,间隔15~20min;③空间探索测试:大鼠由原平台对侧象限放入池中1min,记录大鼠进入各象限耗时、平台潜伏期、穿梭平台次数、平台耗时和速度。
1.4 统计学处理 应用SPSS 13.0软件进行统计分析。计量资料以±s表示,多组间比较采用完全随机方差分析,进一步两两比较采用LSD-t检验和Dunnett t检验;计数资料以大于或小于中位数的率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠一般情况 随日龄增长,各组大鼠体重增加,组间及组内雌/雄成鼠体重比较均无明显差异(P>0.05),而98d时雄鼠体重明显高于雌鼠,差异有统计学意义(P<0.001),提示生后发育期不同方式异氟烷处理对大鼠生长发育无明显影响,成年后雄鼠体重高于雌鼠,符合正常生理状况[10]。发育期异氟烷处理后,各组间雌/雄幼鼠血气分析指标比较均无明显差异(P>0.05),提示异氟烷处理未导致幼鼠出现低氧血症、高二氧化碳血症等,排除其可能的影响。
2.2 旷场实验结果 与Naive组相比,各处理组大鼠在旷场实验中的表现均无明显差异,不同性别大鼠的旷场实验表现中的比较亦无明显差异(P>0.05,表1),提示发育期异氟烷处理对大鼠成年后焦虑、探索等自主行为无明显影响。
表1 发育期不同方式异氟烷处理对成年大鼠旷场实验结果的影响 (±s)Tab. 1 Effects of neonatal isoflurane exposures in different ways on the results of open field tests in adult rats (±s)
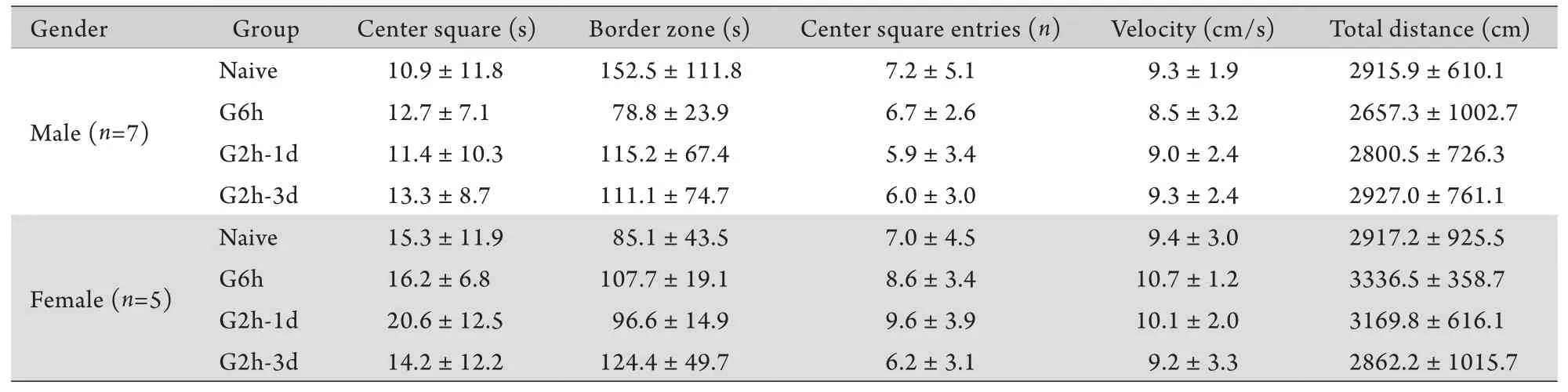
表1 发育期不同方式异氟烷处理对成年大鼠旷场实验结果的影响 (±s)Tab. 1 Effects of neonatal isoflurane exposures in different ways on the results of open field tests in adult rats (±s)
?
2.3 八臂迷宫测试结果
2.3.1 对成年雄鼠的影响 成年雄鼠错误次数>3的百分比由低到高依次为G2h-3d组、Naive组、G6h组、G2h-1d组,分别为21.4%、34.3%、50.0%、50.0%。与Naive组比较,G6h组和G2h-1d组错误次数>3的百分比明显增高,差异有统计学意义(P=0.043、P=0.043),而Naive组与G2h-3d组比较差异无统计学意义(P=0.090)。各处理组间比较,G6h组、G2h-1d组错误次数>3的百分比明显高于G2h-3d组(P<0.001,图1A)。成年雄鼠重复错误次数各组间比较,差异无统计学意义(P>0.05,图1B)。各组成年雄鼠入臂总次数(以>7的百分比表示)比较,G6h组明显高于Naive组(P=0.042),而G6h组和G2h-1d组明显高于G2h-3d组(P=0.003、P=0.008,图1C)。与其余3组比较,G2h-3d组入臂总耗时明显缩短,差异有统计学意义(P<0.001、P<0.001、P=0.030,图1D)。提示发育期不同方式异氟烷处理对成年后雄鼠的空间认知能力有一定影响,单次长时间和间隔较短的异氟烷多次处理,对成年后雄鼠的长期记忆均有损害,而延长处理间隔时间可明显减轻雄鼠空间认知能力的损害。
2.3.2 对成年雌鼠的影响 与Naive、G2h-1d和G2h-3d组比较,G6h组成年雌鼠错误次数>3的百分比明显降低,差异有统计学意义(P=0.008、0.024、0.008,图2A)。G6h组成年雌鼠重复错误次数明显低于Naive、G2h-1d和G2h-3d组,差异有统计学意义(P=0.005、0.000、0.046),且G2h-3d组明显低于G2h-1d组(P=0.024,图2B)。G6h组入臂总次数(以>8的百分比表示)为6%,明显低于Naive、G2h-1d和G2h-3d组(分别为32%、30%和26%),差异有统计学意义(P=0.001、0.002、0.006,图2C)。G6h组入臂总耗时也明显低于Naive、G2h-1d和G2h-3d组,差异有统计学意义(P=0.000、0.006、0.039,图2D)。提示发育期单次异氟烷处理6h对雌鼠成年后的空间认知能力可能具有促进作用,但多次异氟烷处理对雌鼠成年后的临时记忆有一定损害,延长处理间隔时间可减弱对成年后临时记忆的影响。
2.3.3 不同性别成年大鼠八臂迷宫测试结果比较
Naive组中雌鼠错误次数>3的百分比和入臂总次数>7的百分比均明显高于雄鼠,差异有统计学意义(P=0.031、0.000),而G6h组中雌鼠则明显低于雄鼠,差异有统计学意义(P=0.016、0.041,图3A、C)。G2h-1d组雌鼠重复错误次数明显高于雄鼠,差异有统计学意义(P=0.010,图3B)。G2h-3d组雌鼠在错误次数>3的百分比和入臂总次数(以>7的百分比表示)均明显高于雄鼠,差异有统计学意义(P=0.000、0.000,图3A、C)。Naive和G6h组雌鼠入臂总耗时明显低于雄鼠(P=0.023、0.000,图3D)。提示大鼠成年后,雄鼠的空间认知功能明显优于雌鼠;发育期单次异氟烷处理6h对雄鼠成年后的空间认知功能有一定损害,而多次异氟烷处理对雌鼠成年后的空间记忆损害作用更为明显。
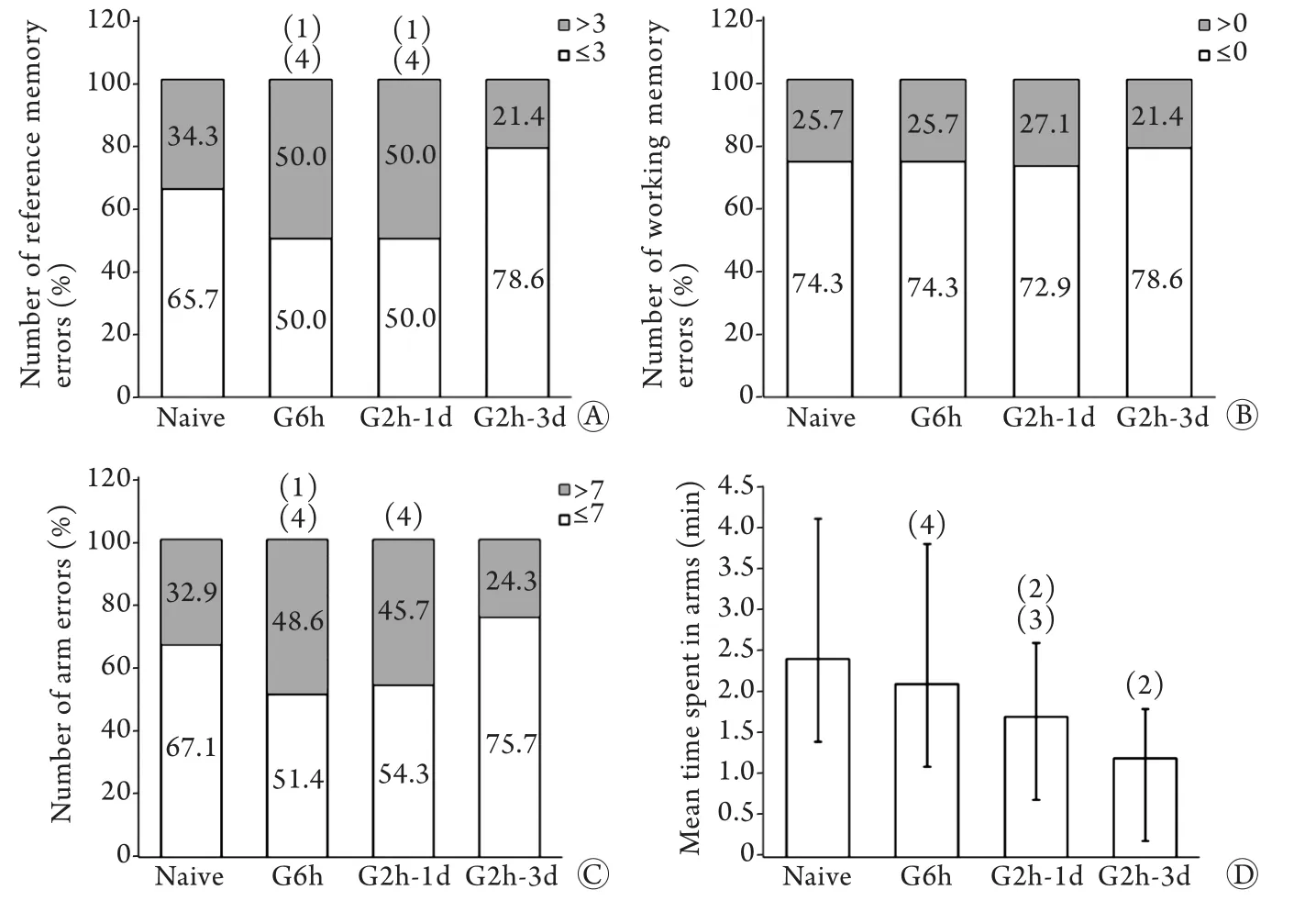
图1 发育期不同方式异氟烷处理对成年雄鼠八臂迷宫测试结果的影响Fig.1 Effects of neonatal isoflurane exposures in different ways on the results of radial arm maze test in adult male rats(1)P<0.05, (2)P<0.01 compared with Naive group; (3)P<0.05, (4)P<0.01 compared with G2h-3d group

图2 发育期不同方式异氟烷处理对成年雌鼠八臂迷宫测试结果的影响Fig. 2 Effects of neonatal isoflurane exposures in different ways on the results of radial arm maze test in adult female rats(1)P<0.05, (2)P<0.01 compared with Naive group; (3)P<0.05, (4)P<0.01 compared with G6h group; (5)P<0.05 compared with G2h-1d group

图3 发育期不同方式异氟烷麻醉对大鼠八臂迷宫影响的性别差异Fig. 3 Gender differences on the effects of neonatal isoflurane exposures in different ways on the results of radial arm maze test in adult rats
2.4 Morris水迷宫测试结果 各组雄鼠在目标象限、相反象限耗时比较差异均无统计学意义(P=0.756、0.674),潜伏期、穿梭平台次数、平台耗时和速度比较差异亦无统计学意义(P=0.687、0.945、0.814、0.980),其中G2h-1d组与其他3组相比在相反象限中耗时最长、潜伏期最长、穿梭平台次数最少、平台耗时最短,但差异无统计学意义(表2)。各组雌鼠在目标象限耗时、潜伏期、平台耗时、速度等指标比较差异无统计学意义(P>0.05);G2h-3d组在相反象限耗时低于G2h-1d组,穿梭平台次数多于G2h-1d组,差异有统计学意义(P=0.033、0.04,表3)。提示发育期多次异氟烷处理,延长处理间隔时间能够明显提高成年大鼠在水迷宫测试中的视觉相关空间认知功能。
3 讨 论
近年来,全身麻醉及镇静药物对于发育期大脑影响的研究备受关注,FDA的用药警示[4]则引起了更为广泛的担忧,尤其是需要经历长时间或多次手术麻醉的婴幼儿,其大脑发育及认知是否受到影响再次成为研究热点。但该警示主要基于临床前研究结果,针对人类的回顾性研究目前尚无明确结论[1],基础研究也因实验动物种类,麻醉药物处理时机、处理时间及次数,神经损害的检测指标,实验动物行为学测试的方法,以及是否有手术伤害性刺激等原因,导致结果存在明显差异[2]。其中达成共识的结论指出,相比发育期短时间麻醉药物处理,长时间或多次处理对成年后神经发育及认知存在一定影响[1]。本研究旨在探讨延长发育期多次麻醉处理的间隔时间能否减轻对成年大鼠认知行为的影响,结果显示,发育期多次异氟烷处理对大鼠成年后焦虑、探索等自主行为没有明显影响,但对空间记忆功能存在一定影响。
表2 发育期不同方式异氟烷处理对成年雄鼠水迷宫测试结果的影响(±s,n=7)Tab. 2 Effects of neonatal isoflurane exposures in different ways on the results of Morris water maze test in adult male rats (±s, n=7)
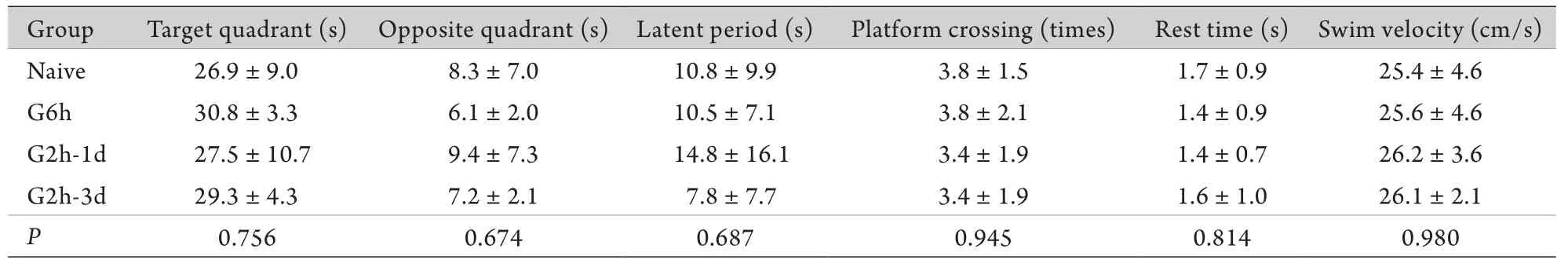
表2 发育期不同方式异氟烷处理对成年雄鼠水迷宫测试结果的影响(±s,n=7)Tab. 2 Effects of neonatal isoflurane exposures in different ways on the results of Morris water maze test in adult male rats (±s, n=7)
?
表3 发育期不同方式异氟烷处理对成年雌鼠水迷宫测试结果的影响(±s,n=5)Tab. 3 Eあects of neonatal iso fl urane exposures in diあerent ways on the results of Morris water maze test in adult female rats (±s, n=5)

表3 发育期不同方式异氟烷处理对成年雌鼠水迷宫测试结果的影响(±s,n=5)Tab. 3 Eあects of neonatal iso fl urane exposures in diあerent ways on the results of Morris water maze test in adult female rats (±s, n=5)
(1)P<0.05 compared with G2h-31d group
?
本研究在经典的测试大鼠空间记忆行为的八臂迷宫和Morris水迷宫实验中发现:间隔时间较短的多次异氟烷处理组(G2h-1d组),无论雌性还是雄性大鼠,其成年后认知行为表现均较差,与既往研究一致[11-12]。延长异氟烷处理间隔时间后(G2h-3d组),雄鼠的行为学表现优于单次处理组和对照组,而单次异氟烷处理6h组的雌鼠成年后也表现出明显的认知行为学优势。该结果提示,发育期异氟烷处理对大鼠成年后认知行为的影响存在明显的性别差异,与Shen等[13]的研究结果一致。
针对人类的回顾性研究发现,幼儿发育期接受多次全身麻醉可明显增加学习障碍及注意缺陷障碍的发生率[14-16]。最近Hu等[17]对1057例接受单次或多次全身麻醉的儿童进行队列研究,再次证实3岁以内幼儿单次麻醉经历与阅读及语言测试成绩下降相关,多次麻醉则影响认知能力和学习成绩,增加学习障碍和注意力缺陷/多动症的风险,但是否完全由麻醉药物的影响所致尚无定论。目前通过啮齿类及非人类灵长动物实验证实,麻醉药物导致的神经毒性可引起短期或持续的神经认知功能损害[2,18],涉及的吸入麻醉药包括氟烷、异氟烷和七氟烷,在大脑发育期可引起神经元变性、凋亡,进而导致认知功能(空间学习及记忆)受损[19-20]。单次异氟烷处理发育期的啮齿类动物后,免疫组化染色可见大脑神经元突触密度及线粒体密度降低、树突棘减少、神经元凋亡增加等神经毒性现象[21-22],但成年后未见明显认知行为异常[22-23]。全麻药物引起的发育期神经变性凋亡并不一定引起成年后的神经认知行为异常,考虑与发育期麻醉暴露时间、暴露次数等多种因素有关[24-25]。而有研究显示,多次异氟烷处理发育期啮齿类动物对其成年后的认知功能具有明显损害[11];七氟醚处理间隔时间越短,其引起的成年后认知损害越明显[12]。本研究结果显示,发育期异氟烷多次处理可导致大鼠成年后认知功能受损,而延长处理间隔时间可明显减轻成年大鼠的认知损害,与既往研究[11-12]一致。该结果提示,对于临床中需要多次手术麻醉的婴幼儿,应尽可能延长手术麻醉的间隔时间,以减轻或消除成年后可能的认知损害,为临床选择手术时机提供了基础研究的证据。
为避免雌激素的影响,基础研究中多选用雄性动物进行实验。也正因如此,雌性在临床前研究中常被忽略。但不同性别动物的行为、神经化学及神经解剖学上的差异是不容忽视的[26]。发育期异氟烷多次处理对成年后大鼠认知行为影响的性别差异是本研究的另一重要内容,结果发现,与雄鼠相比,异氟烷持续处理6h的雌鼠成年后认知功能明显增强,而间隔时间较短的多次异氟烷处理可使雌鼠成年后认知功能发生损害。无论是成年后认知功能增强还是受损,发育期异氟烷处理对雌鼠成年后认知功能的影响较大。该结果与Boscolo等[27]的报道一致,他们认为发育期雌鼠更易受到麻醉药物(咪达唑仑+笑气+异氟烷)的影响。目前越来越多的研究显示,雌鼠的基础反应水平明显强于雄鼠,但在空间学习记忆方面弱于雄鼠[26],本研究的行为学测试也证实了这一点。不同性别大鼠的神经营养因子、神经形成及可塑性、学习记忆、处理压力等能力存在差异[26];雌鼠对精神药物的反应更为强烈,而空间记忆能力较差,也更易受损[26]。性别差异及雌激素在认知行为中的作用还有待进一步深入研究。
麻醉药物对神经功能的影响除了神经毒性外,还有研究证实具有一定的神经保护作用,尤其是对已有的神经损害。Weeks等[28]报道应用异氟烷麻醉治疗药物难治性抑郁症,发现异氟烷吸入麻醉处理后,患者神经认知测试评分明显改善,提示异氟烷具有一定的抗抑郁作用。Murphy等[11]的研究也证实,单次七氟烷处理2h后,雄鼠的空间记忆能力明显提高。本研究中发育期单次异氟烷处理6h(G6h组)的雌鼠及异氟烷多次处理(G2h-3d组)的雄鼠,其成年后的认知功能明显增强。De Roo等[29]报道,在大脑发育的关键时期,麻醉药物能够促进躯体感觉皮层和海马突触的发生,增加树突棘密度,并促进功能性突触的形成。但上述研究结果的生理学基础及其作用机制尚有待进一步探索。
综上所述,本研究结果表明,生后发育期不同时间间隔的异氟烷处理对大鼠成年后认知功能具有一定影响。间隔时间短的多次处理易造成认知损害,延长处理间隔时间能有效减轻或消除成年后的认知行为异常,且这种作用存在明显的性别差异。本研究为临床需要多次手术麻醉的患儿如何选择手术时机,以尽可能降低对其成年后认知功能的影响提供了必要的临床前研究证据。
[1] Davidson AJ, Sun LS. Clinical evidence for any effect of anesthesia on the developing brain[J]. Anesthesiology, 2018,128(4): 840-853.
[2] Montana MC, Evers AS. Anesthetic neurotoxicity: new findings and future directions[J]. J Pediatr, 2017, 181: 279-285.
[3] Houck CS, Vinson AE. Anaesthetic considerations for surgery in newborns[J]. Arch Dis Child Fetal Neonatal Ed, 2017, 102(4):F359-F363.
[4] U.S. Food & Drug Administration. FDA Drug Safety Communication: FDA review results in new warnings about using general anesthetics and sedation drugs in young children and pregnant women[EB/OL].[2017-04-01]. https://www.fda.gov/Drugs/DrugSafety/ucm532356.htm.
[5] Yang J, Li MM, Hao JW, et al. Acute injury to cerebral function produced by isoflurane anesthesia given at different time interval in neonatal rat[J]. Chin Crit Care Med, 2016, 28(3): 267-271.[杨静, 李萌萌, 郝济伟, 等. 异氟烷不同间隔时间麻醉对发育期大鼠脑神经功能的急性损伤作用[J]. 中华危重病急救医学, 2016, 28(3): 267-271.]
[6] Fang XY, Li MM, Hao JW, et al. Effects of physical exercise on object recognition memory in adult rats of postnatal isoflurane exposures[J]. Med J Chin PLA, 2017, 42(7): 617-622. [房晓燕,李萌萌, 郝济伟, 等. 运动对异氟烷处理大鼠成年后物体识别的影响[J]. 解放军医学杂志, 2017, 42(7): 617-622.]
[7] Sayapina NV, Batalova TA, Chaika VV, et al. Multi-walled carbon nanotubes increase anxiety levels in rats and reduce exploratory activity in the open field test[J]. Dokl Biol Sci, 2015, 464: 223-225.
[8] Servick K. Biomedical researchers struggle to gauge risks of
childhood anesthesia[J]. Science, 2014, 346(6214): 1161-1162.[9] Akar F, Mutlu O, Celikyurt IK, et al. Effects of rolipram and zaprinast on learning and memory in the Morris water maze and radial arm maze tests in naive mice[J]. Drug Res (Stuttg), 2015,65(2): 86-90.
[10] Giles ED, Jackman MR, MacLean PS. Modeling diet-induced obesity with obesity-prone rats: implications for studies in females[J]. Front Nutr, 2016, 3: 50.
[11] Murphy KL, Baxter MG. Long-term effects of neonatal single or multiple isoflurane exposures on spatial memory in rats[J].Front Neurol, 2013, 4: 87.
[12] Shen X, Liu Y, Xu S, et al. Early life exposure to sevflurane impares adulthood spatial memory in the rat[J].Neurotoxicology, 2013, 39: 45-46.
[13] Shen X, Dong Y, Xu Z, et al. Selective anesthesia-induced neuroinflammation in developing mouse brain and cognitive impairment[J]. Anesthesiology, 2013, 118(3): 502-15.
[14] Wilder RT, Flick RP, Sprung J, et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort[J].Anesthesiology, 2009, 110(4): 796-804.
[15] Flick RP, Katusic SK, Colligan RC, et al. Cognitive and behavioral outcomes after early exposure to anesthesia and surgery[J]. Pediatrics, 2011, 128(5): e1053- e1061.
[16] Sprung J, Flick RP, Katusic SK, et al. Attention-deficit/hyperactivity disorder after early exposure to procedures requiring general anesthesia[J]. Mayo Clin Proc, 2012, 87(2):120-129.
[17] Hu D, Flick RP, Zaccariello MJ, et al. Association between exposure of young children to procedures requiring general anesthesia and learning and behavioral outcomes in a population based birth cohort[J]. Anesthesiology, 2017, 127(2): 227-240.
[18] Derderian CA, Szmuk P, Derderian CK. Behind the black box:the evidence for the U.S. Food and Drug Administration warning about the risk of general anesthesia in children younger than 3 years[J]. Plast Reconstr Surg, 2017, 140(4): 787-792.
[19] Jiang J, Jiang H. Effect of the inhaled anesthetics isoflurane,sevoflurane and desflurane on the neuropathogenesis of Alzheimer's disease (review) [J]. Mol Med Rep, 2015, 12(1):3-12.
[20] Lu H, Liufu N, Dong Y, et al. Sevoflurane acts on ubiquitination
proteasome pathway to reduce postsynaptic density 95 protein
levels in young mice[J]. Anesthesiology, 2017, 127(6): 961-975.[21] Brosnan H, Bickler PE. Xenon neurotoxicity in rat hippocampal slice cultures is similar to isoflurane and sevoflurane[J].Anesthesiology, 2013, 119(2): 335-344.
[22] Noguchi KK, Johnson SA, Dissen GA, et al. Isoflurane exposure for three hours triggers apoptotic cell death in neonatal macaque brain[J]. Br J Anaesth, 2017, 119(3): 524-531.
[23] Loepke AW, Istaphanous GK, McAuliffe JJ, et al. The effects of neonatal isoflurane exposure in mice on brain cell viability, adult behavior, learning, and memory[J]. Anesth Analg, 2009, 108(1):90-104.
[24] Yang B, Liang G, Khojasteh S, et al. Comparison of neurodegeneration and cognitive impairment in neonatal mice exposed to propofol or isoflurane[J]. PLoS One, 2014, 9(6):e99171.
[25] Lin EP, Lee JR, Lee CS, et al. Do anesthetics harm the developing human brain? An integrative analysis of animal and human studies[J]. Neurotoxicol Teratol, 2017, 60: 117-128.
[26] Simpson J, Kelly JP. An investigation of whether there are sex differences in certain behavioural and neurochemical parameters in the rat[J]. Behav Brain Res, 2012, 229 (1): 289-300.
[27] Boscolo A, Ori C, Bennett J, et al. Mitochondrial protectant pramipexole prevents sex-specific long-term cognitive impairment from early anaesthesia exposure in rats[J]. Br J Anaesth, 2013, 110(1): 47-52.
[28] Weeks HR, Tadler SC, Smith KW, et al. Antidepressant and neurocognitive effects of isoflurane anesthesia versus electroconvulsive therapy in refractory depression[J]. PLoS One, 2013, 8(7): e69809.
[29] De Roo M, Klauser P, Briner A, et al. Anesthetics rapidly promote synaptogenesis during a critical period of brain development[J]. PloS One, 2009, 4(9): e7043.
