基于分子发夹/荧光微球的侧向层析法定量检测黄曲霉毒素B1
2018-07-06周子明谢彩玲
周子明,谢彩玲,赵 斌,2*,郭 狄
(1.中山火炬职业技术学院 生物医药系,广东 中山 528436;2.国家中药现代化工程技术中心中山分中心,广东 中山 528436;3.中山鼎晟质检服务有限公司,广东 中山 528400)
黄曲霉毒素B1(AFB1)是由黄曲霉和寄生曲霉等产生的一种次生代谢物,进入人体或动物体内后,会导致急、慢性中毒,甚至发生癌变或畸变[1-4]。近年来,各种食品、药品中AFB1超标现象频现,对人体健康构成严重威胁。因此,检测食物、药物等中AFB1的含量非常重要。
目前,检测AFB1的常用方法有薄层色谱法[5]、气相色谱法[6]、高效液相色谱法[7]、色谱-质谱联用法[8]、酶联免疫吸附法[9]。但上述方法存在检测仪器昂贵、操作不便、检测时间长等不足,亟需建立一种快速、简便的检测AFB1的新方法。
侧向层析法是继酶联免疫吸附法(ELISA)后发展起来的即时检测技术(Point of care test,POCT)[10-11]。自Beggs等[12]将免疫层析技术成功用于人绒毛膜促性腺激素(HCG)的测定后,胶体金免疫层析技术逐渐发展成为国际临床研究应用最广泛的快速诊断技术之一[13-15]。随着技术的发展,传统的胶体金定性检测技术已不能满足临床诊断需要,提高免疫层析技术的精确度和灵敏度势在必行,利用微米级的荧光微球(Fluorescent microsphere,FM)进行半定量或定量免疫层析技术已成为新的发展方向。荧光微球具有粒径均匀、表面光滑、单分散性好、荧光强度高、容易修饰等优点,已经被广泛应用于生物医学、食品安全等领域[16-18]。
适配体(Aptamer)是一类单链DNA或RNA序列,通过配体指数富集的系统进化技术(SELEX)筛选得到。由于Aptamer具有特异性高、热稳定性好、易于合成修饰以及靶物质广泛的特点,已被用于多种生物传感器的构建[19-23]。AFB1的特异性适配体自2012年被加拿大的Neoventures Biotechnology Inc公司首次报道后,基于适配体构建的AFB1检测方法日益引起关注[24-26]。
本文基于侧向层析法的原理构建了一种荧光定量检测黄曲霉毒素B1的试纸条。该试纸条的结合垫上包被荧光微球标记的DNA分子发夹探针,该DNA分子发夹的“环”(DNA分子发夹由环和茎组成)由黄曲霉毒素B1的适配体构成,而检测线处则包被一段碱基序列,该段序列与DNA分子发夹茎的序列互补。通过此设计策略,检测线处荧光的强度与待测样品中AFB1的含量呈线性关系。利用这一原理,通过一个“off-on”的荧光信号,实现对待测样品中AFB1的高灵敏检测。结果表明,该方法具有高灵敏、高特异性的优点,能用于实际样品中AFB1含量的分析,具有较为重要的实际应用价值。
1 实验部分
1.1 试剂与材料
黄曲霉毒素B1购自Sigma公司(上海),带羧基的荧光微球(激发波长360 nm,发射波长620 nm)购自上海辉质有限公司;Roche牛血清白蛋白(组份五)购自深圳天深医疗器械有限公司;Tris、吐温20、葡聚糖、海藻糖均购自国药集团化学试剂有限公司(上海);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl,98.5%)、N-羟基硫代琥珀酰亚胺(Sulfo-NHS)、链霉亲和素均购自阿拉丁试剂(上海) 股份有限公司;硝酸纤维素膜(NC膜)购自 Millipore(MA,USA);ProClin300购自Supelco公司(美国);玻璃纤维素垫、吸水纸、PVC底板、均购自通成纸制品有限公司。试纸条卡壳购自青岛广达森塑胶有限公司。凉茶、生脉饮、急支糖浆样品为国家中药现代化工程技术中心中山分中心自行研制。DNA片段购自生工生物工程(上海) 股份有限公司,碱基序列见表1,均稀释成100 μmol/L后待用。其他所用试剂均为分析纯,购自国药集团化学试剂有限公司(上海)。实验所用超纯水(≥18.2 MΩ·cm)由Millipore公司的Milli-Q system(美国) 净化制得。

表1 DNA片段的碱基序列Table 1 Alignment of DNA oligonucleotide sequences
1.2 仪器设备
真空旋转浓缩仪(Eppendorf,德国),超声波清洗器(KQ5200,昆山市超声仪器有限公司),电子防潮柜(杭州智硕电子科技有限公司),真空鼓风干燥箱(上海姚氏仪器设备厂),荧光测试仪FA50(深圳锦瑞生物科技股份有限公司),液相色谱-质谱联用仪(LC-MS),喷金划膜仪、斩切机和压壳机(杭州峰杭科技有限公司)。
1.3 标记探针的制备
荧光微球标记DNA分子发夹参照碳化二亚胺法[20]制备,具体步骤如下:1 mg荧光微球加至50 mmol/L pH 6.0的MES缓冲液中,充分混匀后,于14 000 r/min离心15 min后,去除上清液,再加入1 mL MES缓冲液重悬微球,离心,重复3次后,最终用1 mL pH 7.4的PBS缓冲液重悬微球。加入20 μL 5 mg/mL的EDC和20 μL 1.5 mg/mL的NHS后,室温下搅拌反应0.5 h。向上述混合溶液中加入DNA分子发夹(50 μL,100 μmol/L)溶液,涡旋混匀后,反应2 h。所得混合物用PBS缓冲液离心清洗3次,弃去上清液后,用PBS缓冲液重悬得到标记探针母液,待用。
1.4 检测探针与质控探针的制备
取过量链霉亲和素与50 μL 100 μmol/L的Sequence 2在常温下振荡反应0.5 h。待链霉亲和素-Sequence 2形成检测探针后,用喷金划膜仪将其喷涂在硝酸纤维素上。
取过量链霉亲和素与50 μL 100 μmol/L的Sequence 3在常温下振荡反应0.5 h。待链霉亲和素-Sequence 3形成质控探针后,用喷金划膜仪将其喷涂在硝酸纤维素上。
1.5 AFB1试纸条的组装
AFB1试纸条主要由样品垫、结合垫、NC膜、吸水纸、PVC底板以及塑料外壳组成(如图1A)。标记探针吸附在玻璃纤维膜上;检测探针和质控探针均包被在硝酸纤维膜上。各部分重叠约2 mm。裁成约4 mm的宽度后,装在塑料卡壳内备用。组装好的试纸条NC膜上有2条线,靠近吸水纸一端为质控线(C),靠近结合垫一端为检测线(T)。用荧光分析仪进行检测时,只有C线有荧光峰时,才表明该试纸条有效;否则无效。
1.6 AFB1的检测
取待测样本100 μL,从试纸条的样品滴加处加样,10 min后,将滴加待测样本的试纸条放入荧光测试仪进行检测。当待测样本中不含AFB1时,检测区不会出现亮线,质控区会出现亮线;当待测样本中含有AFB1,检测区和质控区均出现亮线。
1.7 实际样品中AFB1含量的检测
取凉茶、生脉饮、急支糖浆3个不同品种的样品各1 mL,分别加入9 mL pH 7.4的磷酸盐缓冲液,混合均匀后,将3个样本分别分成3份,凉茶3个样本编号为1、2、3;生脉饮3个样本编号为4、5、6;急支糖浆3个样本编号为7、8、9。将9个样本依次通过上述制作的AFB1试纸条进行检测,每个样本重复3次。同时用液相色谱-质谱联用(LC-MS)方法进行测定,作为对照。
2 结果与讨论
2.1 基于侧向层析法检测黄曲霉毒素B1的方法学原理
AFB1试纸条检测原理如图1所示。当待测样本中不含AFB1时(见图1B),标记物结合垫处的标记探针随着层析方向向右移动,由于标记探针中的DNA分子发夹“茎”处双链的存在,故不会与反应膜上检测区的Sequence 2互补结合,因此在检测区未检出荧光峰(T)。当标记探针层析到质控区,标记探针中的AFB1适配体则会与质控区的Sequence 3互补结合,因此在质控区检出荧光峰(C);当待测样本中含有AFB1时(见图1C),AFB1先与标记物结合垫处标记探针中的AFB1适配体结合,同时,标记探针中DNA分子发夹的双链部分被打开,AFB1与标记探针形成的复合物层析到反应膜的检测区时,与检测区的Sequence 2互补结合,导致标记探针形成的复合物在检测区被捕获,使得检测区检出荧光峰。而过量未反应的标记探针层析到质控区处,被质控区的Sequence 3捕获,使得质控区也检出荧光峰。根据检测区荧光峰强度(T)和质控区荧光峰强度(C)的比值,即T/C值,可实现对AFB1的检测。待测样本中AFB1的含量越高,试纸条标记物结合垫处的标记探针量越多,检测区的荧光信号T值越大,对应的荧光信号的T/C值也越大。
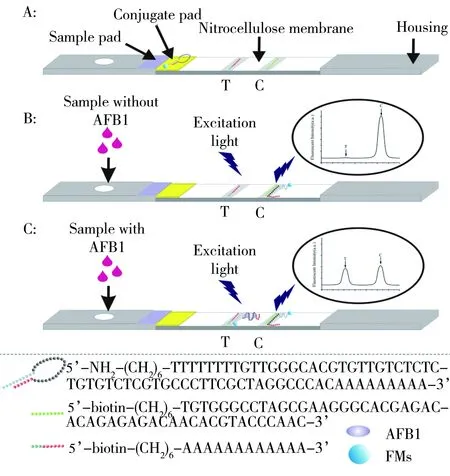
图1 基于侧向层析法检测黄曲霉毒素B1的方法学原理Fig.1 Schematic depiction of the lateral flow assay to detect AFB1A:structure of the AFB1 strip;schematic depiction for detection in the absence(B) and presence(C) of AFB1
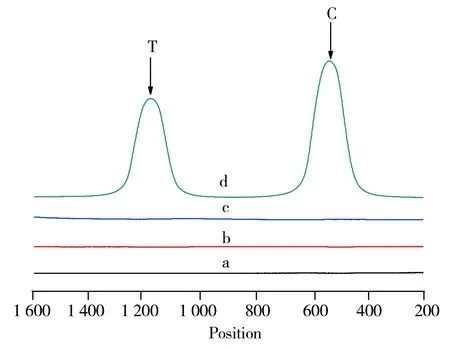
图2 AFB1试纸条对AFB1的检测Fig.2 Detection of AFB1 based on lateral flow assaya:the strip was assembled without the test probe,the control probe and labeled probe;b:with the test probe and the control probe and without the labeled probe;c:with the test probe,the control probe and just FMs;d:with the test probe,the control probe and the labeled probe.1∶5 diluent of the labeled probe stoste was coated on the conjugate pad;concentration of the test probes and the control probe were 1 μmol/L,and 10 ng/mL for the sample,each experiment had been done for three times

图3 不同方法学的AFB1试纸条对AFB1的检测结果Fig.3 Detection of AFB1 based on different methods by lateral flow assay the results were without(A),with(B) AFB1 by the strip assembled by antigen & antibody-dependent colloidal gold immunochromatography;the results were without(C),with(D) AFB1 by the strip assembled by aptamer-dependent colloidal gold immunochromatography;the results were without(E),with(F) AFB1 by the strip assembled by this method;concentration of AFB1 was 5 μg/L,each experiment had been done for three times
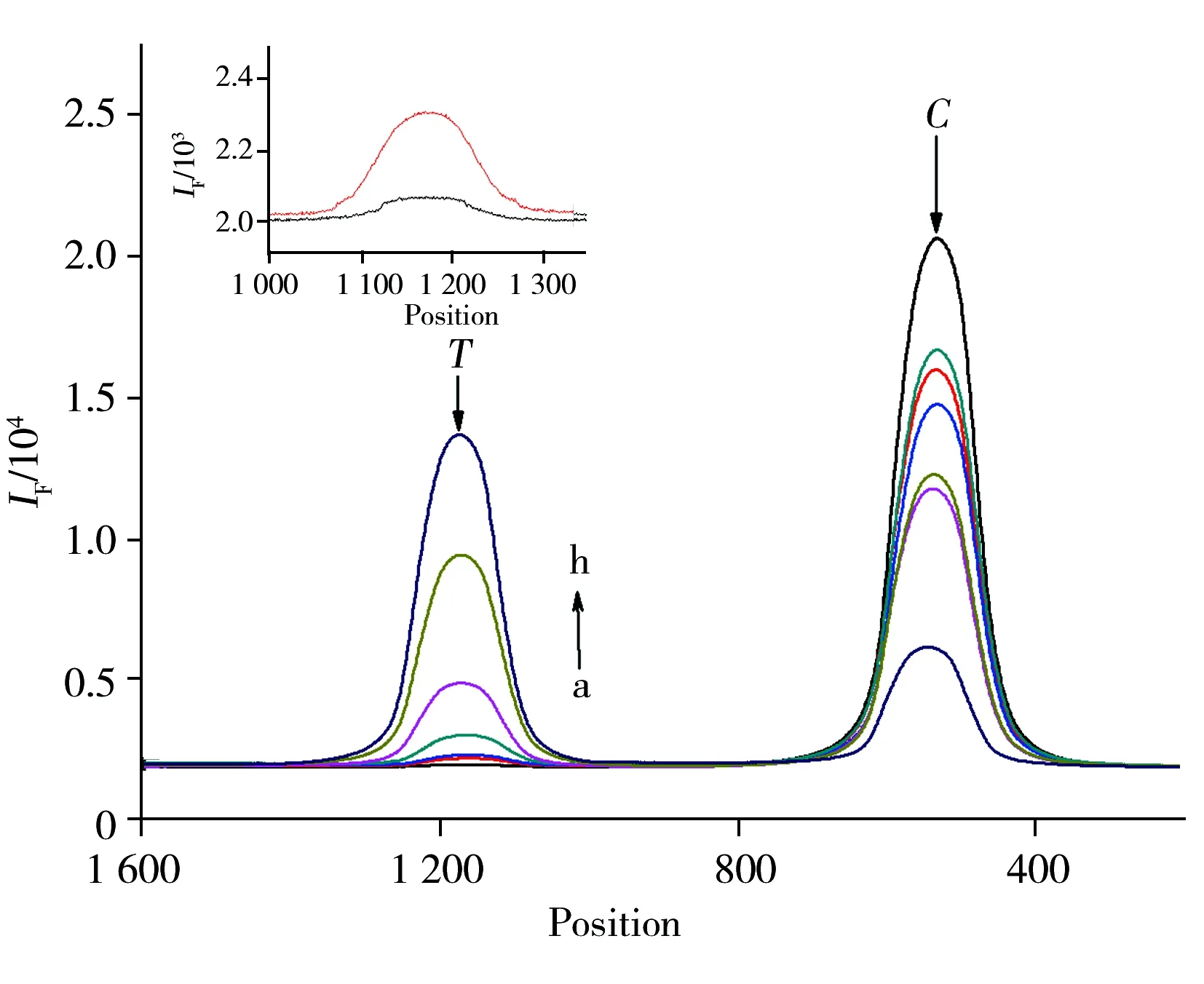
图4 不同浓度AFB1的荧光峰变化图Fig.4 Fluorescence diagram for the fluorescence intensity of the test line and the control line with different concentrations of AFB1 concentration of AFB1(a-h) :0,0.1,0.5,2,5,10,50 μg/L;the insert showed the amplifying diagram of the fluorescence peaks at the test line of curve a and b;concentration of the test probe and the control probe were 1 μmol/L,0.5 mg/mL for the labeled probe;each experiment had been done for three times
基于该原理,对此方法进行了验证,如图2所示。当NC膜上未包被检测探针和质控探针,结合垫上也未喷涂标记探针时,检测区和质控区均未检出荧光峰(曲线a)。当NC膜上包被检测探针和质控探针,结合垫上不喷涂标记探针时,检测区和质控区依然未检出荧光峰(曲线b)。当NC膜上包被检测探针和质控探针,仅将荧光微球喷涂在结合垫上时,检测区和质控区依然未检出荧光峰(曲线c)。当NC膜上包被检测探针和质控探针,且喷涂标记探针时,检测区和质控区可检测到明显的荧光峰(曲线d)。结果证实,图1中的检测原理是可行的。
2.2 适配体介导的侧向层析法与抗原抗体介导的免疫层析法的比较
比较了基于抗原抗体介导的胶体金免疫层析法与基于适配体介导的荧光微球侧向层析法。传统的胶体金免疫层析法检测AFB1大多基于“竞争法”,即在金垫上包被胶体金标记的AFB1抗体,在检测线(T)处包被载体蛋白-AFB1结合物,在质控线(C)处包被多抗。当样品中不含AFB1时,检测线(T)和质控线(C)处均有明显的亮线(图3A);当样品中含有AFB1时,检测线(T)处的亮线明显减弱甚至消失(图3B)。这说明了传统胶体金方法的可行性。图3C显示了用适配体介导的胶体金侧向层析法的检测结果。将胶体金与图1中的DNA分子发夹通过吸附作用结合后,包被在金垫上,Sequence 2和Sequence 3分别包被在检测线和质控线处。当样品中不含AFB1时,检测线处几乎观察不到亮线,而质控线处的亮线也非常弱(图3C);当样品中含有AFB1时,检测线和质控线处的亮线依然不明显(图3D)。这表明基于胶体金的侧向层析法不可行。这可能是因为胶体金与DNA分子发夹通过吸附的方式作用,当DNA分子发夹与AFB1形成复合物,或者DNA分子发夹与Sequence 3形成 DNA双链时,胶体金与DNA之间的作用力不足以将胶体金与复合物或者双链吸附[26-28],以至于形成的复合物或者DNA双链无法将胶体金留在检测线或者质控线处,因此无论样品中是否有AFB1,检测线和质控线处的亮线均非常微弱。当用荧光微球取代胶体金时,荧光微球与DNA分子发夹通过共价偶联。相比于样品中无AFB1时的结果(图3E),当样品中含有AFB1时,检测线处出现明显的荧光亮线(图3F)。这可能是因为用共价键的方式将荧光微球与DNA分子发夹偶联时,即使形成了复合物或者DNA双链,但荧光微球作为荧光探针依然与复合物或者DNA双链偶联。综上所述,基于适配体的胶体金侧向层析法不可用,而基于适配体的荧光微球侧向层析法是可行的。
2.3 标记探针浓度的影响
测试样本的质量浓度为10 μg/L,检测探针的包被浓度为1 μmol/L,对标记探针的喷涂浓度进行了研究。发现在相同条件下,随着标记探针喷涂浓度变化,检测区荧光峰强度(T)和质控区的荧光峰强度(C)均有显著变化。当用0.1 mg/mL的标记探针进行喷涂时,检测区和质控区的荧光峰强度均非常弱,表明此时喷涂的标记探针量不足。当用0.5 mg/mL的标记探针进行喷涂时,检测区和质控区的荧光峰强度显著增强。当用1 mg/mL和2 mg/mL的标记探针喷涂时,检测区和质控区的荧光峰强度与0.5 mg/mL标记探针喷涂时相差不大。考虑到标记探针的浓度太高会增加成本,且可能会影响标记探针的层析效率。因此,选择0.5 mg/mL的标记探针进行后续实验。
2.4 检测探针浓度的影响
对检测探针的包被浓度进行研究。发现在相同条件下,随着样本中AFB1浓度的升高,检测区荧光峰强度(T)和质控区荧光峰强度(C)的比值(T/C)均会增加。当检测探针浓度为0.1 μmol/L时,随样本浓度的升高,T/C值增加不大,而且当样本质量浓度大于10 μg/L时,出现hook现象。当检测探针浓度增至0.5 μmol/L时,随样本质量浓度的升高,T/C值的增幅有所提高,但当样本质量浓度为50 μg/L时,T/C值的增加趋势下降,表明此条件下的线性范围不宽。当检测探针浓度增至1 μmol/L时,T/C值与样本质量浓度呈线性关系。当检测探针浓度增至2 μmol/L时,随样本质量浓度的升高,T/C值与检测探针浓度为1 μmol/L时无显著区别。因此,选择检测探针的浓度为1 μmol/L。
2.5 基于侧向层析法的试纸条检测AFB1
图4显示了不同浓度的AFB1对T和C的影响。结果表明,随着AFB1浓度的增加,T增加明显。当AFB1的质量浓度在0.1~50 μg/L时,T/C与AFB1的质量浓度呈良好的线性关系,线性方程为Y=0.059 6X+0.076 0,r2=0.993 3,其中Y为T/C值,X为样本的质量浓度(μg/L )。基于3倍信噪比(S/N=3)计算得到检出限为0.05 μg/L。
比较了现有方法及本方法的检出限及检测范围(表2)。从表2可以看出,本方法的灵敏度更高,检测更快速。

表2 AFB1检测方法的主要参数对比Table 2 Comparison of major characteristics of common method used in the determination of AFB1
2.6 基质效应
由于一步反应,且不清洗,因此侧向层析法测试中常存在基质干扰。本实验选取2、10 μg/L两个质量浓度的标准品分别添加到凉茶(本底浓度2.03 μg/L)、生脉饮(本底浓度0.81 μg/L)、急支糖浆(本底浓度1.23 μg/L)3种基质样品中(按照1∶9的体积比添加),进行加标回收实验,结果如表3所示。样本的回收率为84.9%~113%,表明本方法受基质效应影响不大。
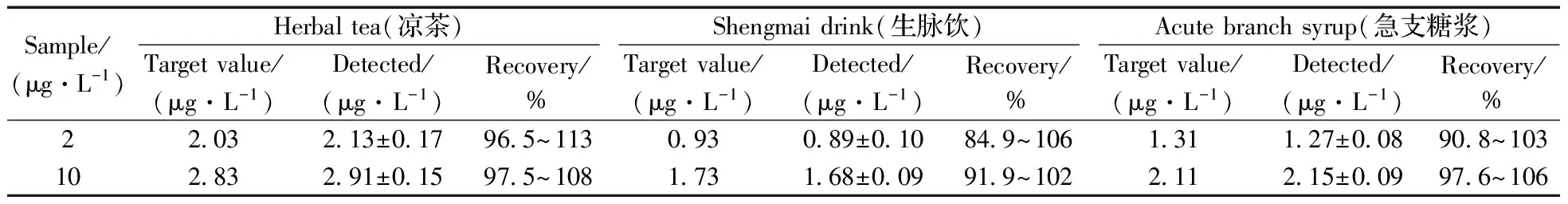
表3 AFB1试纸条的回收实验Table 3 Spiked recoveries test of the AFB1 strip
2.7 特异性实验
在优化条件下,以黄曲霉毒素M1(AFM1)、黄曲霉毒素G1(AFG1)、黄曲霉毒素B2(AFB2)、赭曲霉毒素A(OTA)、玉米赤霉烯酮为干扰物,考察了本方法对AFB1检测的特异性。在相同条件下,将上述6种不同物质分别滴加到AFB1试纸条中,反应一段时间后用荧光测试仪检测体系的T/C。结果表明,100倍AFB1浓度的上述5种对照物质得到的T/C,与空白对照基本一致。而10 μg/L 的AFB1得到的T/C为0.724,表明基于侧向层析法的AFB1试纸条对AFB1的检测具有很好的特异性。
2.8 实际样品中AFB1的检测
按照“1.7”方法分析检测了凉茶、生脉饮、急支糖浆3个样品中AFB1的含量。同时用液相色谱-质谱联用(LC-MS)方法进行检测,作为对照。测试结果如表4所示,两种方法对3种不同基质样本测试结果的相关性较好。
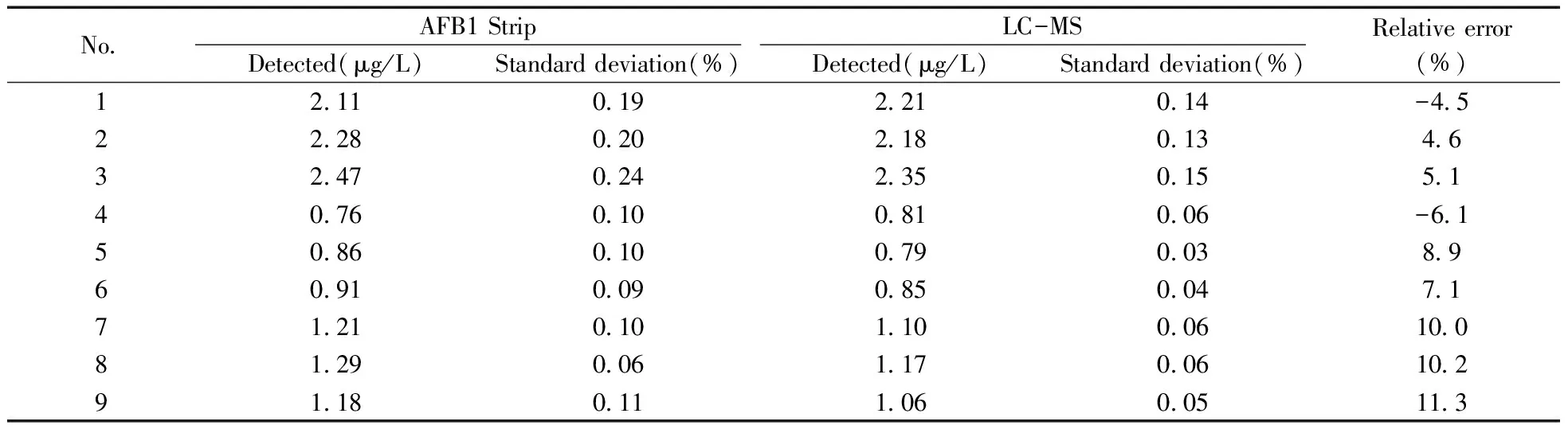
表4 AFB1试纸条和LC-MS检测实际样品结果Table 4 The results of AFB1 strip and LC-MS for the real sample
3 结 论
本文基于侧向层析法构建了一种AFB1检测的试纸条。该方法原理在于样品中AFB1与标记探针中的DNA分子发夹结合后,形成的复合物在检测区能够被检测探针捕获,通过一个“off-on”的荧光信号,实现对AFB1的高灵敏检测。该方法具有高灵敏、高特异性的优点,并能用于实际样品中AFB1含量的分析。该方法具有较好的实用性,但其在各种溶液配方以及工艺条件等方面有待进一步优化,以优化检测体系、提高标记效率、降低检出限。
参考文献:
[1] Vidal J C,Bonel L,Ezquerra A,Hernandez S,Bertolin J R,Cubel C,Castillo J R.Biosens.Bioelectron.2013,49:146-158.
[2] Chen J H,Wen J L,Zhuang L,Zhou S G.Nanoscale,2016,8(18):1-6.
[3] Jafari M,Rezaei M,Kalantari H,Tabarzad M,Daraei B.J.Toxicol.,2017,2017:1-6.
[4] McKeague M,Bradley C,Girolamo A,Visconti A,Miller J D,DeRosa M C.Int.J.Mol.Sci.,2010,11:4864-4881.
[5] Ma J,Qiu F N,Liu J E,Gong D,Xu L.Anim.Husb.FeedSci.(马俊,邱富娜,刘金娥,巩丹,徐玲.畜牧与饲料科学),2013,34(2):19-23.
[6] Scott P,Kanhere S,Weber D.FoodAddit.Contam.,1993,10:381-389.
[7] Ying Y F,Zhu C Y,Wei M Y,Chen H H,Qu J,Lu C B,Lin X J,Luo C J.Chin.J.Anal.Chem.(应永飞,朱聪英,韦敏钰,陈慧华,屈健,陆春波,林仙军,罗成江.分析化学),2010,38:1759-1764.
[8] Yao T,Wang D,Li S,Liu Y J,Sun B K,Wang Y.J.Instrum.Anal.(姚婷,王丹,李双,刘玉娟,孙秉康,汪勇.分析测试学报),2017,36(11):1346-1351.
[9] Liu B H,Chu K C,Yu F Y.FoodControl.,2016,68:1-7.
[10] Xia S Q,Yu Z B,Liu D F,Xu C L,Lai W H.FoodControl.,2016,59:507-512.
[11] Osikowicz G,Beggs M,Brookhar P,Caplan D,Ching S,Eck P,Gordon J,Richerson R,Sampedro S,Stimpson D.Clin.Chem.,1990,36:1586.
[12] Beggs M,Novotny M,Sampedro S.Clin.Chem.,1990,36:1084-1085.
[13] Wang W,Zhang S,Liu C,Lu L,Wang S,Zhang X.Electrophoresis,2009,30:3092-3098.
[14] Liu Q,Tang Y,Xiang J J,Zou J H,Zhai Y F.J.Instrum.Anal.(刘茜,唐勇,向军俭,邹军辉,翟一凡.分析测试学报),2012,31(4):397-402.
[15] Xiang J J,Chen Y Q,Tang Y,Xu X L,Yang H Y,Liu B,Liu X F.Chin.J.Biol.(向军俭,陈耀强,唐勇,徐霞玲,杨红宇,刘斌,刘小峰.中国生物制品学杂志),2010,23(5):529-532.
[16] Huang X,Aguilar Z,Li H,Lai W,Wei H,Xu H,Xiong Y.Anal.Chem.,2013,85:5120-5128.
[17] Zhang X,Wen K,Wang Z,Jiang H,Beier R,Shen J.FoodControl.,2016,60:588-595.
[18] Wang H,Wang H,Chen S,Dzakah E,Kang K,Wang J,Wang J.Clin.Chim.Acta,2015,444:37-42.
[19] Zhou Z M,Feng Z,Zhou J,Fang B Y,Ma Z Y,Liu B,Zhao Y D,Hu X B.Sens.ActutorB,2015,210:158-164.
[20] Zhou Z,Zhou J,Chen J,Yu R N,Zhang M Z,Song J T,Zhao Y D.Biosens.Bioelectron.,2014,59:397-403.
[21] He Y,Wang Z,Tang H.Biosens.Bioelectron.,2011,29:76-81.
[22] Chang H,Tang L,Wang Y,Jiang J,Li J.Anal.Chem.,2010,82:2341-2346.
[23] Baker B,Lai R,Plaxco K.J.Am.Chem.Soc.,2006,128:3138-3139.
[24] Chryseis P,Andres C,Allen G.Canada Patent,WO 2011020198A1.2011.
[25] Juntunen E,Arppe R,Kalliomaki L,Salminen T,Talha S M,Myyrylainen T,Soukka T,Pettersson K.Anal.Biochem.,2016,492:13-20.
[26] Wu Z,Lu H,Liu X,Hu R,Zhou H,Shen G,Yu R Q.Anal.Chem.,2010,82:3890-3898.
[27] Bi S,Yan Y,Hao S.Angew.Chem.Int.Ed.,2010,49(26):4438-4442.
[28] Mazumdar D,Liu J,Lu G.Chem.Commun.,2010,46(9):1416-1418.
[29] Guo X,Wen F,Zheng N,Luo Q,Wang H,Wang H,Li S,Wang J.Biosens.Bioelectron.,2014,56:340-344.
[30] Shim W,Kim J,Kim J,Choi J,Je J,Kuzmina N,Eremin S,Chung D.FoodSci.Biotechnol.,2008,17:623-630.
[31] Evtugyn G,Porfireva A,Stepanova V,Sitdikov R,Stoikov I,Nikolelis D,Hianik T.Electroanalysis,2004,26:1-11.
[32] Castillo G,Spinella K,Poturnayová A,nejdárková M,Mosiello L,Hianik T.FoodControl.,2015,52:9-18.
[33] Shim W,Kim M,Mun H,Kim M.Biosens.Bioelectron.,2014,62:288-294.
