Neuritin与HSP60在急性肝损伤修复中的表达变化及意义
2018-07-05王朝阳朱美意欧阳军张宏伟
王朝阳 朱美意 欧阳军 张宏伟
石河子大学医学院第一附属医院普通外科(新疆石河子 832000)
肝脏是机体执行解毒和代谢自稳态功能的主要器官[1],参与多种物质代谢及凝血因子的合成[2-3],而肝损伤是威胁我国人民健康的重大疾病之一[4]。虽然肝脏具有强大的储备功能及再生能力[5],但其再生修复的分子机制目前尚未完全清楚,如何促进肝损伤后的再生修复已成为临床亟待解决的问题,成为近年来的研究热点。
WIBRAND等[6]对肝脏研究发现,胚胎期小鼠Neuritin基因的表达水平随着肝脏的发育而逐渐增高,至成年期时达到顶峰,随后将成年小鼠肝脏70%切除,发现Neuritin基因的表达水平出现一过性降低,随着肝脏再生的开始其表达水平开始回升并且回升的时间与cyclinD1一致,而cyclinD1是肝脏发育成熟和再生的一个重要指标。由此推测Neuritin可能具有促进肝脏再生的作用,而Neuritin作为神经营养因子在人体内多个器官表达,其研究主要集中在神经系统,在肝损伤及修复过程中的变化及作用国内外几乎处于空白。本课题组于1999年在国内首先克隆了Neuritin基因[7],并通过酵母双杂交技术在酵母菌体内构建了Neuritin真核表达系统,获得了分泌型Neuritin蛋白,进一步[8]以Neuritin为诱饵发现了Neuritin与细胞增殖和分化以及信号转导相关的蛋白质均有相互作用,其中包括热休克蛋白60(heat shock proteins 60,HSP60)。HSP60属于热休克蛋白家族中的一种,是机体在各种理化因子刺激下产生的一类高度保守的蛋白质[9-11],其最主要的功能是作为分子伴侣[12],参与新生肽链的折叠与装配、对变性蛋白的修复或加速其降解、促进损伤细胞的自我修复,以保护机体在各种有害因素刺激时不受或少受伤害[13],但目前国内对HSP60的研究却相对较少,而在肝损伤修复中的研究国内外却少有涉及。
因此,基于上述研究,笔者推测Neuritin与HSP60在肝损伤修复方面可能功能相关、共同参与并促进了肝损伤的再生修复,但是缺乏必要的客观线索或依据,迄今尚未见任何研究将它们有意识地进行比较和联系,更未见两者在肝损伤修复中的研究与报道,故笔者将研究集中于两者在肝损伤修复上,在继酵母双杂交之后,本研究利用免疫印迹技术(Western blot)检测Neuritin与HSP60在肝损伤修复过程中的表达变化差异,探讨两者在肝损伤修复过程中的意义及可能机制,为深入研究肝损伤修复的分子机制奠定实验基础、提供新思路。
1 材料与方法
1.1 材料 Sprague-Dawley(SD)大鼠购自新疆医科大学动物饲养中心;Neuritin、HSP60抗体(Abcom公司);蛋白分子量marker(Fermantes公司),β-actin抗体(SIGMA公司);PVDF膜(Solarbio公司);化学发光检测试剂盒Thermo公司。
1.2 方法
1.2.1 动物分组、造模及标本采集 由新疆医科大学动物饲养中心提供同一批次(批号XJZZQ(XK)200301)5周龄、清洁级、雌雄不限的SD大鼠,体质量(200±20)g,经石河子大学医学院第一附属医院动物饲养中心分笼饲养,保持12 h光照、12 h避光循环,恒温恒湿、标准饲料、自由饮水,经适应性饲养1周后,按照随机抽样原则将其分为空白组(n=6)和实验组(n=42),空白组为0 h观察点,其中实验组均行肝左叶70%切除以诱导急性肝损伤[14],分别于术后6、12、24、48 h及3、7、14 d再次手术切除残余肝左叶,部分肝脏标本用于Western Blot检测,一部分于10%福尔马林固定,常规包埋、切片行HE染色。相应时间点从尾缘静脉采血约1 mL、室温静置30 min后3 000 r/min离心10 min,取血清送往石河子大学医学院第一附属医院检验科,由专业检验人员利用全自动生化分析仪检测ALT、AST浓度。所有大鼠均通过石河子大学医学院第一附属医院伦理委员会审核。
1.2.2 肝组织HE染色 取肝组织石蜡块,制备切片(4 μm),苏木精-伊红染色,显微镜下观察肝组织病理学变化。
1.2.3 Western Blot取各时间点肝组织标本约50 mg,提取蛋白后混匀,于10%和15%的SDS-PAGE中电泳,电转至PVDF膜中,5%脱脂奶粉封闭2 h后加入一抗(Neuritin抗体1∶500、HSP60抗体1∶20 000、β-action抗体1∶1 000),室温孵育4~6 h,TBST洗膜4次,每次15 min;加入HPR标记的二抗,孵育2 h,TBST洗膜3次,每次10 min,最后用ECL发光试剂盒显影检测蛋白印迹条带,以目的蛋白和内参β-actin条带灰度值的比值作为目的蛋白的相对表达量。
1.3 统计学方法 各组大鼠均进入统计分析,中途无遗失,应用SPSS 17.0统计学软件进行数据分析,计量资料以±s表示;不同时间点之间的比较采用单因素ANOVA检验,组间两两比较采用LSD-t检验,采用Pearson方法分析Neuritin、HSP60分别与ALT、AST相关性,所有检验以P<0.05为差异有统计学意义。
2 结果
2.1 急性肝损伤修复模型的鉴定
2.1.1 术后行为学观察及存活率统计 与空白组相比,实验组大鼠毛发略凌乱、光泽度降低,精神萎靡、嗜睡,活动量减少,对外界刺激反应迟钝,初次及二次术后所有大鼠均存活,切口愈合良好,无感染渗血等并发症的发生,二次术后精神、活动及食欲恢复良好,14 d存活率为100%。

图1 肝左叶70%切除术诱导急性肝损伤Fig.1 Development of an acute liver-injury model by resection of the 70%left hepatic lobe
2.1.2 血液生化检查 空白组及肝损伤组各个时间点ALT和AST水平变化,见表1。在各个时间段,6 h时,肝损伤组ALT、AST水平较空白组有显著升高(P<0.05),并且在12、24 h时持续升高(P<0.05),48 h继续升高并达到高峰(P<0.05),提示造模成功;3 d时开始下降、7 d时继续下降,但仍显著高于空白组(P<0.05);14 d几乎恢复正常,但差异不具有统计学意义(P>0.05)。
在各时间点,ALT、AST组间两两比较,14 d时ALT、AST与0 h比较差异不具有统计学意义(P>0.05),其余组间比较差异均具有统计学意义(P< 0.05)。
2.1.3 病理分析 图2显示:空白组肝组织结构正常,肝细胞轮廓清晰,形态较为规则,胞浆均匀红染,细胞核大小正常,核质淡染,肝细胞无变性、坏死等;肝细胞索排列整齐并以中央静脉为中心呈放射状排列,肝小叶结构清晰呈多边形,大小基本一致,小叶间分界清楚,整个肝无明显充血、变形、坏死病理改变。实验组可见正常肝小叶结构紊乱,出现灶状坏死,肝小叶界限模糊、扭曲变形,中央静脉偏离或消失,肝细胞索排列紊乱,失去正常放射状排列,肝细胞变性、坏死,细胞核偏心分布,部分细胞胞核消失,间质充血伴有炎症细胞浸润,肝窦扩张其内红细胞淤积,肝窦腔隙消失,肝脏组织结构明显破坏,甚至出现大片状坏死。
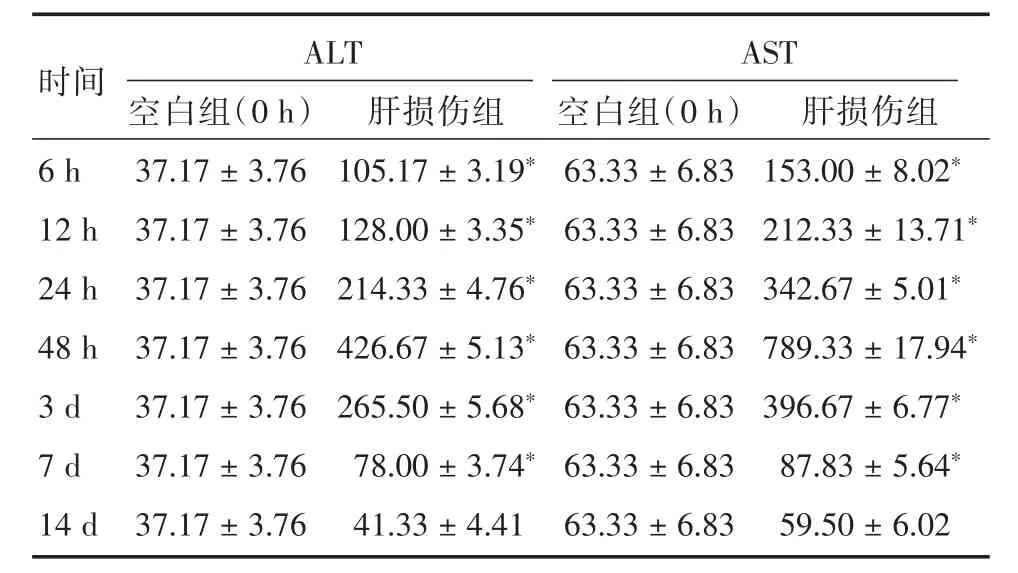
表1 各组大鼠血清ALT/AST表达Tab.1 Serum ALT and AST levels in rats x±s
2.2 Neuritin与HSP60在肝损伤修复过程中的表达变化差异 与空白组对比,Neuritin在肝损伤后6、12、24、48 h的表达量逐渐降低,并在48 h时达到最低,在损伤后3、7、14 d其表达量逐渐升高(F=172.195,P< 0.05);HSP60在肝损伤后6、12、24、48 h的表达量逐渐升高,并在48 h时表达最高,在损伤后3、7、14 d其表达量逐渐下降(F=130.731,P< 0.05)。见图3。
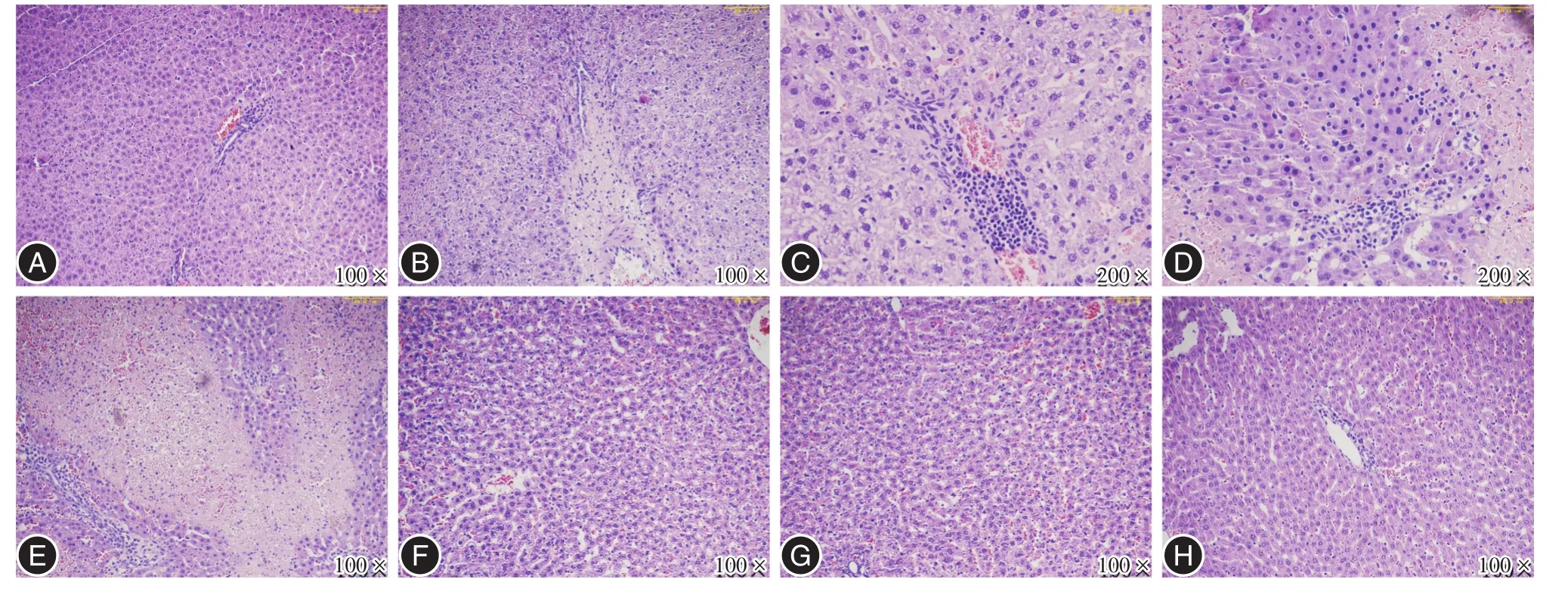
图2 各组大鼠脏组织H E染色Fig.2 Histological changes were analyzed by HE
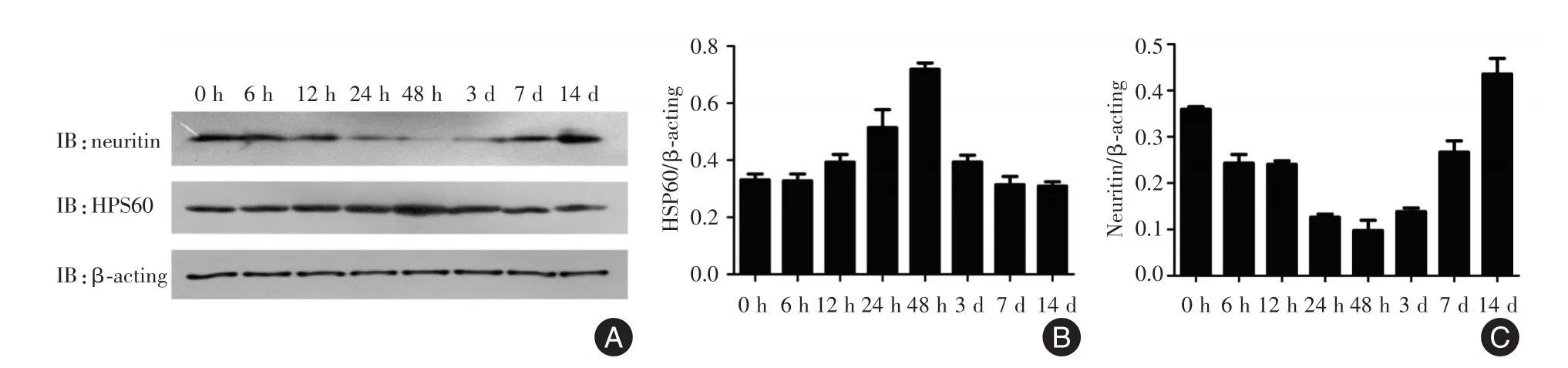
图3 Neuritin与HSP60在肝损伤修复过程中的表达变化差异Fig.3 Analysis of Neuritin and HSP60 proteins expression in acute liver injury
2.3 Neuritin、HSP60与肝损伤的相关性 相关性分析显示,在肝损伤后 6、12、24、48 h、3、7、14 d,HSP60的表达变化趋势与血清ALT、AST的变化趋势之间存在显著正相关性(r=0.898 1,P<0.001)、(r=0.925 2,P<0.001),说明HSP60的表达变化与肝损伤修复的进程密切相关;Neuritin的表达变化趋势与血清ALT、AST的变化趋势之间存在显著的负相关性(r=-0.813 1,P< 0.001)、(r=-0.832 3,P<0.001),说明Neuritin的表达变化也与肝损伤修复的进程密切相关。见图4。
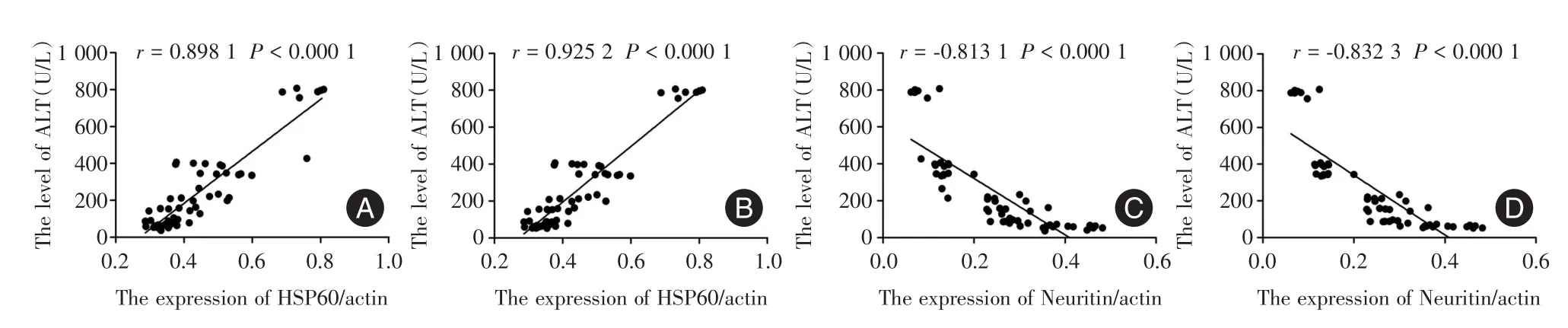
图4 Neuritin、HSP60与ALT、AST相关性分析(Pearson相关)Fig.4 Neuritin and HSP60 expression levels in relation to acute liver injury
2.4 Neuritin与HSP60在肝损伤修复过程中的相关性 相关性分析显示,在肝损伤后6、12、24、48 h、3、7、14 d,Neuritin的表达变化趋势与HSP60的表达变化趋势之间存在显著的负相关性(r=-0.060 5,P<0.001),说明Neuritin与HSP60在肝损伤修复过程中的表达变化趋势密切相关。见图5。
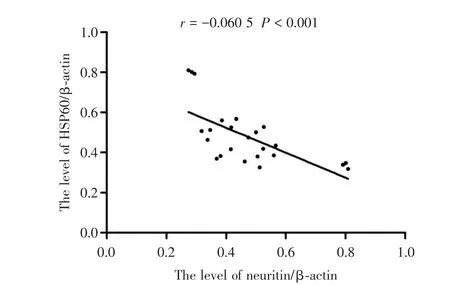
图5 Neuritin与HSP60的相关性分析(Pearson相关)Fig.5 Neuritin expression levels in relation to HSP60
3 讨论
急性肝损伤是导致患者死亡的重要原因之一[15-16],多种原因可引起肝功能异常和肝损伤[17],如药物性损伤、免疫性损伤、外伤暴力损伤等等,其具体机制异常复杂,目前尚未完全清楚,更不清楚损伤后再生修复的确切分子机制[18-20]。因此,建立稳定、有效的急性肝损伤修复动物模型是研究其损伤机制、再生以及防治的关键性技术[21]。本实验采用单纯性肝叶部分切除术建立急性肝损伤修复模型,该方法不需要解剖及阻断肝门,操作简单、成功率高,与传统的Pringle法[22]相比有效地避免了肝脏缺血再灌注的损伤和术后残肝细胞再生不良。当肝细胞发生损伤时,肝细胞膜通透性增加,ALT和AST即从细胞内逸出,使血液ALT、AST水平升高[23],在一定程度上反映了肝细胞的损伤程度[3],而血液ALT、AST升高被认为是判断急性肝损伤严重程度的经典指标[24],其随时间变化的趋势反映出损伤后再生修复的启动及进展[25]。与空白组比较,实验组ALT、AST含量显著升高并于术后48 h达到高峰,进一步肝组织病理学检测发现,空白组肝组织正常,而肝损伤组肝小叶结构破坏及肝细胞肿胀、坏死,在术后48 h最为明显,提示肝损伤逐渐加重并于术后48 h最重,血液生化及病理改变确定了该损伤模型的成立。
当机体受到有害因素刺激时,细胞内HSPs合成增加,它能保护机体(或细胞)不受或少受有害因素的伤害[13]。实验组在肝损伤后 6、12、24、48 h,其血清ALT、AST不断升高,病理组织显示肝脏损伤程度不断增加,表明肝损伤在逐渐加重,此时HSP60的表达量也逐渐上升,并且在第48小时时肝损伤程度与HSP60表达量同步达到高峰,可能是其对肝脏应激保护作用逐渐增强的表现。在肝损伤后3、7、14 d,其血清ALT、AST和病理组织显示肝脏的损伤程度逐渐降低,表明肝损伤在逐渐修复,此时HSP60的表达量也逐渐下降,说明可能随着肝损伤逐渐得到修复HSP60的应激保护作用逐渐下降。在整个肝损伤修复过程中,随着损伤的加重或修复,HSP60的表达量也随之同步变化呈正相关,说明HSP60可能参与了肝脏的损伤修复,可能体现在以下两个方面[26]:抵抗损伤和加速修复。在创伤等应激原的作用下,细胞内产生变性或异常的蛋白质,表现为肽链伸展、失去盘旋及折叠状态,分子空间构型的改变等,但此时HSP60发挥了分子伴侣作用,使蛋白质肽链重新折叠并恢复原来的构象及功能,从而在应激等不利状态下提高细胞的抵抗力起到抗损伤作用;如果蛋白变性不可逆,HSP则帮助变性蛋白质转入溶酶体加以清除,从而加速了组织的修复,因此表现为随着肝损伤的加重或修复、HSP60的表达量随之升高或降低。总之,HSP60是保护细胞结构功能免受损伤所必需的,如何加强和利用HSP60的抗损伤和促进修复作用,则是今后的研究方向之一。
Neuritin(又称 candidate plasticity-related gene 15,CPG15)[27]最初被认为是一条高度限制在神经系统表达的基因,它能促进神经突起的快速生长,后来的研究证实[28]Neuritin在肝组织中也有明显表达,并且还介导了神经系统以外其他细胞的再生。实验组在肝损伤后6、12、24、48 h,其血清ALT、AST不断升高,病理组织显示肝脏损伤程度不断增加,表明肝损伤在逐渐加重,此时Neuritin的表达量逐渐下降,并且在第48小时肝损伤程度最重时,其表达量却最低,可能是其对肝再生的作用逐渐减弱的表现。在肝损伤后3、7、14 d,其血清ALT、AST和病理组织显示肝脏的损伤程度逐渐降低,表明肝损伤在逐渐修复,此时Neuritin的表达量却逐渐上升,说明可能随着肝损伤逐渐得到修复Neuritin对肝再生的作用逐渐增强。在整个肝损伤修复过程中,随着肝损伤的加重或修复,Neuritin的表达量也呈现出一定变化规律呈负相关,说明Neuritin也可能参与了肝脏的损伤修复,但是具体分子机制目前国内外未见任何报道。我们推测:Neuritin作为神经营养因子,在肝脏组织中如同神经系统一样,可能通过以下途径促进肝损伤的再生修复:(1)Neuritin促进肝脏中神经再生:CPG15基因是神经活动和其他神经营养因子作用的下游基因[6,29-30],提示Neuritin是神经活动和各种神经生长因子的下游因子,Neuritin可以促进神经突起的生长及其分支和突触的发育成熟,调节突触回路的形成[31],而无论是神经活动的刺激还是神经生长因子的直接作用都能诱导神经突起的生长,而神经纤维的长入可影响肝损伤的再生修复;(2)Neuritin促进肝脏中血管再生:KOJIMA等[28]通过给予人脐静脉内皮细胞重组的Neuritin,发现Neuritin能够促进内皮细胞的迁移以及促进肿瘤组织中血管的生长,因而认为Neuritin可以被看做是一种血管生长因子,可增强血管内皮细胞的粘附和迁移能力,有利于新生毛细血管的生长,改善肝损伤后的血流动力学,促进肝损伤后的再生修复;(3)Neuritin与其他因子协同作用,具体有待于进一步研究。
STORTI等[32]研究发现,在应激作用下,热休克反应(heat shock response,HSR)可抑制正常蛋白的合成,却能使HSP大量表达并通过修复变性的蛋白而发挥对蛋白分子的应激保护作用。图4表明,肝损伤后48 h内,随着损伤的逐渐加重HSP60的表达量逐渐增加,而Neuritin的表达量却逐渐下降,可能是HSR一方面抑制了Neuritin等重要蛋白的合成以减少应激对其所致的蛋白分子损伤;另一方面促进了HSP60的表达量增加,以促进HSP60对损伤的Neuritin等重要蛋白的修复。肝损伤48 h以后,随着损伤因素的逐渐减弱,HSR也随之逐渐降低,一方面HSR对Neuritin等重要蛋白的合成抑制作用逐渐减弱,从而使Neuritin的表达量逐渐升高,表现出Neuritin对肝脏的再生作用逐渐增强;另一方面,HSR促进HSP60合成的作用也逐渐减弱,从而使其表达量逐渐下降。进一步相关性分析显示,在肝损伤修复的整个过程中,Neuritin与HSP60的表达变化趋势截然相反,呈显著的负相关性,该结果与STORTI等的结论相吻合,说明了两者可能共同参与了肝损伤的再生修复。
因此,HSP60不仅降低了损伤因素带来的伤害,即抵抗肝损伤;而且还促进了肝脏的再生修复,而Neuritin可能仅仅促进了肝损伤后的再生修复。基于上述研究及酵母双杂交实验[8]结果,我们大胆猜测:HSP60与Neuritin在肝损伤修复过程中可能功能相关,HSP60很可能作为Neuritin的上游因子通过某条信号通路发生相互作用而产生相应的生物效应,共同促进了肝损伤的再生修复,但具体信号通路及生物学机制有待于我们进一步深入研究,这也是本研究存在的局限性及不足之处,本课题组后续将进一步研究HSP60与Neuritin的关系及可能作用的信号通路,为研究肝损伤修复的发生发展提供新的实验依据,为肝损伤的治疗提供新的思路。
[1]SANG M S,JI H Y,KI S H.Role of the Nrf2-ARE pathway in liver diseases[J].Oxid Med Cell Longev,2013,2013(6):763257.
[2]高飞,张卫青,梁首勤,等.血清白蛋白、前白蛋白和转铁蛋白在评价慢性肝衰竭患者营养支持中的应用[J].实用医学杂志,2017,33(4):603-605.
[3]AGRAWAL S,DHIMAN R K,LIMDI J K.Evaluation of abnormal liver function tests[J].Postgrad Med J,2016,92(1086):223-234.
[4]洪慧敏,陈梦婷,王颖怡,等.一氧化氮降低对肝脏凋亡损伤的研究进展[J].实用医学杂志,2016,32(9):1533-1535.
[5]WEI W,DIRSCH O,MCLEAN A L,et al.Rodent models and imaging techniques to study liver regeneration[J].Eur Surg Res,2015,54(3-4):97-113.
[6]WIBRAND K,MESSAOUDI E,HAVIK B,et al.Identification of genes co-upregulated with Arc during BDNF-induced long-term potentiation in adult rat dentate gyrus in vivo[J].Eur J Neurosci,2006,23(6):1501-1511.
[7]黄瑾,杨磊,应康,等.人类Neuritin cDNA的克隆和表达[J].复旦学报(自然科学版),2001,40(5):521-524.
[8]罗星,张峪涵,于娜,等.神经突起因子酵母双杂交诱饵质粒构建和转化[J].中国公共卫生,2006,22(4):444-445.
[9]陈明帅,徐超,宋兴超,等.热休克蛋白的研究进展[J].经济动物学报,2016,20(1):44-53.
[10]LUO J,WEI L S,MONTELL C.TRPA1 mediates sensation of the rate of temperature change in Drosophila larvae[J].Nat Neurosci,2017,20(1):34.
[11]XU Y,ZHENG G,DONG S,et al.Molecular cloning,characterization and expression analysis of HSP60,HSP70,and HSP90,in the golden apple snail,Pomacea canaliculata[J].Fish Shellfish Immunol,2014,41(2):643-653.
[12]SHI J,FU M,ZHAO C,et al.Characterization and function analysis of Hsp60 and Hsp10 under different acute stresses in black tiger shrimp,Penaeus monodon.[J].Cell Stress Chaperones,2016,21(2):295-312.
[13]YAN Z,WEI H,REN C,et al.Gene expression of Hsps in normaland abnormalembryonic developmentofmouse hindlimbs[J].Hum Exp Toxicol,2015,34(6):563-574.
[14]王朝阳,朱美意,张宏伟,等.一种急性肝损伤再生修复模型的建立[J].中华灾害救援医学,2017,5(12):671-676.
[15]LICATA A.Adverse drug reactions and organ damage:The liver[J].Eur J Intern Med,2016,28:9-16.
[16]LIMDI J K,HYDE G M.Evaluation of abnormal liver function tests[J].Postgrad Med J,2016,79(932):307-312.
[17]TAYLOR S A,WHITINGTON P F.Neonatal acute liver failure[J].Liver Transpl,2016,22(5):677.
[18]徐土炳,李莉,罗兴迪,等.骨髓间充质干细胞在肝细胞损伤恢复中的作用[J].实用医学杂志,2017,33(5):687-692.
[19]HAI Z,JIN L,WANG L R,et al.Methimazole-induced cholestatic hepatitis:two cases report and literature review[J].Oncotarget,2016,7(4):5088-5091.
[20]张慧平,张超,李方跃,等.奥曲肽通过抑制内质网应激减轻肝纤维化大鼠肝损伤[J].实用医学杂志,2017,33(13):2113-2116.
[21]MCGONIGLE P,RUGGERI B.Animal models of human disease:challenges in enabling translation[J].Biochem Pharmacol,2014,87(1):162.
[22]YU Z,YANG H,DENG X,et al.Intermittent Pringle maneuver versus continuous hemihepatic vascular inflow occlusion using extra-glissonian approach in laparoscopic liver resection[J].Surg Endosc,2016,30(3):1-10.
[23]DONG D,ZHANG S,YIN L,et al.Protective effects of the total saponins from Rosa laevigata Michx fruit against carbon tetrachloride-induced acute liver injury in mice[J].Food Chem Toxicol,2013,62:120.130.
[24]WORETA T A,ALQAHTANI S A.Evaluation of abnormal liver tests[J].Med Clin North Am,2014,98(1):1-16.
[25]STRIFLER G,TUBOLY E,SZEL E,et al.Inhaled methane limits the mitochondrial electron transport chain dysfunction during experimental liver ischemia-reperfusion injury[J].PLoS One,2016,11(1):e0146363.
[26]SPECIALE A,CHIRAFISI J,SAIJA A,et al.Nutritional antioxidants and adaptive cell responses:an update[J].Curr Mol Med,2011,11(9):770.
[27]DINGDING H,BO Q,GUOQING L,et al.Characterization of neuritin as a novel angiogenic factor[J].Biochem Biophys Res Commun,2011,415(4):608-612.
[28]KOJIMA N,SHIOJIRI N,SAKAI Y,et al.Expression of neuritin during liver maturation and regeneration[J].FEBS Lett,2005,579(21):4562.
[29]CAPPELLETTI G,GALBIATI M,RONCHI C,et al.Neuritin(cpg15)enhances the differentiating effect of NGF on neuronal PC12 cells[J].J Neurosci Res,2007,85(12):2702-2713.
[30]KARAMOYSOYLI E,BURNAND R C,TOMLINSON D R,et al.Neuritin mediates nerve growth factor-induced axonal regeneration and is deficient in experimental diabetic neuropathy[J].Diabetes,2008,57(1):181-189.
[31]SATO H,FUKUTANI Y,YAMAMOTO Y,et al.Thalamus-derived molecules promote survival and dendritic growth of developing cortical neurons[J].J Neurosci,2012,32(44):15388-15402.
[32]STORTI R V,SCOTT M P,RICH A,et al.Translational control of protein synthesis in response to heat shock in D.melanogaster cells[J].Cell,1980,22(3):825-834.
