LC-MS/MS法测定Beagle犬血浆中ET-26盐酸盐及其代谢产物ET-acid
2018-07-05刘美玲陈星宇赵志玲张文胜徐小平钱广生
刘美玲, 陈星宇, 赵志玲, 张文胜, 徐小平, 钱广生
(1. 四川大学华西药学院,四川 成都 610041; 2. 四川大学华西医院 转化科学中心麻醉与危重急救研究室,四川 成都 610041)
0 引 言
ET-26盐酸盐是短效麻醉药物依托咪酯(Etomidate )的新类似物,它是由依托咪酯经过水解,酯化而形成的活性咪唑类衍生物[1]。ET-26盐酸盐与依托咪酯有类似的药理特点,具有全身麻醉和镇静作用,且起效快、苏醒迅速,对心血管的稳定性好[2],还很大程度上克服了依托咪酯的肾上腺素抑制作用[3]。目前对于生物样品中ET-26盐酸盐的含量检测方法报道较少,有文献报道用容量法[4]对ET-26盐酸盐进行检测,该方法虽简便,但是灵敏度较低,不适合用于生物样品的检测。也有文章使用GC-MS[5]对ET-26盐酸盐进行检测,ET-26盐酸盐在制备过程中易产生有关物质依托咪酯酸及依托咪酯,影响ET-26盐酸盐的分离测定,该方法未能对其杂质依托咪酯酸进行分离检测,且方法灵敏度低,难以满足临床上个体血药浓度监测的需求。杨姗姗等[1]用HPLC方法成功分离了依托咪酯酸、依托咪酯及ET-26盐酸盐,也为本研究分离依托咪酯酸和ET-26盐酸盐提供了参考。依托咪酯的检测方法主要有高效液相色谱法[6-8]、气相色谱法[9-10]、气质联用[11-12]等。由于ET-26盐酸盐与依托咪酯结构相似,可参考测定生物样品中的依托咪酯的方法。考虑到生物样本中血药浓度低,且样本成分复杂,仅用高效液相色谱法难以达到生物样本中检测灵敏度和专属性的要求,本课题拟采用具有高灵敏度和高选择性的液相-质谱联用法测定血浆中ET-26盐酸盐的含量。
1 实验部分
1.1 仪器、试剂与实验动物
Agilent 1200 高效液相色谱仪;Agilent G6460型三重四级杆质谱仪(Agilent Mass-Hunter工作站);Beckman P/ACE MDQ仪(Beckman 32 Karat工作站,Beckman Coulter公司);十万分之一电子分析天平(Sartorious ME215s,Sartorious CPA225D);pH计(METTLER-TOLEDO,320pH meter,Metter-Toledo仪器上海有限公司);漩涡混匀仪(IKA MS3 basic);MILLI-Q超纯水纯化仪;CHMEDA Excel 210SE型麻醉机(美国CHMEDA公司):PHILIPS 150B3监护仪(苏州飞利浦消费电子有限公司);BL-420E+型生物机能实验系统(成都泰盟科技有限公司)。
氨水、乙酸、甲酸、无水乙醇、甲醇、乙腈均为色谱纯。ET-26盐酸盐对照品(20140218,含量99.57%),实验室精制;依托咪酯酸对照品(20140211批,含量91.40%),实验室自制;依托咪酯(101131-201001),依托咪酯杂质C{1-methylethyl 1-[(1RS)-1-phenylethyl]-1H-imidazole-5-carboxylate},均购自中国药品生物制品检定所。
成年健康Beagle犬9只,体重7~10 kg(由四川省医科院实验动物研究所提供)。
1.2 对照品储备液与内标溶液的配制
精密称取ET-26盐酸盐对照品、依托咪酯酸对照品各10 mg,至10 mL容量瓶中,加甲醇溶解并稀释至刻度,分别作为对照品储备液,4 ℃保存备用。取依托咪酯杂质C(内标)11 mg,至50 mL容量瓶中,加甲醇溶解并稀释至刻度,作为内标储备液,4 ℃保存备用。内标储备液临用前用乙腈稀释至11 ng/mL,作为内标溶液。
1.3 血浆样品的预处理
取血浆样品100 μL置于1.5 mL EP管中,加入含乙腈的内标溶液400 μL,涡旋混匀2 min(2 500 r/min) ,离心20 000g× 10 min,取上清液100 μL于1.5 mL EP管中,加入等体积的无水乙醇,涡旋混匀2 min (2 500 r/min), 取上清液5 μL进样分析。
1.4 色谱条件
分析柱:Agilent Extend-C18 (3.0 mm × 100 mm,3.5 μm);流动相:水(0.01% NH3,用乙酸调pH至9.0)-乙腈,体积比 35:65;流量:0.3 mL/min;柱温:30 ℃;进样盘温度:10 ℃;洗针液体:乙醇-水(体积比 3:1),洗针10 s;进样体积:5 μL;进样溶液:乙腈-乙醇(体积比 1:1)。
1.5 质谱条件
离子源:ESI 源;雾化气和辅助气 :氮气;离子源温度:300 ℃;气体流量:5 L/min;喷雾器压力:45 psi(1 psi = 6.895 kPa);鞘气温度:250 ℃;鞘气流量:11 L/min;毛细管电压:3500 V;辅助电压:500 V;扫描方式:多反应监测(MRM) ,正离子模式;用于定量分析的检测离子对为:ET-26盐酸盐,m/z275.3/105.1; 依托咪酯酸,m/z217.0/113.1;依托咪酯杂质C(内标),m/z259.0/155.1。
2 结果与讨论
2.1 样品前处理方法的选择及优化
2.1.1 沉淀剂的选择
本实验筛选了甲醇、乙腈、乙醇作为沉淀剂,通过依托咪酯酸的峰面积,考察沉淀效果。其中乙腈沉淀蛋白效果最好,甲醇和乙醇沉淀蛋白絮状物较多,考虑到进样溶剂为乙腈-乙醇(1:1),故进一步考察了乙腈:乙醇体积比1:1,4:1,9:1为沉淀剂的沉淀效果,结果显示单独以乙腈为沉淀剂,效果最好。
2.1.2 沉淀剂体积的选择
通过依托咪酯酸的峰面积,考察乙腈与血浆体积比分别为1:2,1:3,1:4时蛋白的沉淀效果。结果表明,血浆:乙腈(1:4)沉淀最干净,且峰面积响应值最大,故以此为蛋白沉淀剂。
2.2 色谱条件的选择及优化
2.2.1 流动相的选择
对于+ESI离子源,流动相一般采用10 mmol/L的甲酸或者乙酸溶液,但实验发现采用甲酸或者乙酸等偏酸性溶液会使得ET-26盐酸盐部分解离,存在分子型和离子型两种形式[13],导致基线不稳,从而影响测定结果。结合本品色谱条件在偏碱性条件下分离效果较好,考察了0.01% NH3(乙酸调节pH至8.0,9.0,10.0)为流动相A,乙腈为流动相B时,基线的漂移情况。结果发现流动相改为碱性后ET-26盐酸盐不会解离,且基线平稳。同时,流动相B的pH为9.0时,峰形较好。流动相体积比A:B =35:65时,各色谱峰分离较好,且出峰时间合适。
2.2.2 进样溶液的选择
分别考察乙腈、甲醇、乙醇、乙腈-水(1:1)、乙腈-甲醇(1:1)、乙腈-乙醇(1:1)为进样溶液时,各色谱峰的峰形以及分离情况。结果表明,以乙腈为进样溶液时,由于溶剂与初始流动相极性差异较大,依托咪酯酸容易分裂成两个峰,以甲醇,乙醇为进样溶液时,依托咪酯酸的响应值较小。乙腈与乙醇的混合溶液为进样溶液时峰面积响应最大,且峰形较好。
进一步考察了乙腈与乙醇不同混合比例对依托咪酯酸峰面积响应值的影响,结果表明乙腈-乙醇(1:1)为进样溶液时,依托咪酯酸响应值及峰形最好,因此将其作为最终进样溶液。
2.3 质谱条件的选择及优化
2.3.1 ET-26盐酸盐定量离子对的选择
在+ESI离子化方式下,进行ET-26盐酸盐的母离子扫描(Q1 scan),产生准分子离子[M+H]+峰:m/z275.3,在子离子扫描(product ion scan)模式下扫描子离子,选取丰度最高、信号最强的子离子:m/z171.1作为定量离子对。但实验发现若采用这一丰度最大的离子对进行定量,ET-26盐酸盐极易在色谱柱上残留,而其丰度值稍小的离子对m/z275.3/105.1也能达到相应的响应要求且不易在色谱柱上残留,故最终选择了m/z275.3/105.1为MRM定量的离子对。采用Agilent G6460型三重四级杆质谱仪自带的Agilent Optimizer工作站自动优化功能优化所有质谱参数以获得较高的灵敏度。
2.3.2 依托咪酯酸定量离子对的选择
实验采用流动相:水(0.01% NH3,用乙酸调pH至9.0)-乙腈(35:65),对依托咪酯酸进行母离子扫描(Q1 scan),产生准分子离子[M+H]+峰:m/z217.0,然后在子离子扫描(product ion scan)模式下扫描子离子,选取丰度最高、信号最强的子离子:m/z113.1,采用Agilent G6460型三重四级杆质谱仪自带的Agilent Optimizer工作站自动优化功能优化所有质谱参数以获得较高的灵敏度。
2.3.3 内标的选择
生物样品测定中,由于前处理步骤较多,容易引入较大的误差,因此引入内标十分必要。本实验选择的内标有英国药典上的依托咪酯、美托咪酯(依托咪酯杂质B)、依托咪酯杂质C。其结构均与待测物ET-26盐酸盐及其代谢产物依托咪酯酸(依托咪酯杂质A)结构类似。依托咪酯的总离子流色谱图(m/z245.0/141.0,碎裂电压80 V,碰撞能量4 eV)的保留时间tR为16.5 min,相较于待测物ET-26盐酸盐的保留时间tR更长,延长了分析时间。实验发现,美托咪酯在24h内不能在样品中稳定存在,容易分解。而依托咪酯杂质C与待测物ET-26盐酸盐可以完全分离,出峰时间较快,且其在10 ℃条件下可以稳定保存24 h,因此最终选择依托咪酯杂质C作为内标。对其进行优化后最优定量离子对为m/z259.0/155.1。
2.4 特异性实验
平行取来自6个不同个体的正常Beagle犬空白血浆,均同时加入ET-26盐酸盐、依托咪酯酸及依托咪酯杂质C,按照1.3项下方法处理。另取Beagle犬静脉注射定量ET-26盐酸盐10 min后所得血浆样品,按照1.3项下方法处理,在选定的色谱条件测定,结果如图1~图3所示,血浆中内源性物质对待测物及内标的测定无干扰。
2.5 标准曲线,线性范围与定量限、检测限
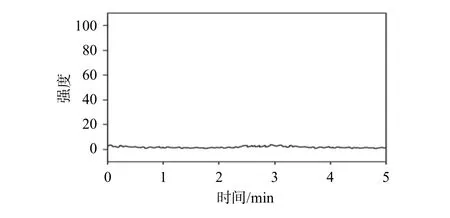
图1 空白血浆处理后依托咪酯酸、ET-26盐酸盐、内标总离子流色谱图
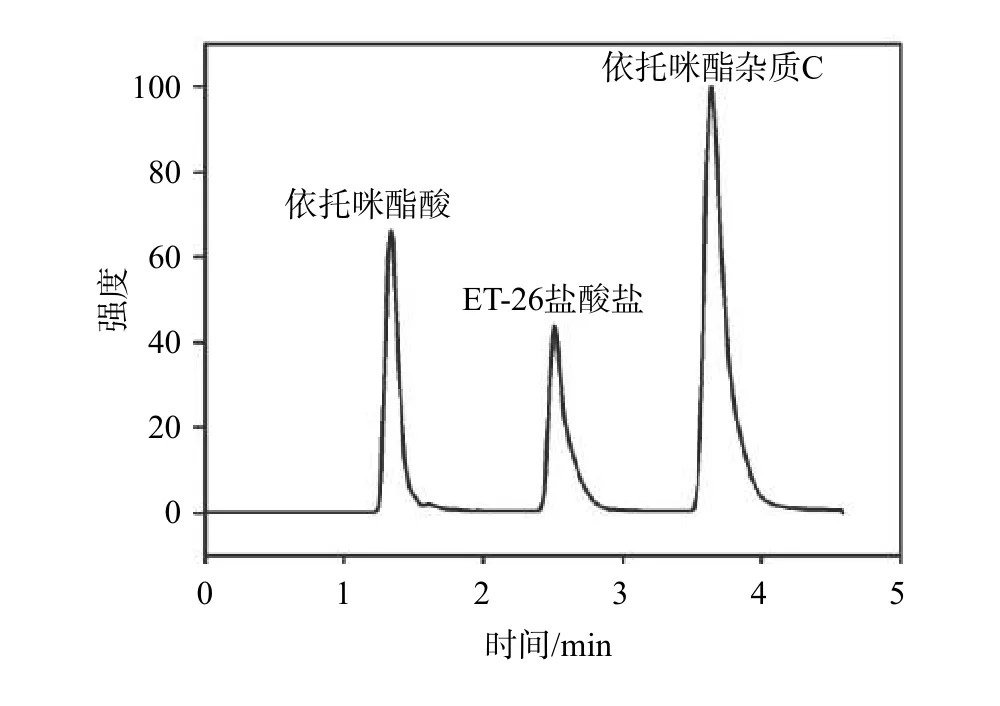
图2 空白血浆加依托咪酯酸、ET-26盐酸盐,依托咪酯杂质C处理后总离子流色谱图
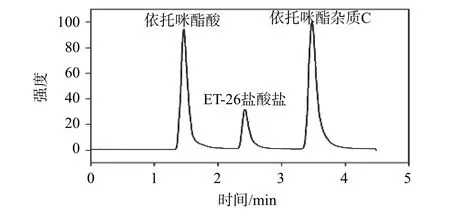
图3 Beagle犬静脉注射定量ET-26盐酸盐10 min后所得血浆样品处理后总离子流色谱图
取正常Beagle犬空白血浆80 μL各8份,分别加入质量浓度为20 900,10 450,3 483,1 161,387.0,129.0,64.51,32.25 ng/mL的ET-26盐酸盐标准溶液10 μL,质量浓度为21 080,10 540,3 513,1 171,390.4 ,130.1 ,65.06,32.53 ng/mL的依托咪酯酸标准溶液10 μL,分别按1.3项处理,并按优化的色谱质谱方法检测。以血浆浓度为横坐标,标准溶液与内标的峰面积之比为纵坐标作图,结果表明ET-26盐酸盐,依托咪酯酸分别在3.225~2 090 ng/mL和3.253~2 108 ng/mL范围内线性良好,其线性回归方程分别为y= 0.008 13x- 0.005 64 (r= 0.999 8),y= 0.005 1x+ 0.026 55 (r= 0.999 8)。取主峰峰高约为基线噪声的10倍(S/N= 10)作为定量限,ET-26盐酸盐、依托咪酯酸定量限分别为3.225 ng/mL、3.253 ng/mL。取主峰峰高约为基线噪声的3倍(S/N= 3)作为检测限,ET-26盐酸盐、依托咪酯酸的检测限分别为0.970 0 ng/mL、1.000 ng/mL。
2.6 回收率考察
取9份正常Beagle犬空白血浆80 μL,分别加入低中高3个浓度的ET-26盐酸盐标准溶液(129.0,1 161,10 450 ng/mL)和依托咪酯酸标准溶液(130.1,1 171,10 540 ng/mL)各10 μL,设3个平行。同时取9份同等体积的乙腈溶液80 μL,加样情况同上。按照1.3 项下血浆样品的预处理方法处理,以空白加标血浆中待测物与内标的比值Ai除以乙腈溶液中待测物与内标的比值As,其结果作为回收率考察。结果表明 Beagle 犬血浆中ET-26盐酸盐低,中,高浓度回收率分别为86.57% ± 3.3%,90.25% ± 0.57%,105.03% ± 0.90%;依托咪酯酸的低,中,高浓度回收率分别为96.54% ± 1.4%,95.94% ± 0.87%,98.27% ± 0.53%,结果表明该方法回收率高。
2.7 基质效应
取9份正常Beagle犬空白血浆80 μL,分别置于1.5 mL EP管中,加空白乙腈溶液400 μL,涡旋混匀2 min(2 500 r/min) ,离心20 000g× 10 min ,取上清液置于1.5 mL EP管中,氮气吹干,加入含乙腈的内标溶液400 μL复溶,再加入80 μL纯乙腈。分别加入低中高3个浓度的ET-26盐酸盐标准溶液(129.0,1 161,10 450 ng/mL)和依托咪酯酸标准溶液(130.1,1 171,10 540 ng/mL)各10 μL,作为A组,设3个平行。
同时取9份同等体积的乙腈溶液80 μL置于1.5 mL EP管中,加入含乙腈的内标溶液400 μL,分别加入低中高3个浓度的ET-26盐酸盐标准溶液(129.0,1 161,10 450 ng/mL)和依托咪酯酸标准溶液(130.1,1 171,10 540 ng/mL)各10 μL,作为B组,设3个平行。两组样品均按照1.3项下样品的预处理方法,取上清液5 μL 进样分析。测得ET-26盐酸盐的低、中、高3种浓度的基质效应分别是88.13% ± 4.2%,89.21% ± 2.5%,91.42% ± 2.6%;依托咪酯酸的低、中、高3种浓度的基质效应分别是86.10% ± 5.3%,88.52% ± 3.5%,90.35% ± 2.5%,结果表明基质效应不影响实验结果测定。
2.8 日内、日间精密度
取18份正常Beagle犬空白血浆80 μL,分别加入低中高3个浓度的ET-26盐酸盐标准溶液(129.0 ,1 161,10 450 ng/mL)、依托咪酯酸标准溶液(130.1,1 171,10 540 ng/mL)各10 μL,每种浓度的样品各6份。连续3 d制备样品,测定3批样品精密度。按照1.3 项下处理后进样,计算血浆中ET-26盐酸盐和依托咪酯酸峰面积与内标的比值,代入标准曲线,求得实测浓度。计算日内和日间的精密度。测定结果如表1~表3所示。
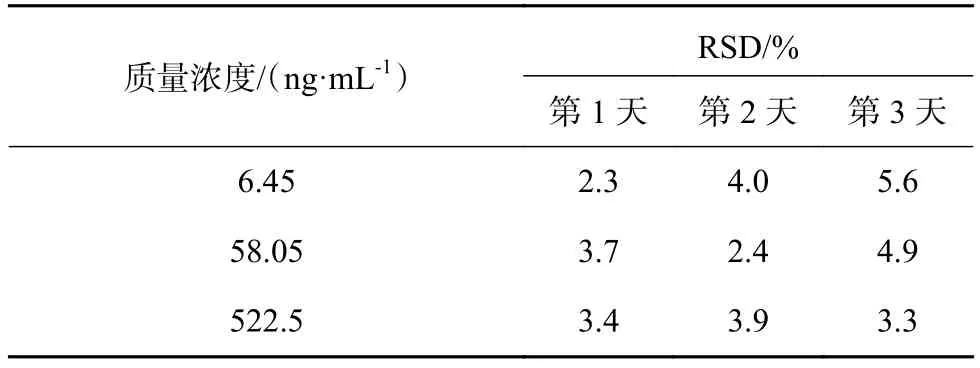
表1 Beagle犬血浆中ET-26盐酸盐日内精密度测定结果( n = 6)
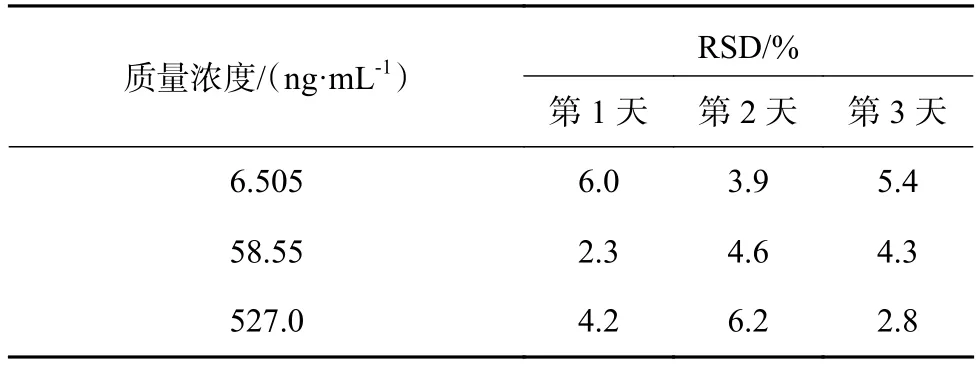
表2 Beagle犬血浆中依托咪酯酸日内精密度测定结果( n = 6)
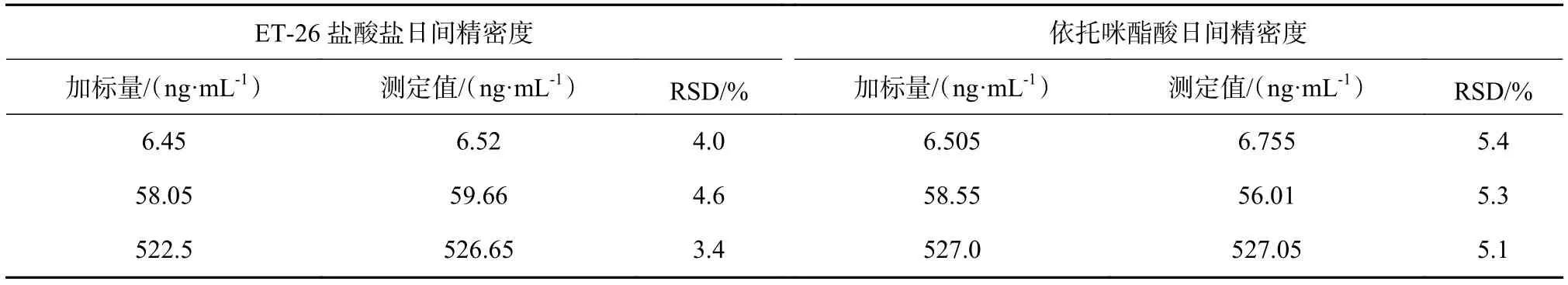
表3 Beagle犬血浆中ET-26盐酸盐、依托咪酯酸日间精密度测定结果
2.9 稳定性考察
2.9.1 储备液长期冷藏放置的稳定性
将ET-26盐酸盐储备液(1.045 mg/mL)、依托咪酯酸储备液(1.054 mg/mL)于4 ℃条件下放置7,14,30 d 后,按照1.2项下,稀释后进样分析,以考察储备液长期冷藏的稳定性。结果表明,ET-26盐酸盐储备液于4 ℃条件下放置30 d后的平均偏倚率为-0.33%,依托咪酯酸盐储备液于4 ℃条件下放置30 d后的平均偏倚率为0.28%,故储备液可在4 ℃条件下放置30 d。
2.9.2 样品处理前冰冻(-80 ℃)的稳定性
考察样品处理前在-80 ℃下放置的稳定性,即取配置好的含低、中、高3种浓度的空白血浆加标样品,在-80 ℃下放置,分别于第15 d、30 d取样测定。测定结果显示,ET-26盐酸盐和依托咪酯酸的低、中、高浓度变化的RSD值均在3.8% ~ 7.8%之间,说明该样品处理前可在-80 ℃条件下放置30 d。
2.9.3 样品处理前冻融稳定性
取配制好的低、中、高3种浓度空白血浆加标样品,分别在室温与-80 ℃条件下反复冻融3次后取样分析。ET-26盐酸盐和依托咪酯酸的低、中、高浓度变化的RSD分别在5.3% ~ 7.3%和2.7% ~7.4%之间,说明该样品处理前冻融稳定性良好。
2.10 药动学参数
取9只成年Beagle犬禁食12 h,分为高、中、低3组,分别静脉注射给药7.68,3.84,1.92 mg/kg,给药后均在0.5,1,2,3,4,5,10,20,30,60,120,180,240,300 min后采集静脉血0.8 mL于编号后的离心管中,迅速加入40 μL氟化钠(40 mg/mL),上下翻转混合,3 500 r/min离心15 min制备血浆,取出上层血浆,分两份转入1.5 mL的EP管中,于-80 ℃保存。待测血浆按照1.3 项下处理后进样,并计算每个血浆样本的血药浓度,其高、中、低浓度药时曲线如图4~图6所示。实验中所测得的所有血药浓度数据,用DAS3.2.1软件进行优度选择和房室模型拟合。给药剂量为1.92,3.84,7.68 mg/kg时的主要药代动力学参数分别为:t1/2=78.96,36.51,32.947 min; AUC(0-t)= 46.09,570,565.3 μg·L-1·min;AUC(0-∞)= 47.70,577,567.9 μg·L-1·min;表观分布容积V= 4 369,351.1,591.85 L/kg;CL = 40.95,6.67,12.449 L/(min·kg)。
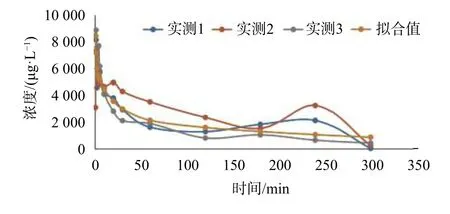
图4 Beagle犬高剂量组血浆药物(ET-26盐酸盐)浓度-时间图(Dose: 7.68 mg/kg)
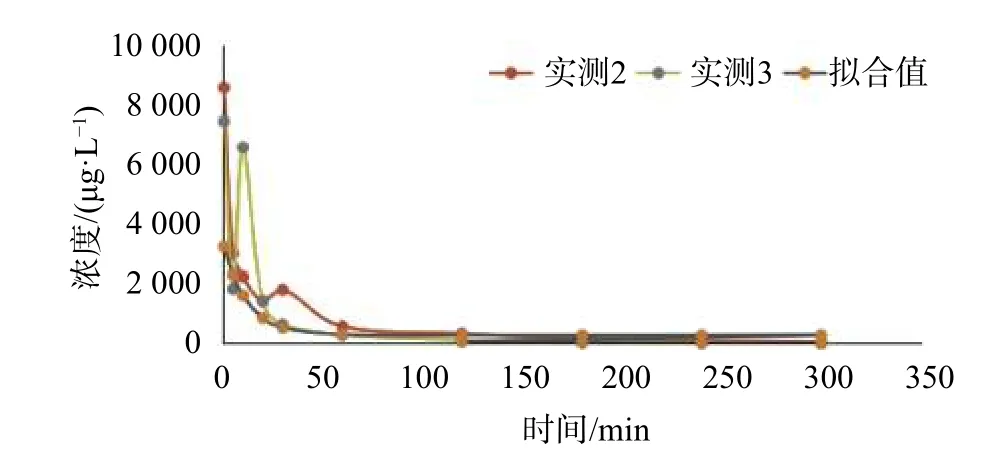
图5 Beagle犬中剂量组血浆药物(ET-26盐酸盐)浓度-时间图(Dose: 3.84 mg/kg)
3 结束语
本实验成功建立了用LC-MS/MS准确测定Beagle犬血浆中ET-26盐酸盐及其代谢产物依托咪酯酸的实验方法。该方法在+ESI离子化方式下,以依托咪酯杂质C的定量离子对为m/z259.0/155.1为内标,通过检测ET-26盐酸盐的碎片离子m/z275.3/105.1进行MRM定量。该方法稳定性良好,提取回收率高,内源性杂质无干扰,基质不影响检测结果,能有效应用于Beagle犬血浆中ET-26盐酸盐及其代谢产物依托咪酯酸的定量检测。
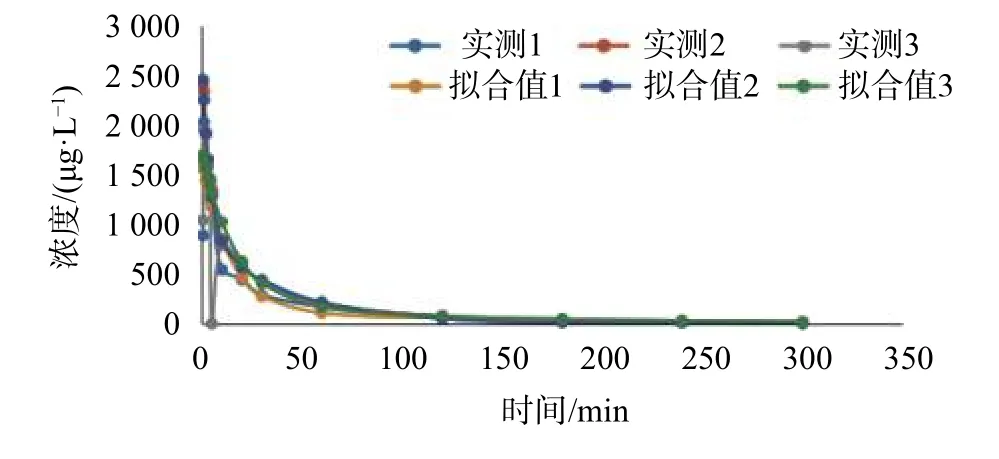
图6 Beagle犬低剂量组血浆药物(ET-26盐酸盐)浓度-时间图(Dose: 1.92 mg/kg)
[1]杨姗姗, 张贝, 王裴珮, 等. HPLC测定ET–26盐酸盐中的有关物质[J]. 华西药学杂志, 2017, 32(1): 95–98.
[2]刘星星, 张文胜. 依托咪酯类似物的研究进展[J]. 华西药学杂志, 2015, 30(5): 617–619.
[3]WANG B, JIANG J, YANG J, et al. Pharmacologic studies on ET–26 hydrochloride in a rat model of lipopolysaccharide–induced sepsis[J]. European Journal of Pharmaceutical Sciences, 2017, 109(9): 441–445.
[4]付仕娅, 赵志玲, 王裴珮, 等. 容量法测定ET–26盐酸盐的含量[J]. 华西药学杂志, 2016, 31(1): 82–84.
[5]康仪, 钟艺, 宫德瀛, 等. GC–MS法测定SD大鼠血浆中的盐酸ET–26[J]. 华西药学杂志, 2017, 32(3): 278–280.
[6]ZHANG H, AILING M A, WANG Y, et al. Determination of etomidate concentration in plasma by HPLC[J]. China Medicine & Pharmacy, 2015, 30(6): 1125–1128.
[7]YAN K, ZHU X, ZHAO L. HPLC determination of etomidate in human plasma[J]. Chinese Journal of Pharmaceutical Analysis, 2010, 30(4): 1125–1128.
[8]王发, 张秉华, 郭欢迎, 等. HPLC法测定依托咪酯注射液的含量及有关物质[J]. 西北药学杂志, 2010, 25(4): 253–255.
[9]KULPMANN W R, KLOPPENBORG A, KOHL B. Drug monitoring by gas–chromatography A) tocainide—B)etomidate[J]. Fresenius Zeitschrift Für Analytische Chemie,1984, 317(6): 667–668.
[10]LUHMANN I, SZATHMARY S C. Sensitive and automated gas chromatographic method for the determination of etomidate in plasma samples[J]. Journal of Chromatography B Biomedical Sciences & Applications, 1990, 532(1): 150.
[11]DENG X, SIMPSON V. Gas chromatographic––mass spectrometric determination of etomidate in mouse brain.[J].Journal of Pharmacological & Toxicological Methods, 2000,43(1): 73.
[12]MOLINA D K, HARGROVE V M, RODRIGUEZ R G.Distribution of etomidate in a fatal intoxication.[J]. Journal of Analytical Toxicology, 2008, 32(8): 715.
[13]赵志玲, 王裴珮, 钱广生, 等. 紫外分光光度法测定ET–26盐酸盐的离解常数[J]. 华西药学杂志, 2016, 31(1): 66–68.
