微波辅助萃取-高效液相色谱法同时测定PM2.5中16种多环芳烃
2018-07-05袁小雪谢碧俊
刘 滔, 游 钒, 袁小雪, 谢碧俊, 雍 莉, 胡 彬
(四川省疾病预防控制中心理化检验所,四川 成都 610041)
0 引 言
多环芳烃(PAHs)是一类典型的持久性有机污染物,由2个及以上不含杂原子和取代基的苯环构成,其主要来源为石化燃料及其他物质的不完全燃烧。大气细颗粒物PM2.5中PAHs的浓度虽然很低,但其毒害性较大,被人体呼吸系统吸入,有致癌、致畸、致基因突变等效应[1-2]。因此,PM2.5中PAHs的污染已经引起世界各国的普遍关注,美国国家环保总署确定了16种PAHs作为优先监测并控制的污染物,2012年我国环保部发布了GB 3095——2012《环境空气质量标准》,也同样新增了PM2.5中PAHs等一系列监测指标。
目前,文献报道的PM2.5中PAHs的分析方法主要有高效液相色谱法(HPLC)[3-4]和气相色谱-质谱联用法(GC-MS)[5-6]。GC-MS法具有高灵敏、高定性能力,但分析高沸点PAHs及对其同分异构体的分离存在一定的困难;而HPLC法不受组分挥发性和热稳定性限制,具有操作简便、灵敏度高、成本低等优势而被广泛使用。前处理方法主要有索氏萃取法[7-8]、固相微萃取[9-10]、超临界流体萃取[11]、加速溶剂萃取[12-14]和超声波萃取[15-16]。其中,索氏萃取法提取效率高,但操作繁琐费时,消耗有机溶剂量大,且萃取后需进一步浓缩;固相微萃取方法萃取效率高,速度快,但成本较高,萃取所用纤维易碎,聚合物的涂层性质不稳定容易产生样品携带等;超临界流体萃取法由于适用于非极性或低极性 PAHs 的萃取,应用范围相对较窄,且技术成本较高;加速溶剂萃取法操作简便,萃取效率较高,但其后处理操作步骤多,组分损失较大;超声辅助萃取法操作简单、快速,但有机试剂扩散严重,萃取效率较低,且共提取物较多。而微波辅助萃取作为一种较高效的样品前处理方法已被成功地用于土壤、海水、河流沉积物及植物等样品中PAHs的提取[17]。本文优化了微波萃取时间、溶剂及用量,微波辐射功率等萃取条件,建立了磁力搅拌辅助微波萃取-高效液相色谱法同时测定PM2.5中16种优控多环芳烃的方法。
1 实验部分
1.1 试剂
16种PAHs混合标准溶液(萘、苊烯、苊、芴、菲、蒽、荧蒽、芘、苯并[a]蒽、屈、苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、二苯并[a,h]蒽、苯并[g,h,i]芘、茚并[1,2,3-cd]芘),乙腈为溶剂,每个组分的质量浓度均为500 μg/mL,Accstandard试剂公司;乙腈、正己烷、丙酮、二氯甲烷(HPLC级,Scientific试剂公司);超纯水(电阻率≥18.0 MΩ·cm)。
1.2 仪器及设备
1260高效液相色谱仪(美国安捷伦公司,同时配二极管阵列紫外检测器和多波长荧光检测器);多环芳烃液相色谱专用柱(4.6 mm×150 mm×5 μm,美国安捷伦公司);Milli-Q超纯水仪(美国Millipore公司);N-EVAP-112氮吹仪(美国Organomation公司);MARS X微波萃取仪(美国CEM公司);TH-150C型中流量PM2.5采样器(武汉市天虹仪表有限责任公司);玻璃纤维滤膜(美国Pall公司,直径90 mm)。
1.3 仪器分析条件
乙腈作为流动相A相,超纯水作为B相,其梯度洗脱程序为:0~20 min,40%A;20~25 min,40%A→100%A;25~30 min,40%A。流动相流量为2.0 mL/min,柱温为25 ℃,进样量为10 μL,紫外、荧光串联检测器检测。如表1所示,荧光检测器设定了波长切换程序,16种PAHs中仅苊烯不具有荧光,选择紫外波长220 nm对其进行检测。
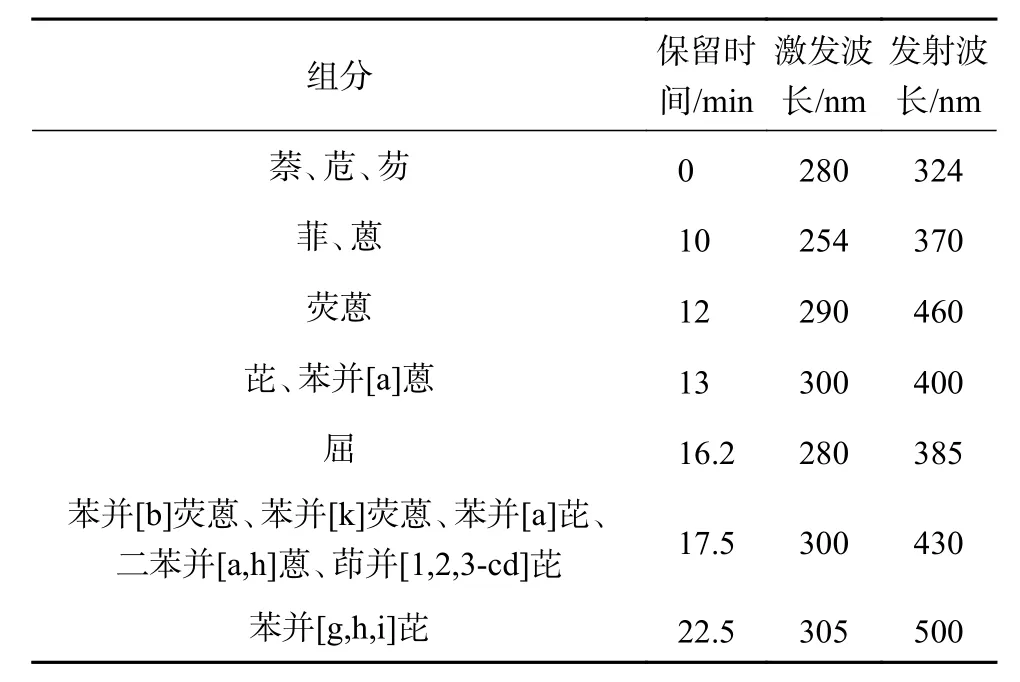
表1 荧光检测器波长切换程序
1.4 样品的采集
在成都市区域内设置3个采样点,于2016年2月连续采样7 d,2016年3月连续采样10 d(3月为雾霾天气,固连续采样10 d),采样流量为100 L/min,采样时间为24 h,采样点均避开污染源及障碍物。采样时,记录温度及大气压以换算标准采样体积。采样前,将玻璃纤维滤膜置于马弗炉中500 ℃下加热烘烤4 h,除掉有机物,冷却后将其放在恒温恒湿箱中平衡24 h后用十万分之一电子天平进行称量恒重,采样完成后将其再次平衡称量,采集样品低温保存(-18 ℃以下),并尽快完成多环芳烃提取及测定。
1.5 样品预处理
将采样后的玻璃纤维滤膜除去边缘无尘部分,然后用切割器将滤膜切为四等份,将四分之一滤膜剪碎后放入微波萃取罐内进行提取。微波提取条件为微波功率300 W,微波辐射6 min,压力0.3 MPa,萃取溶剂为正己烷-丙酮(体积比 2:1,总体积为15 mL),并采用磁力搅拌附件对样品进行提取。萃取完成后,将萃取液过滤后经氮吹仪浓缩至1 mL以下,再向浓缩液中加入一定量的乙腈,浓缩至1 mL以下,重复1次,将其溶剂完全置换为乙腈,最后定容至1.0 mL待测。
将未经采样的玻璃纤维滤膜置于马弗炉中500 ℃下加热烘烤4 h,去除有机物及增加滤膜韧性,冷却后将滤膜放在恒温恒湿箱中平衡制得空白滤膜。将滤膜切为四等份,用进样针向四分之一滤膜中滴加不同体积的不同浓度标准溶液,滤膜再次平衡,低温保存(-18 ℃以下),制得空白加标样品。
2 结果与讨论
2.1 微波提取条件优化
2.1.1 提取溶剂及用量
考虑到微波萃取的特点及16种PAHs的理化性质,选取正己烷/丙酮(v/v1:1,2:1)、二氯甲烷/丙酮(v/v1:1,2:1)、正己烷/二氯甲烷(v/v1:1,2:1)不同体积比的萃取溶剂进行提取。萃取条件为:微波功率300 W,萃取时间6 min,萃取压力0.3 MPa,以此考察16种PAHs的萃取效果。如图1所示,可知用正己烷-丙酮(2:1)提取时,提取效率最高。因为PAHs在丙酮中的溶解度较大,PAHs容易进入提取溶剂中,而正己烷的沸点低,可缩短浓缩时间,从而减少待测物的损失;其次,由于正己烷对微波的吸收相对较弱, 可使微波升温减慢,从而减少溶剂的挥发,防止PAHs由于过热或溶剂挥发而损失[18]。当正己烷与丙酮的体积比大于2:1时,PAHs提取效率有所下降,这可能是由于正己烷体积增加,提取溶剂对微波的吸收效率降低,从而降低了萃取效率。因此,本实验最终选择体积比为2:1的正己烷/丙酮作为提取溶剂。此外,还考察了溶剂用量对萃取效率的影响,结果如图2所示,当使用总体积为15 mL的正己烷/丙酮(2:1)时,PAHs萃取效率最高。这可能因为适量的溶剂便可充分提取样品中PAHs,当溶剂用量继续增加时,浓缩时间也相应增加,从而可导致待测组分的挥发损失。固本文最后采用总体积为15 mL的正己烷/丙酮(v/v2:1)作为提取溶剂。

图1 溶剂及比例对PAHs萃取效率的影响

图2 正己烷/丙酮(v/v 2:1)的用量对PAHs萃取效率的影响
2.1.2 微波辐射功率及时间
为考察微波功率及萃取时间对PAHs萃取效率的影响,分别选用微波功率(100~900 W)和萃取时间(2~10 min)进行实验。结果表明,当微波功率达到300 W以后,提取效率不再升高反而有所降低,可能因为随着微波功率的增加,微波加热速率较快,溶剂易挥发并带走待测组分,导致其萃取效率降低;当萃取时间为2 min时,PAHs萃取效率偏低,2 min以后逐渐升高,6 min以后提取效率不再发生明显变化。因此,采用微波功率300 W, 萃取加热时间6 min进行后续实验。此外,还分别考察了微波萃取压力及磁力搅拌对PAHs萃取效率的影响,结果表明:当萃取压力为0.3 MPa,使用磁力搅拌时,PAHs的萃取效率最高。主要因为磁力搅拌和适当的加压可增大萃取溶剂和样品的有效接触比表面积,进而提高PAHs的萃取效率;同时,采用磁力搅拌,还可缩短萃取时间,减少PAHs因萃取时间过长而带来的损失。因此,采用磁力搅拌附件,压力0.3 MPa进行下一步实验。
2.2 微波萃取法与超声萃取及加速溶剂提取法的结果对照
分别采用微波萃取、超声萃取及加速溶剂萃取来考察PAHs的萃取效率。微波萃取选用最佳优化条件,超声萃取和加速溶剂的萃取温度、萃取时间及萃取剂用量的最佳实验条件参照文献[13, 16],其他实验条件保持一致,测定结果见表2。由表可知,微波萃取法的PAHs平均回收率及相对标准偏差(RSD)均比超声萃取法略好,与加速溶剂提取法结果相当,其萃取效率甚至优于文献报道的索氏提取法[7]。对于低环PAHs,虽然微波萃取法及加速溶剂提取法的萃取效率都较低,但也明显优于超声萃取法的结果,这可能是由于低环PAHs易挥发,超声萃取法密闭性较微波萃取法差,从而导致低环PAHs在提取过程中更易损失;且与超声波萃取和加速溶剂提取法相比,微波萃取具有更加智能、快速、有机溶剂使用量少、稳定性好等优势。

表2 微波萃取法与超声波萃取法及加速溶剂提取法的结果比较
2.3 方法线性范围及检出限
将混合标准溶液稀释配制成质量浓度分别为0.025,0.05,0.1,0.5,1.0,5.0 μg/mL的混合标准系列,依次进样分析。其荧光和紫外检测器的色谱图分别见图3、图4。然后以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,得出16种PAHs在0.025~5 μg/mL范围内均具有良好的线性,其线性相关系数均≥0.999 8。连续进样10次接近于试剂空白的混合标准溶液 , 以3倍标准偏差为仪器检出限,然后以采样体积144 m3,采集效率90%,进样体积10 μL,计算方法检出限,得到16种PAHs的方法检出限为0.005~0.051 ng/m3。
2.4 方法精密度及准确度

图3 PAHs标准溶液荧光检测色谱图
在标准线性范围内,在平行空白玻璃纤维滤膜上分别加入低(0.025 μg/mL)、中(0.5 μg/mL)、高(5 μg/mL)3个水平混合标准溶液各11份,滤膜平衡后按照1.5进行预处理后测定其浓度,分别计算16种PAHs的加标回收率,得到方法加标回收率在78.8%~101.6%之间,相对标准偏差在0.4%~5.8%之间。
2.5 实际样品测定
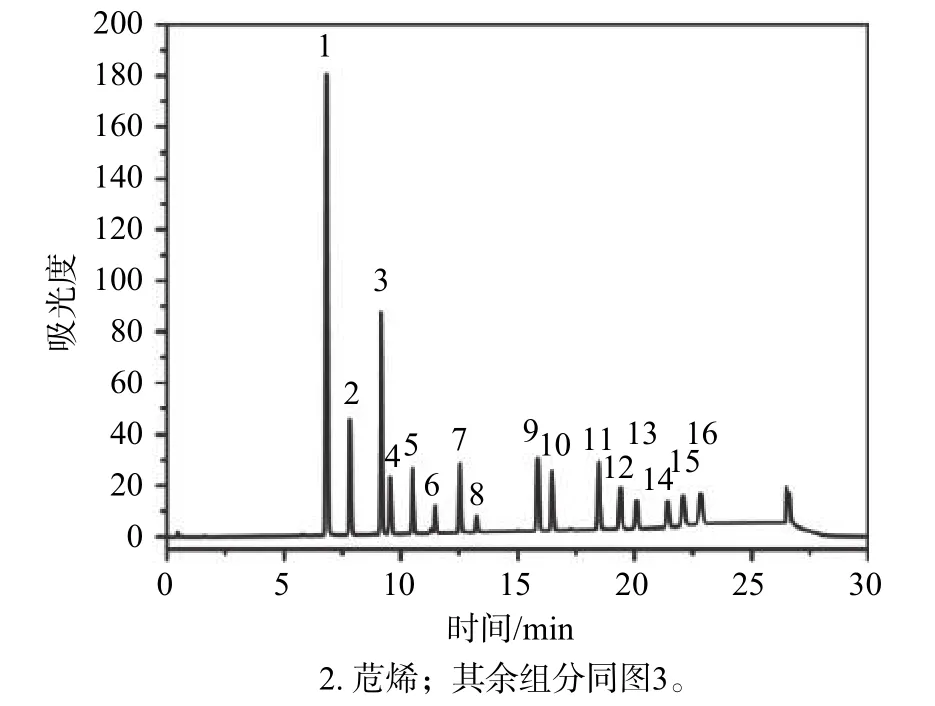
图4 PAHs标准溶液紫外检测色谱图
在最优实验条件下分析2016年2月和3月成都市3个采样点大气颗粒物样品中的PAHs ,结果见表3。由表可知,成都市2016年2月至3月,各采样点PM2.5中PAHs的总浓度范围为17.70~53.34 ng/m3,且3月各采样点PAHs的总浓度均高于2月;各采样点的高环PAHs均有检出,少部分低环化合物苊烯、苊、芴未检出;各采样点中2环、3环PAHs的含量都较低。这些分布特征及规律与其他南方城市基本一致。并且,我国空气质量标准中仅苯并[a]芘给定限值为2.5 ng/m3,而其他优控PAHs 均无标准限值,国外也未制定有环境空气16种PAHs的限量要求。由此得出,2016年2月至3月,成都市的空气在一定范围内受到了PAHs的污染,且3月污染相对较严重。而引起这些污染的可能原因有:石油加工产品和煤不完全燃烧所释放出的烟尘与水汽及工业生产排放的废气等。

表3 各采样点PM2.5中16种PAHs的平均含量及总浓度ng/m3
3 结束语
本文建立了磁力搅拌辅助微波萃取-高效液相色谱法同时测定大气PM2.5中的16种PAHs。该方法具有分离效果好,操作简便、快速,选择性好,准确度及灵敏高等优点。与传统索氏提取、超声提取和加速溶剂提取法相比,微波辅助萃取对PAHs提取效率高,避免了有机溶剂的大量使用,样品处理过程中待测组分损失较少,且该法更加稳定、智能、省时,能够满足大批量样品的准确分析。将其应用于实际样品的测定,可为PM2.5中PAHs的污染分布和源解析提供相应的数据支持。
[1]PANTHER B C, HOOPER M A, TAPPER N J. A comparison of air particulate matter and associated polycyclicaromatic hydrocarbons in some tropical and temperate urban environments[J]. Atmos Environ, 1999, 33(24–25):4087–4099.
[2]王平利, 戴春雷, 张成江. 城市大气中颗粒物的研究现状及健康效应[J]. 中国环境监测, 2005, 21(1): 83–87.
[3]张德云, 孙成均, 王涛. 高效液相色谱法测定室内空气中13种多环芳烃[J]. 华西医科大学学报, 2002, 33(1): 140–143.
[4]何燕, 王淑惠, 解彦平, 等. 高效液相色谱法测定空气中的16种多环芳烃[J]. 现代预防医学, 2015, 42(8): 1475–1500.
[5]赵红帅, 刘保献, 常淼, 等. 控温超声提取–气相色谱–三重四级杆质谱测定大气细颗粒物(PM2.5)中的多环芳烃[J]. 分析化学, 2014, 42(5): 729–734.
[6]刘斐, 段凤魁, 李海蓉, 等. 固相微萃取–气相色谱串联质谱法检测北京大气细颗粒物中的多环芳烃[J]. 分析化学,2015, 43(4): 540–546.
[7]GOGOU A I, APOSTOLAKI M, STEPHANOU E G.Determination of organic molecular markers in marine aerosols and sediments: one–step flash chromatography compound class fractionation and capillary gas chromatographic analysis[J]. J Chromatogr A, 1998, 799(1–2):215–231.
[8]高少鹏, 刘大锰, 安祥华, 等. 高效液相色谱法测定某钢铁厂地区大气颗粒物PM2.5中16种多环芳烃[J]. 环境科学,2006, 27(6): 1052–1055.
[9]KOZIEL J A, ODZIEMKOWSKI M, PAWLISZYN J.Sampling and analysis of airborne particulate matter and aerosols using in–needle trap and SPME fiber devices[J]. Anal Chem, 2001, 73(1): 47–54.
[10]KOLAR K, CIGANEK M, MALECHA J. Air/polymer distribution coefficients for polycyclic aromatic hydrocarbons by solid–phase microextraction sampling[J]. J Chromatogr A,2004, 1029(1–2): 263–266.
[11]SHIMMO M, ANTTILA P, HARTONEN K. Identification of organic compounds in atmospheric aerosol particles by on–line supercritical fluid extraction–liquid chromatography–gas chromatography–mass spectrometry[J]. J Chromatogr A, 2004, 1022(1–2): 151–159.
[12]刘兴国, 张艳海, 刘晓达, 等. 高效液相色谱法同时测定雾霾中的16种多环芳烃[J]. 环境化学, 2015, 34(7): 1383–1385.
[13]江阳, 刘滔, 汪文家, 等. 加速溶剂萃取–高效液相色谱法同时测定大气颗粒物PM2.5中16种多环芳烃[J]. 中国测试,2015, 41(6): 43–51.
[14]袁小雪, 江阳, 杨长晓, 等. 快速溶剂提取–高效液相色谱法测定PM2.5中16种多环芳烃[J]. 分析化学, 2017, 45(11):1641–1647.
[15]HAYAKAWA K, MURAHASHI T, AKUTSU K, et al.Comparison of polycyclic aromatic hydrocarbons and nitropolycyclic aromatic hydrocarbons in airborne particulates collected in downtown and suburban Kanazawa, Japan[J].Atmos Environ, 2002, 36(35): 5535–5541.
[16]常君瑞, 李娜, 徐春雨, 等. 超声提取–高效液相色谱法测定PM2.5中的多环芳烃[J]. 实用预防医学, 2016, 23(3):267–269.
[17]BUDZINSKI H, LETELLIER M, GARRIGUES P, et al.Optimisation of the microwave–assisted extraction in open cell of polycyclic aromatic hydrocarbons from soils and sediments–study of moisture effect[J]. J Chromatogr A, 1999,837(1–2): 187–200.
[18]周娜, 骆和东, 李呐, 等. 食品中苯并(α)芘的微波辅助萃取方法的研究. 光谱学与光谱分析, 2014, 34(3): 787–790.
