RNAi沉默CAPN1基因对Aβ 25-35诱导的原代神经细胞的神经毒性及凋亡的影响
2018-07-04杨保平唐震宇
杨保平, 罗 拯, 邹 可, 唐震宇
阿尔茨海默病(Alzheimer disease,AD)是一种渐进性不可逆的以神经变性为特征的疾病,其主要病变包括大量的β-淀粉样蛋白沉积(β-amyloid protein,Aβ)形成的神经炎性斑块、由微管相关蛋白tau蛋白异常过度磷酸化聚集而引起的神经纤维缠结和选择性的神经元凋亡,β淀粉样蛋白(Aβ)沉积及其神经毒性级联反应被认为在阿尔茨海默病的发病过程中起到至关重要的起始及枢纽作用[1]。在诸多的发病假说中,不溶解的Aβ对神经元有毒性作用,是构成老年斑的核心成分,在导致细胞凋亡的同时,激活胶质细胞诱发生炎症级联反应,升高胞内Ca2+浓度,使神经细胞钙稳态失调[2]。关于阿尔茨海默病发病的分子机制目前还不完全清楚,钙调失常在该病的发病过程中起了一定作用。有研究表明钙蛋白酶的过度激活与AD的发病有关[3]。钙蛋白酶(calpain)是钙依赖性中性蛋白酶,和caspase同属半胱氨酸蛋白酶超家族的成员,calpain广泛分布于哺乳动物神经系统中的胞质、质膜和其他细胞器膜中,正常情况下以无活性的酶原形式存在[4]。该酶不仅参与细胞内正常的信号转录,而且参与许多病理过程,包括颅脑损伤、脑缺血等神经元退变[5]。AD病变中,calpain的表达处于失衡状态[6],而最近的研究表明钙蛋白酶在AD神经元凋亡的过程中发挥重要的作用[7,8]。
本实验中利用Aβ 25-35诱导原代胎鼠皮质神经元毒性损伤,旨在探讨CAPN1 RNAi对Aβ 25-35诱导的原代神经细胞的神经毒性及凋亡的影响,为阿尔茨海默病的治疗提供了新的靶点。
1 资料与方法
1.1 材料和试剂 CCK8试剂盒,generay Trizol RNA提取试剂,takara反转录试剂盒,全式金qPCR试剂盒,罗氏AnnexinV/PI凋亡检测试剂盒,Thermo蛋白提取试剂,CAPN1、CDK5、GSK3β、tau、PHT-tau及β-actin一抗和二抗,慢病毒介导μ-calpain 基因(吉马)。
1.2 CAPN1 shRNA 重组慢病毒/腺病毒载体构建(neuro-2a-CAPN1 shRNA)筛选 μ-calpain基因有效干扰片段的筛选、质粒载体构建、慢病毒及腺病毒包装由吉马基因公司完成。
1.3 原代皮质神经元细胞培养 原代皮质神经元细胞来源于C57BL/6野生型胎鼠,细胞计数后接种到预先用0.1 g/L的多聚赖氨酸包被的24孔板(5×104个细胞/孔),置于含5%CO2的37 ℃恒温培养箱,神经干细胞B-27培养基培养,含2 mmol/L-谷氨酰胺、105U/L青霉素和100 mg/L链霉素。每3 d半量换液一次至原代培养7 d后进行后续试验。
1.4 Aβ药物干预方法 用PBS溶解Aβ25-35浓度为10 μmol,置于-80 ℃冻存,使用前置于37 ℃老化7 d。实验分组:(1)原代胎鼠皮质神经元+PBS;(2)原代胎鼠皮质神经元+Aβ25-35;(3)原代胎鼠皮质神经元+CAPN1 shRNA慢病毒+Aβ25-35;(4)原代胎鼠皮质神经元+CAPN1 shRNA慢病毒+Aβ25-35+P25;取对数生长期的细胞制成单细胞悬液,调整细胞浓度105个/ml,接种至6孔板内,置5%CO2,37 ℃培养箱内培养,细胞达80%汇合给予Aβ25-35等处理,培养72 h后收集细胞或细胞培养液进行各项实验。
1.5 CCK-8法观察各组细胞活力的变化 按CCK-8试剂盒说明书进行操作,用胰酶消化对数生长的原代胎鼠神经元细胞,去消化液,加入含胎牛血清的细胞培养液3 ml,将细胞吹打成悬液,1500 r/m 2 min离心,弃上清,用完全培养液重悬,浓度为1×105μmol/ml,接种于96孔板中,于5%CO237 ℃培养箱中培养。细胞生长至70%融合度时用CAPN1shRNA或阴性对照转染48 h,随后相应加Aβ25-35、p25处理72 h。用PBS洗涤细胞并用含有CCK8的新鲜DMEM代替,然后将细胞在5%CO2于37 ℃温育4 h。去培养基后,将DMSO加入各孔中,在酶标仪上测定450 nm处的吸光度值(OD值),重复5次。
1.6 细胞凋亡检测 取对数生长的原代胎鼠神经元细胞消化,离心后用完全培养液重悬,浓度为1×105μmol/ml,接种于6孔板中,实验分组处理如前所述。各组细胞经处理培养结束后,按照罗氏试剂盒说明书步骤进行Annexin V和PI的双染,然后用流式细胞仪检测凋亡。经胰蛋白酶消化、吹打使其成单细胞悬液,移入离心管中,于1000 r/min离心5 min,弃上清,PBS漂洗一次后,重复离心洗涤一次。将细胞重悬于500 μl binding buffer中,再分别加入5 μl的AnnexinV溶液和5 μl PI染液,轻轻涡旋样品并在25 ℃在黑暗中温育15 min。在1 h内转至流式检测管,流式细胞检测仪读数,实验重复3次。
1.7 实时荧光定量PCR检测μ-calpain的表达变化 RNA提取试剂盒提取细胞总RNA,用蛋白核酸分析仪测定RNA的纯度及定量,1%琼脂糖凝胶电泳鉴定RNA完整性。RNA反转录成cDNA,反转录产物-20 ℃保存或直接进入下一步。TaqMan荧光探针技术行实时荧光定量PCR检测,结果以β-actin作为内参基因,△△Ct法分析基因的相对表达。
1.8 Western blot方法检测细胞内相关蛋白的表达 培养神经元经按实验要求处理后,提取细胞总蛋白,采用BCA法进行蛋白浓度测定分别检测μ-calpain、CDK5、GSK-3β、tau、PHT-tau表达水平的变化。Western blot按常规操作进行:SDS-PAGE电泳分离蛋白质后转膜,用Blocking Buffer封闭,缓慢摇动孵育转印膜2 h。封闭后,用1×TBS洗涤3次,每次5 min。加入稀释好的一抗,4 ℃孵育过夜。用1×TBST洗涤3次,每次10 min。加入稀释好的二抗,室温孵育2 h。用1×TBST洗涤3次,每次10 min。用ECL底物对PVDF膜进行化学发光检测,使用LAS4000 mini化学发光成像仪进行拍照,并使用Quantity One软件进行灰度分析定量。
2 结 果
2.1 CAPN1 RNAi对神经元细胞活力的影响 与NC组相比,在加入Aβ诱导后,NC+Aβ组的细胞活力显著下降(P<0.05),而转染CAPN1 shRNA后,与模型组相比,CAPN1 shRNA+Aβ组细胞活力显著增高(P<0.05)(见图1),表明CAPN1基因对细胞活力有显著影响,在加入P25后,CAPN1 shRNA+Aβ+P25组细胞活力无显著性差异(P>0.05)。
2.2 CAPN1 RNAi对神经元细胞凋亡的影响 与NC组相比,NC+Aβ组的细胞早期凋亡率显著升高(P<0.01),而转染CAPN1 shRNA后,与模型组相比,CAPN1 shRNA+Aβ组早期凋亡率显著降低(P<0.01)(见图2),表明CAPN1基因对神经元细胞凋亡有显著影响。
2.3 CAPN1 RNAi对神经元细胞CAPN1 mRNA表达水平的影响 与NC组相比,CAPN1 shRNA+Aβ组中CAPN1 mRNA的表达显著升高(P<0.01);而转染CAPN1 shRNA后,CAPN1 mRNA的表达得到显著抑制(P<0.01)(见图3),表明CAPN1 shRNA转染成功。
2.4 CAPN1 RNAi对神经元细胞相关蛋白表达水平的影响 Western blot方法检测蛋白表达情况:与NC组相比,NC+Aβ组中μ-calpain、CDK5、p-tau/tau蛋白表达水平显著升高(P<0.01),GSK3β蛋白表达水平升高(P<0.05);而转染CAPN1 shRNA后,与模型组相比,μ-calpain、GSK3β、p-tau/tau蛋白表达水平均显著降低(P<0.01),CDK5蛋白表达水平降低(P<0.05),表明CAPN1基因对神经元细胞CDK5、GSK3β、p-tau/tau的蛋白表达有显著影响,在加入P25后,CAPN1 shRNA+Aβ+P25组,CDK5、GSK3β、p-tau/tau蛋白表达水平均有所上调,μ-calpain蛋白表达未见明显改变(P>0.05)(见图4),表明CAPN1基因对神经元细胞CDK5、GSK3β、p-tau/tau的蛋白表达有显著影响。
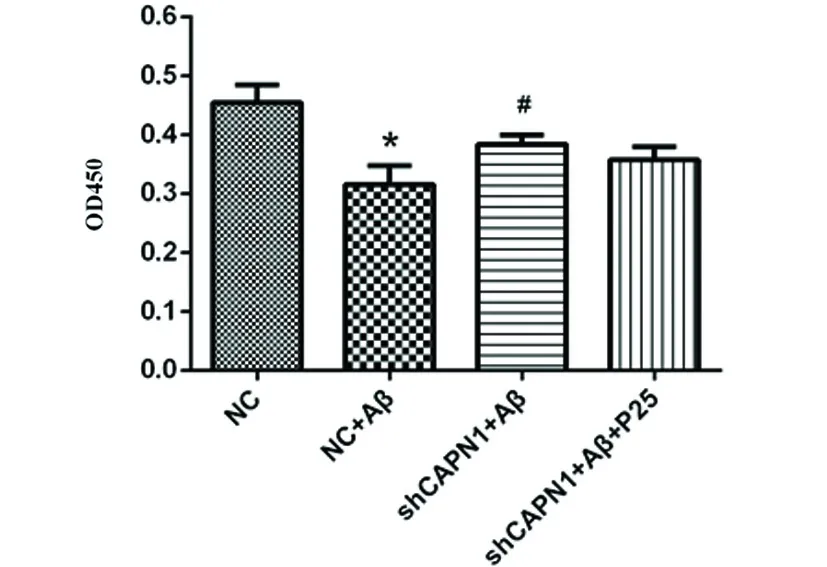
与对照组相比*P<0.05;与模型组相比#P<0.05
图1 CAPN1 RNAi对神经元细胞活力的影响
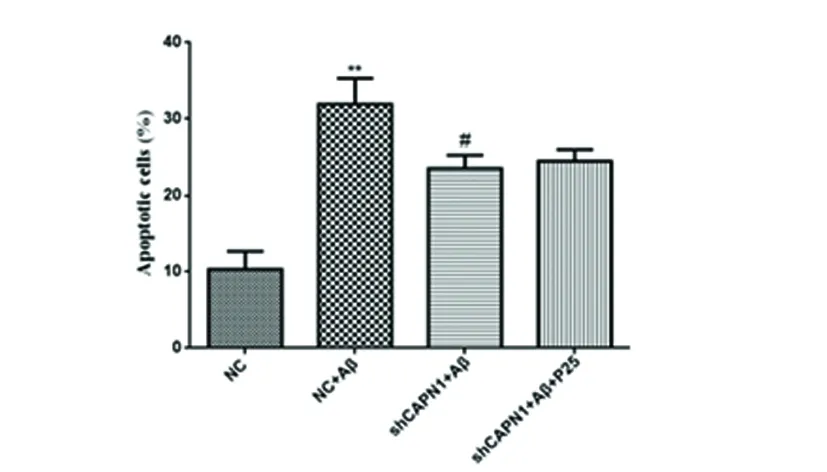

与对照组相比**P<0.01;与模型组相比#P<0.01
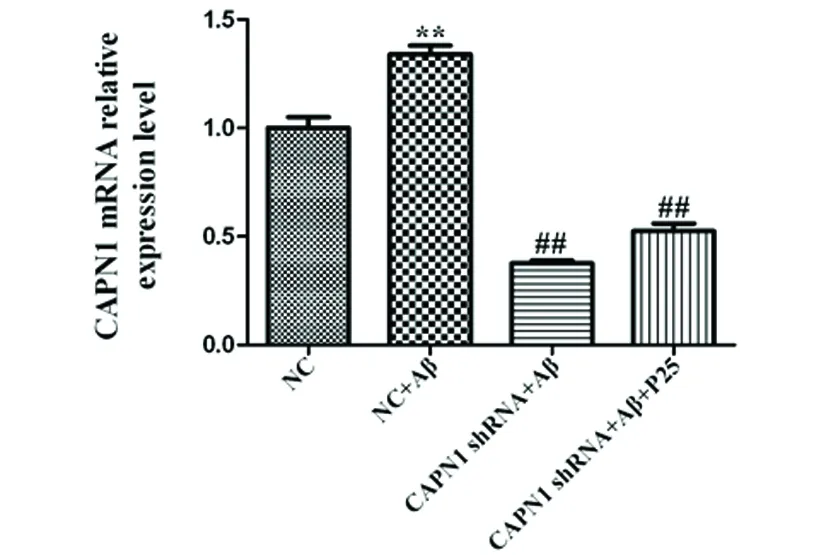
与对照组相比**P<0.01;与模型组相比##P<0.01
图3 RT-PCR检测CAPN1 RNAi对神经元细胞CAPN1 mRNA表达水平的影响

与对照组相比**P<0.01;与模型组相比##P<0.01;与shRNA CAPN1+Aβ组相比*P<0.05
图4 Western blot检测CAPN1 RNAi对神经元细胞相关蛋白表达水平的影响
3 讨 论
阿尔茨海默病是一种以记忆力下降和认知功能障碍为主要表现的神经退行性疾病,以细胞形成大量由β-淀粉样蛋白组成的淀粉样斑块,细胞内神经原纤维缠结及神经元退行性病变。目前多数学者认为AD的病因和发病机制关键的因素是Aβ异常代谢和沉积。Aβ具有神经毒性作用,其聚集沉淀后可引起AD样病变[9],本实验利用Aβ25-35片段诱导AD细胞模型。研究发现AD与细胞凋亡关系密切,认为细胞凋亡是AD中神经元退行性死亡的重要途径[10]。干扰细胞凋亡可能成为治疗AD新的方法。
研究发现,Ca2+浓度在AD患者脑中升高。近年来有许多研究证据表明,由Ca2+浓度失衡引起的Calpain过度激活直接或间接与AD的大脑病变有关[11]。Calpain系统(包括CalpainⅠ和CalpainⅡ)是一个复杂的、高度调控的蛋白降解体系[12]。在体内,Calpain通过Ca2+激活及自溶而表现出蛋白水解酶活性,并通过钙蛋白酶抑制蛋白(Calpastatin)抑制Calpain活性。因为Calpain主要作用对象是细胞骨架蛋白,受体蛋白以及蛋白激酶,Calpain可能通过对这些蛋白进行特异的局部降解而对其结构、功能进行调控,在AD疾病中使神经元细胞分解引起凋亡,进而引起神经退行性病变[13]。本研究中发现转染CAPN1 shRNA后,模型组中CAPN1在mRNA及蛋白水平的表达均显著下降,与已有报道[14]一致,在AD病变中,calpain过度表达在细胞骨架损伤进展和神经退变中发挥着重要的作用。
本实验中还发现,转染CAPN1 shRNA后,神经元细胞的活力明显增加,凋亡情况明显改善,并且CDK5、GSK3β、p-tau蛋白表达水平均显著下调,在加入P25后,CDK5、GSK3β、p-tau的蛋白表达显著升高。已有研究表明,tau蛋白的过度磷酸化可导致微管功能丧失,是AD分子病理的重要环节,过度磷酸化的tau蛋白通过与正常tau蛋白竞争性结合管蛋白,从而阻断微管蛋白的组装,抑制微管聚集,使微管解体及细胞骨架破坏[15]。CDK5是引起tau蛋白磷酸化的重要的蛋白激酶[16]。有多种调节蛋白参与此过程,其中以p35的作用最为重要。在一些损伤因素的作用下,p35可经中性蛋白酶(calpain)作用,降解为p25[17],从而形成p25/CDK5复合体,更大地发挥激活CDK5的作用,进一步对其底物tau蛋白磷酸化,从而引发神经退行性改变[18]。糖原合成酶激酶(GSK)-3β是一种通过磷酸化作用的糖原合成的关键调节酶[19]。GSK-3β是通过磷酸化而失活的蛋白激酶之一,磷酸化后其活性明显降低,GSK-3β被认为参与了有淀粉样前体蛋白(APP)生成Aβ以及tau蛋白磷酸化过程。近来研究结果显示,GSK-3β能使tau蛋白多个位点磷酸化,有研究结果显示:GSK-3β极有可能是AD脑中引起tau蛋白异常磷酸化的最关键的激酶之一[20]。本实验沉默CAPN1基因后,calpain1表达下调,致使GSK-3β表达降低。该结果为阿尔茨海默症的治疗靶点提供了理论基础。
综上所述,本研究证明CAPN1 RNAi可以显著改善Aβ 25-35诱导的原代神经细胞的神经毒性及凋亡,其作用机制可能是通过下调CDK5、GSK3β、p-tau蛋白表达水平来实现的。
[参考文献]
[1]Palop JJ,Mucke L.Amyloid-beta-induced neuronal dysfunction in Alzheimer’s disease:from synapses toward neural networks[J].Nat Neurosci,2010,13(7):812-818.
[2]Workgroup AA.Calcium Hypothesis of Alzheimer’s disease and brain aging:A framework for integrating new evidence into a comprehensive theory of pathogenesis[J].Alzheimers Dement,2017,13(2):178-182.
[3]Shiraha H,Glading A,Chou J,et al.Activation of m-calpain (calpain II) by epidermal growth factor is limited by protein kinase A phosphorylation of m-calpain[J].Mol Cell Biol,2002,22(8):2716-2727.
[4]Ray SK.Currently evaluated calpain and caspase inhibitors for neuroprotection in experimental brain ischemia[J].Curr Med Chem,2006,13(28):3425-3440.
[5]Ono Y,Saido TC,Sorimachi H.Calpain research for drug discovery:challenges and potential[J].Nat Rev Drug Discov,2016,15(12):854-876.
[6]Biesecker KR,Srienc AI,Shimoda AM,et al.Glial cell calcium signaling mediates capillary regulation of blood flow in the retina[J].J Neurosci,2016,36(36):9435-9445.
[7]Karlsson JO,Blennow K,Janson I,et al.Increased proteolytic activity in lymphocytes from patients with early onset Alzheimer’s disease[J].Neurobiol Aging,1995,16(6):901-906.
[8]谢守嫔,罗 佳,李海龙,等.当归含药血清对Aβ-(25-35)诱导PC12细胞凋亡的保护作用研究[J].西部中医药,2015,28(6):13-16.
[9]Kudo W,Lee HP,Zou WQ,et al.Cellular prion protein is essential for oligomeric amyloid-beta-induced neuronal cell death[J].Hum Mol Genet,2012,21(5):1138-1144.
[10]Leissring MA,Akbari Y,Fanger CM,et al.Capacitative calcium entry deficits and elevated luminal calcium content in mutant presenilin-1 knockin mice[J].J Cell Biol,2000,149(4):793-798.
[11]Baudry M,Bi X.Calpain-1 and Calpain-2:The Yin and Yang of synaptic plasticity and neurodegeneration[J].Trends Neurosci,2016,39(4):235-245.
[12]Liu Q,Chen Y,Auger-Messier M,et al.Interaction between NFkappaB and NFAT coordinates cardiac hypertrophy and pathological remodeling[J].Circ Res,2012,110(8):1077-1086.
[13]Hou ST,Jiang SX,Desbois A,et al.Calpain-cleaved collapsin response mediator protein-3 induces neuronal death after glutamate toxicity and cerebral ischemia[J].J Neurosci,2006,26(8):2241-2249.
[14]Yu Y,Run X,Liang Z,et al.Developmental regulation of tau phosphorylation,tau kinases,and tau phosphatases[J].J Neurochem,2009,108(6):1480-1494.
[15]Liu SL,Wang C,Jiang T,et al.The role of cdk5 in Alzheimer’s disease[J].Mol Neurobiol,2016,53(7):4328-4342.
[16]Cruz JC,Tseng HC,Goldman JA,et al.Aberrant Cdk5 activation by p25 triggers pathological events leading to neurodegeneration and neurofibrillary tangles[J].Neuron,2003,40(3):471-483.
[17]Zhou M,Huang T,Collins N,et al.APOE4 induces site-specific tau phosphorylation through calpain-CDK5 signaling pathway in EFAD-Tg mice[J].Curr Alzheimer Res,2016,13(9):1048-1055.
[18]Jiang H,Guo W,Liang X,et al.Both the establishment and the maintenance of neuronal polarity require active mechanisms:critical roles of GSK-3 beta and its upstream regulators[J].Cell,2005,120(1):123-135.
[19]Javitt DC.Glutamate as a therapeutic target in psychiatric disorders[J].Mol Psychiatry,2004,9(11):984-997.
