不同运动强度上调心肌祖细胞标志物表达诱导心脏细胞增殖
2018-07-03周云鹤秦黎黎孙静瑜
周云鹤,费 俭,杨 桦,秦黎黎,孙静瑜,李 青
不同运动强度上调心肌祖细胞标志物表达诱导心脏细胞增殖
周云鹤1,费 俭1,杨 桦1,秦黎黎1,孙静瑜1,李 青2
1. 同济大学, 上海 200092; 2. 复旦大学 脑科学研究院, 上海 200433
目的:探讨不同运动强度对成体小鼠心肌祖细胞标志物Isl1基因表达的影响及诱导心脏细胞增殖的作用。方法:雄性C57BL/6J小鼠随机分为安静对照组(C)、有氧运动组(A)和过度运动组(E),每组6只。A组和E组分别采用小动物跑台方式进行为期4周不同强度的训练。训练结束后采用超声心动图方法对心脏各层结构界面和心功能做定性定量观察与分析,Real-Time PCR法检测心肌Isl1基因和增殖因子PCNA表达,血常规和血清生化检测分析CK和CK-MB等心肌酶谱表达,HE染色观察分析心肌细胞形态结构。结果:运动诱导心肌祖细胞标志物基因Isl1表达上调,且促进细胞增殖因子PCNA的表达上调;有氧运动比过度运动的效果更显著;超声心动图结果显示,有氧运动可以显著改善心功能,提高心系数。结论:运动可有效提高小鼠心脏内源性心肌祖细胞标志物Isl1表达,促进细胞增殖因子PCNA表达增加,改善心脏功能。其中,有氧运动比过度运动对心脏形态和功能改善更显著。探索不同运动强度对心脏细胞再生的影响,将有助于验证或补充成体心肌祖细胞自我更新和分化的生物学机制,为运动医学、运动康复学和预防医学提供有价值的实践依据。
心肌祖细胞;Isl1;超声心动图;运动强度;细胞增殖
成体心肌组织的更新和分化研究成为近年来关注的热点[14]。心肌细胞增殖可作为心脏损伤后修复再生的基础,对于治疗心肌损伤后心肌细胞损失及再生不足等导致的心功能不全、心律失常和心脏衰竭等严重心脏疾病具有重要意义。
心脏干/祖细胞(cardiac stem cells, CSCs/cardiac progenitor cells, CPCs)疗法是心肌损伤修复的重点治疗策略。其中,非创伤性的促进内源性干细胞再生[11,17]不仅可以提供一种非侵入性的治疗,而且能够规避移植引起的免疫抑制,正越来越受到重视。促进成体心脏心肌干/祖细胞的更新和分化,以及有效动员足量的干/祖细胞归巢,修复受损心肌组织,是目前生物学、临床医学和康复医学共同关注的重要课题。CPCs标记物是心肌祖细胞分类的标志,能够作为祖细胞因子受体,通过改变微环境对细胞迁移、定植和分化等起到调节作用。至今研究者已发现多种类型不同标记的心肌祖细胞,主要包括C-kit、Sca-1、Nkx 2.5、Flk1、GATA4 和Isll等[9,10,12,20]。这些心肌祖细胞具有不同的表型特征和分化潜能,但是各类型心肌祖细胞的分化潜能尚未得到充分证实。
在众多心肌干/祖细胞的热点标志物研究中,IsI1已被证明是胚胎心脏组织干细胞的标志物[18],Isl1阳性细胞是胚胎心脏发育中重要的原始祖细胞,利用谱系追踪技术对Isl1阳性细胞分化研究显示,其能够分化为血管内皮、心内膜、平滑肌、右室及左房肌等全部心脏细胞谱系[19,25]。
课题组前期研究发现,有氧运动诱导的心肌肥大是一个平衡的和可逆的生理性增长过程[6],许多因子参与了细胞增殖的调控,Isl1参与心肌肥大与增殖调节。此外,Isl1阳性细胞在胚胎发育期、出生后直到成年都存在[15],是目前心脏中发现的唯一一类能用单一标记进行识别的祖细胞,因此,Isl1阳性细胞是用于研究心脏再生的最佳潜在性内源祖细胞。综上所述,Isl1阳性细胞具有成为运动诱导心肌细胞增殖的内源性心肌祖细胞来源的可能性。但是运动能否诱导Isl1阳性细胞自我更新与分化目前未见报道。
本研究选择心肌祖细胞标志物基因Isl1作为主要研究对象,选用野生型雄性C57BL/6J小鼠,采用小动物跑台的运动方式,不同的运动负荷干预,通过超声心动图、体重、心系数、血液生化检测、细胞增殖因子和转录因子检测以及HE染色等多种方式,研究不同运动强度对小鼠心脏结构和功能的影响,探索有氧运动和超负荷运动对成年小鼠心脏心肌细胞增殖的作用机制,研究结果将有助于验证或补充成体心肌祖细胞自我更新和分化的影响及生物学机制。
1 实验对象与方法
1.1 实验对象及分组
雄性野生型C57BL/6J小鼠由上海斯莱克实验动物有限责任公司提供。运动模型建立及动物饲养在同济大学动物房。笼内铺盖灭菌的木屑垫料,每隔12 h光暗循环,每日小鼠自由进食,标准鼠粮及饮水均经过辐照杀毒或高温高压灭菌处理。动物福利及实验操作严格遵守《实验动物管理条例》进行。动物实验内容和方案获得上海南方模式生物研究中心实验动物看护及使用伦理委员会的批准(SRCMO-IACUC NO. 20140002)。
1.2 实验仪器与试剂
主要仪器:运动干预采用JD-PT小动物实验跑台,超声心动图数据使用Visual Sonics770型小动物超声仪采集,组织切片采用Thermo Shandon全自动组织石蜡包埋机进行切片,用90iNikon光学显微镜进行观察,采用MP Biomedicals Fast Prep-24匀浆系统、Beckman Coulter(Microfuge 22R)冷冻离心机和CFX96 Real-Time System PCR仪进行基因表达测试,使用Sysmex CHEMIX-180全自动生化分析仪进行血生化测试等。
主要试剂:异氟醚、多聚甲醛和戊巴比妥钠购于Sigma公司,苏木素/伊红染液购于珠海贝索生物技术有限公司,6×Loading Buffer(核酸专用)和限制性内切酶购自TaKaRa有限公司,PCR试剂盒购自天根公司,Trizol购自Roche公司;DEPC水购自上海生工,琼脂糖Regular Agarose G-10购自BioWest,蛋白酶K购自Merck Millipore 公司,磷酸盐缓冲液(Phosphate Buffer Solution, PBS)购于碧云天生物技术研究所等。
1.3 实验设计与运动方案
实验干预为28天,运动强度参照Bedford训练模型标准[8]并进行适当修改。将雄性野生型C57BL/6J小鼠随机分成3组:安静对照组(C)、有氧运动组(A)和过度运动组(E),每组6只。C组正常饮食,不干预,笼内自由活动。A组和E组在电动鼠类跑台上进行适应性训练1周,每周5次,每次训练20 min,速度为10 m/min,旨在使其熟悉跑台运动方式。
正式跑台训练4周。有氧运动组:速度15 m/min,坡度0°,60 min/天,每日下午4∶00-5∶00进行训练,每周训练6天,间隔1天,周日休息。超负荷运动组:速度25~35 m/min,逐渐递增,坡度10°~15°逐渐递增,时间90 min/天至120 min/天,逐渐递增。每日下午4∶00-6∶00进行训练,每周训练6天,间隔1天,周日休息。
超负荷运动标准:动物不能坚持本级负荷跑速,先后滞于跑道后1/3处达6次以上,声光电力刺激驱赶无效。
1.4 测试指标与方法
1.4.1 超声心动图检测
超声心动图是应用超声波回声探查心脏和大血管以获取有关信息,将心脏各层结构界面活动情况的空间和时间变化以影像或曲线形式记录下来的一组无创性检查方法。超声心动图可对心脏解剖和心功能做出定性诊断和定量分析。本研究超声心动图检测评价运动小鼠左心室功能具体步骤如下:
1. 运动训练结束后24 h,小鼠异氟醚吸入麻醉。
2. 小鼠麻醉稳定后固定,心前区脱毛,取仰卧位。
3. 超声心动图检测使用Visual Sonics Vevo 770高分辨率小动物超声系统,可对小鼠多脏器的两维超声图像采集,心脏M型超声检测,解剖型心动周期重建,心功能分析检测等。配有气体麻醉系统,使小鼠的麻醉趋于持续性,小鼠的心率保持稳定性,在进行超声过程中使其处于正常的生理状态;数字射频输出模块,能记录心肌运动、血管张力等变化。宽频探头(RMVTM707B),频率30 MHz,聚焦深度1.3 cm,在小鼠胸骨左缘、胸骨右缘、心尖部及胸骨上窝扫查。
采集小鼠心脏的二维、M型超声心动图像和脉冲多普勒检测血流频谱,并进行心脏结构、各瓣口血流及时间参数的测量,测量评价心脏结构和功能的各项参数。
3组小鼠,每组6只,每只小鼠在每个切面上检测2次,每次读取连续5个心动周期数值,取平均值用于统计。
4. 记录左室收缩期末径(Left Ventricular Internal Diameter at end systole,LVIDs)、左室舒张期末径(Left Ventricular Internal Diameter at end diastole,LVIDd),室间隔收缩末期厚度(Interventricular Septal Thickness at systole,IVSs),室间隔舒张末期厚度(Interventricular Septal Thickness at diastole,IVSd),收缩末左室后壁厚度(Left Ventricular Posterior Wall at systole,LVPWs),舒张末左室后壁厚度(Left Ventricular Posterior Wall at diastole,LVPWd)。
由超声心动图程序自动计算左室射血分数(Left Ventricular Ejection Fraction, LVEF)、左室短轴缩短率(Left Ventricular Fractional Shortening,LVFS)。
5. 超声医师操作前未知悉小鼠分组情况,在操作时尽量避免对小鼠胸廓施压,以免影响心率和测量数据。
1.4.2 血清生化检测
本实验血清生化检测指标主要选取心肌酶谱:肌酸激酶(CK)、肌酸激酶同功酶(CK-MB)和天门冬氨酸氨基转移酶(AST)等指标变化进行小鼠运动机能的评定。本实验血清检测样本取材:1.5 ml EP管收集小鼠全血,收集后立刻放入4℃冰箱中。所有样本取好后离心,3 000 rpm×10 min,取上清,用于生化指标检测。
1.4.3 实时定量PCR检测增殖因子和心肌祖细胞标志物表达
提取3组小鼠心脏组织总RNA、反转cDNA、Real time PCR法检测细胞增殖因子和转录因子在心脏组织的表达情况。每组取3只小鼠的心脏组织RNA、反转录成cDNA进行实时定量PCR检测。

表1 Real time PCR法检测的引物序列表
扩增条件为:94℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸20 s,35个循环。PCR产物用2%琼脂糖凝胶电泳检测(120 V,20 min)。
1.4.4 HE染色组织检测
心脏组织样本(3组小鼠,每组3只)4%PFA固定24 h后,转移至组织夹中,流水冲洗5~10 min,以去除残余的多聚甲醛。使用Thermo Shando全自动组织处理机完成组织块的脱水、浸蜡等过程。步骤:1)脱蜡:切片经60℃烘干30 min后,二甲苯脱蜡2次,每次浸泡15 min;2)水化:梯度乙醇处理,依次经100%、100%、95%、75%、50%乙醇、去离子水浸泡,每步5 min;3)苏木素染色:苏木素染液浸泡2 min,流水冲洗至切片颜色稳定;4)分色(可选):如苏木素染色过深,可用1%盐酸酒精进行分色,时间1~2 s,完成后用流水冲洗,直至核返蓝;5)伊红染色:伊红染液浸泡2 min,自来水冲洗5 min至切片颜色稳定;6)脱色:如伊红染色过深,可用95%乙醇适度浸泡脱色,时间1~2 s;7)脱水:梯度乙醇处理,依次经50%、75%、95%、100%、100%乙醇浸泡,每步5 min;8)透明:二甲苯浸泡2次,每次10 min;9)封片:切片自二甲苯取出,待稍微晾干后用中性树胶封片,并于通风橱中吹干2~3 h。
1.5 数据统计
所有数据以均数±标准误(±)表示。数据组间比较采用方差分析(one way or two-way ANOVA,Bonferroni post hoc analysis)和Studengt’s t-test方法。当<0.05时表示差异具有统计学意义。数据统计及绘制图表使用软件Graph Pad Prism 5.0完成。
2 研究结果
2.1 不同运动强度对小鼠心功能的影响
采集小鼠心脏的二维、M型超声心动图像和脉冲多普勒检测血流频谱,测量评价心脏结构和功能的各项参数。3组小鼠的超声心动图片如图1所示:E组小鼠的M型超声心动图显示二尖瓣前叶活动曲线CD段出现一个向上突起的异常波形(即SAM征),致使左室流出道内径变窄,室间隔肥厚,左室内径减小。
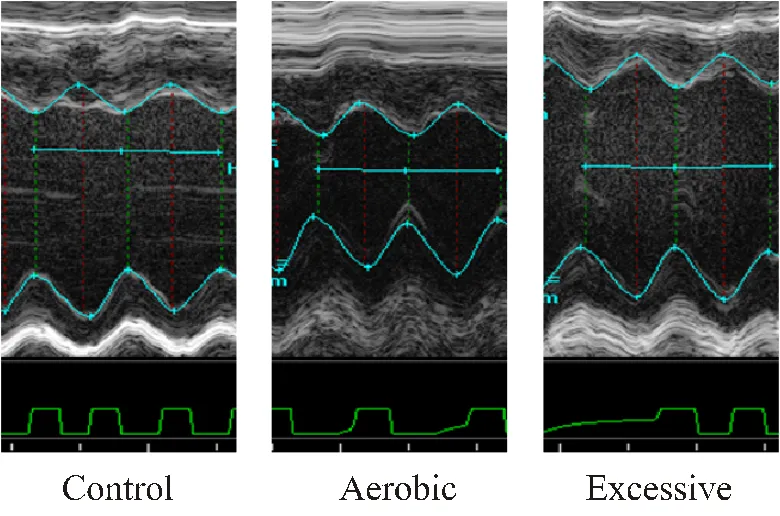
图1 小鼠不同强度运动4周的超声心动图
Figure 1. Echocardiography of Mice at Different Exercise Intensity for 4 Weeks
射血分数(EF)的值(图2A),A组明显升高,与C组相比有显著性差异(=0.002),E组与C组相比没有显著性差异。
左室短轴缩短率(FS)结果(图2B):A组明显升高,与C组相比有显著性差异(=0.002),E组与C组相比没有显著性差异。
收缩末左室后壁厚度(LVPWs)结果:A组明显升高(图2C),与C组相比有非常显著性差异(<0.001),E组与C组相比有显著性差异(=0.026)。
室间隔收缩末厚度(IVSS)结果:A组明显升高(图2D),与C组相比有显著性差异(=0.034),E组与C组相比没有显著性差异。
左室收缩末期内径(LVIDs)结果:A组明显降低(图2E),与C组相比有显著性差异(=0.002),E组与C组相比没有显著性差异。
左室舒张末期内径(LVIDd)结果(图2F):A组明显降低,与C组相比有显著性差异(=0.002),E组与C组相比没有显著性差异。
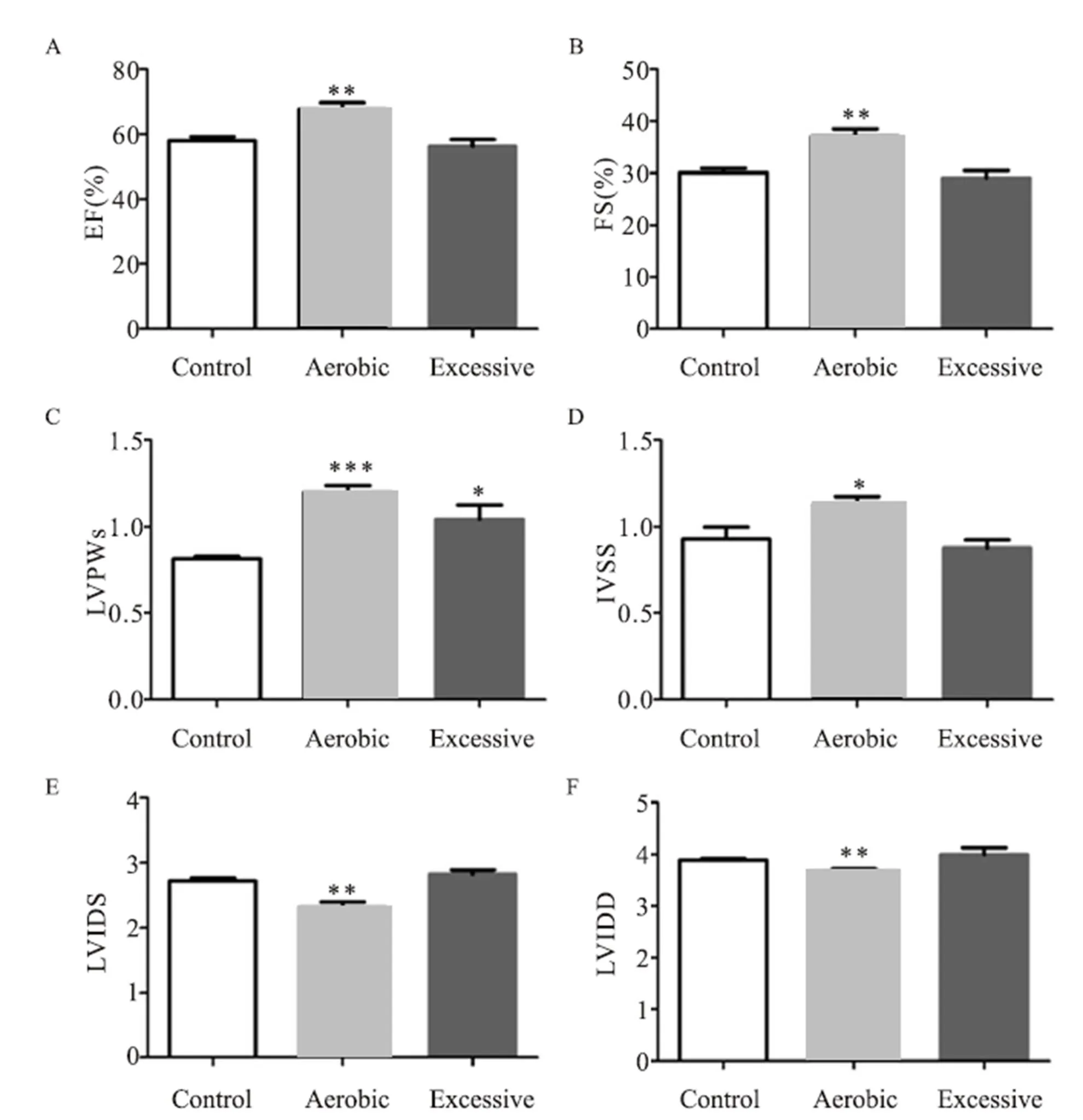
注:A:射血分数(EF),B:左室短轴缩短率(FS),C:收缩末左室后壁厚度(LVPWs),D:室间隔收缩末厚度(IVSS),E:左室收缩末期内径(LVIDs),F左室舒张末期内径(LVIDd)。*表示P<0.05,**表示P<0.01,***表示P<0.001,图3、图4同。
Figure 2. Hyperdata Results of Mice at Different Exercise Intensity for 4 Weeks
2.2 心系数结果
心系数为心脏重量与体重的比值,是反映心肌肥大的重要指标。一般认为,运动性肥大是心脏对运动训练的适应性反应,是一种生理性心脏重塑的过程。本实验结果显示,4周有氧运动后小鼠心脏重量及心系数增加,与C组相比具有显著性差异(表2),表明有氧运动诱导了心脏肥大的形成。而E组小鼠心脏重量及心系数变化不大,与C组相比没有统计学意义上的显著性差异。

表2 运动4周后小鼠体重、心脏重量及心系数变化
注:***表示<0.001。
2.3 心肌酶谱指标结果
运动4周后,小鼠心肌酶谱指标检测结果(图3):肌酸激酶(CK)结果,A组明显降低,与C组相比有显著性差异(=0.014),E组显著升高,与C组相比有显著性差异(=0.035)。肌酸激酶同功酶(CK-MB)结果,A组明显降低,与C组相比有显著性差异(=0.005),E组显著升高,与C组相比有显著性差异(=0.017)。天门冬氨酸氨基转移酶(AST)结果,A组明显降低,与C组相比有显著性差异(=0.016),E组与C组相比没有显著性差异。
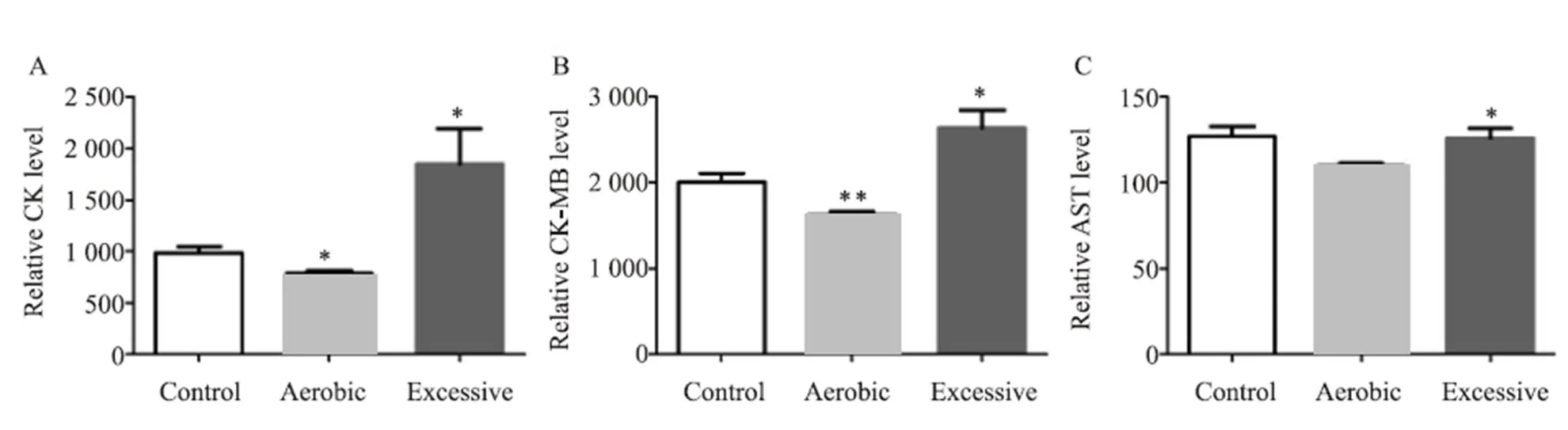
图3 不同强度运动4周小鼠的心肌酶谱结果
Figure 3. CK , CK-MB and AST Results of Mice at Different Exercise Intensity for 4 Weeks
2.4 实时定量PCR检测增殖因子和心肌祖细胞标志物结果
Real-time PCR 法检测增殖因子PCNA和心肌祖细胞标志物Isl1在心脏组织表达情况,增殖因子PCNA结果(图4A):A组明显升高,与C组相比有显著性差异(<0.0001),E组与A组相比升高,有显著性差异(=0.003);心肌祖细胞标志物Isl1结果如图4B所示,Isl1在A组和E组都有增加,其中,A组与C组相比有显著性差异(=0.004),E组与C组相比有显著性差异(=0.035)。
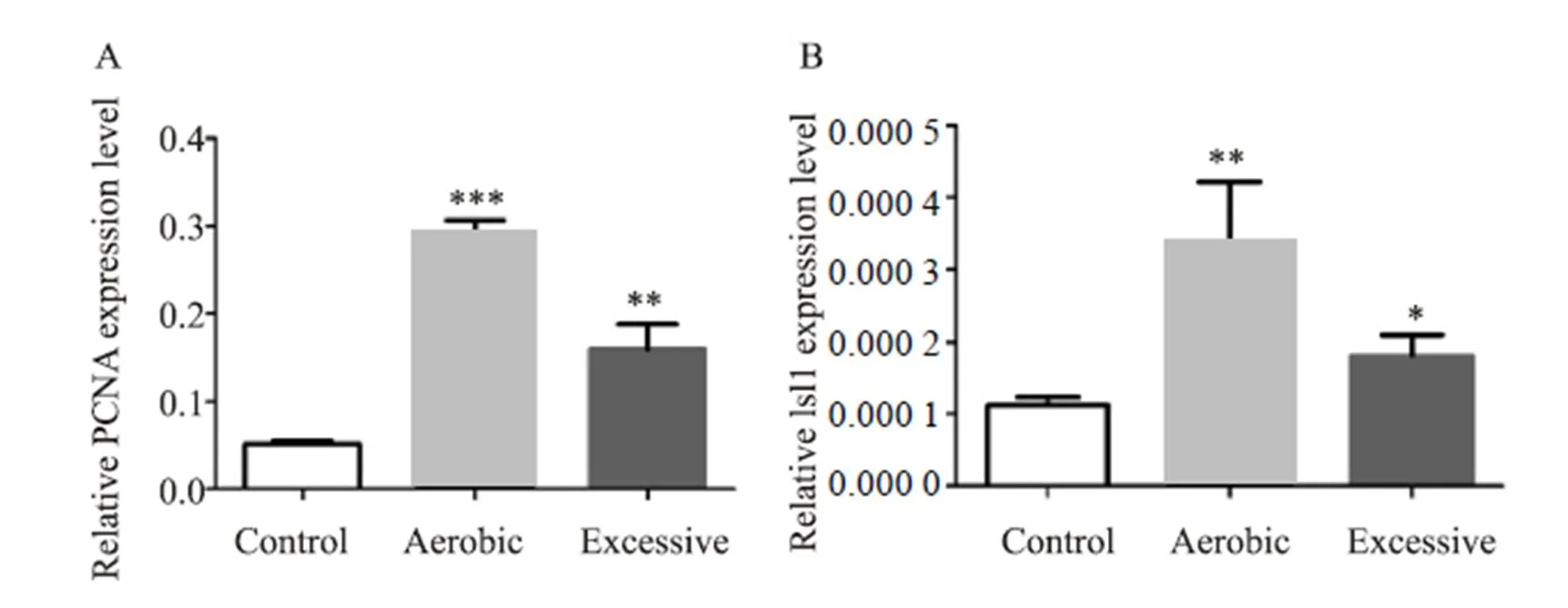
图4 增殖因子和心肌祖细胞标志物的表达结果
Figure 4. Expression of Growth Factor and Myocardial Progenitor Cell Markers
2.5 HE组织染色结果
心肌组织HE染色观察:HE染色显示,C组小鼠心肌纤维结构清晰,着色均匀,细胞核大小均匀,位于心肌纤维的中央,未见肌丝断裂(图5 Control);E组小鼠心肌纤维数量减少,心肌横截面空白区域明显多于C组,可见肌纤维断裂,但未见变性及坏死改变(图5 Excessive);A组小鼠心肌纤维结构清晰,可见肌细胞增粗,细胞境界清楚,心肌横截面空白区域少于超负荷运动组,肌丝断裂较少见(图5 Aerobic),但细胞未见变性和坏死等改变。
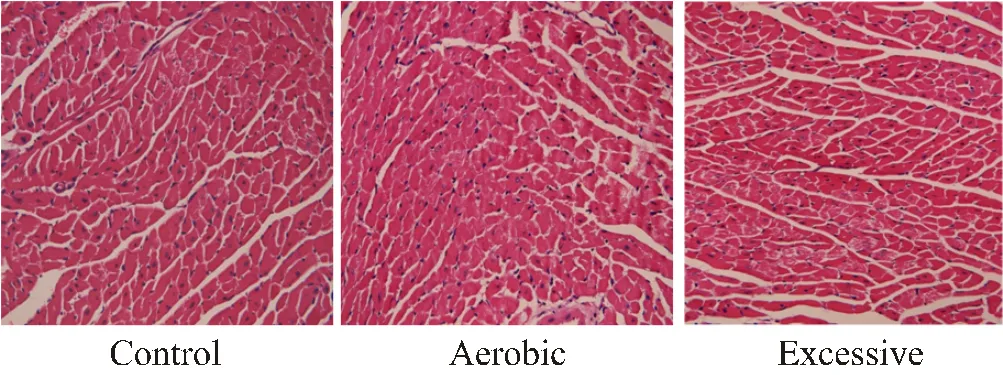
图5 小鼠不同强度运动4周的心脏HE染色结果(X40)
Figure 5. Cardiac HE Staining rResults of Mice at Different Exercise Intensity for 4 Weeks(X40)
3 分析与讨论
LIM同源结构域转录因子1(insulin transcription factor1, Isl1)基因也被称为胰岛素增强子结合蛋白1(islet-1,Isl1),属于LIM同源框基因家族,是1990年瑞典的Karlsson等[16]在研究胰岛素基因表达调控过程中,从大鼠胰岛素瘤细胞系RIN的cDNA文库中首次发现,并被克隆测序。Isl1是一种多效性转录因子,可以作用于不同的下游靶基因,在许多组织和器官的发育进化过程中,如心脏和胰腺的器官形成、运动神经元的分化等[18,21,26],发挥重要的作用,包括影响细胞的增殖、分化和迁移等。
Isl1最近几年被发现在心脏发育过程中起重要作用。研究表明,Isl1基因敲除小鼠心血管发育不全,在E9.5心脏发育停滞,并在E10.5死亡[12,28]。Isl1在特异的心肌前体细胞中表达,并随着心脏的发育表达量逐渐下降。Isl1在早期发育过程中的正常表达,对心肌前体细胞的增殖、迁移和存活是必需的[25]。同时有研究发现,Isl1可以协同多个基因共同调控心脏发育,进而影响整个心脏发育的过程,如Isl1与Gata4及Nkx2.5能够共同协调发挥作用[7,13,29-31]。Isl1和有关基因在心脏发育过程中表达异常会导致各种先天性心脏病的出现[2,24,34]。
Isl1阳性细胞被认为是内源性心肌祖细胞,可以分化生成心脏发育所需约2/3的细胞,即可以分化成心肌细胞系、内皮细胞系和平滑肌细胞系[18],以及所有心血管隔室和传导系统的主要细胞类型[23]。本研究表明,适宜规律的运动能够降低实验动物体重,增加心脏重量,增大心肌细胞直径和细胞体积等形态学指标,提高心系数和左室短轴缩短率等心功能指标,与以往研究报道的运动模型相符[1,3,22]。本研究选用的C57小鼠心脏结构和功能的生长发育变化主要发生在4周龄以前,4周龄以后心脏的生长发育趋于成熟。因此可以表明,适宜的规律性运动有助于成年小鼠心脏功能的提高和心系数的增加,引起运动型心脏肥大。
心肌生理性肥大和病理性肥大的早期形态学非常相似,都表现为室壁增厚和质量增加,解剖学水平上很难区分。细胞水平上,都表现出心肌细胞体积增大、直径增宽和肌节增加。病理性心肌细胞肥大是心脏对抗血流动力学增加、肌损伤和神经激素应激等的共同反应。受损的心脏,肥厚机制被激活,心肌细胞生长,成纤维细胞增殖和细胞外基质沉积,相应的心室壁增厚,左室重量增加,心肌纤维化及心脏舒张功能降低[32,33]。从长远来看,可导致严重的收缩和舒张功能障碍,导致失代偿性充血性或纤维化心脏衰竭。
截止目前,关于运动性心肌肥大机制的研究,主要集中于心肌实质成分与间质成分的形态学、生理学与分子生物学等方面,对心肌细胞的发育生物学和细胞生物学领域的研究报道尚少[27]。关于运动促进心肌干细胞的动员、增殖和分化的报道少见。
本研究结果显示,有氧运动组和超负荷运动组野生型小鼠心脏增殖因子PCNA都增加,具有显著性差异(<0.000 1和=0.003),表明不同运动强度对心肌细胞周期产生影响,引起的心肌肥大伴随着增殖的发生。
心肌祖细胞标志物Isl1的表达,与对照组相比,有氧运动组和超负荷运动组野生型小鼠心脏Isl1表达量都升高,具有显著性差异(=0.004和=0.035),表明不同运动强度促进了小鼠心肌祖细胞标志物表达的提高。
本研究结果显示,运动能够促进野生型小鼠心肌祖细胞标志物Isl1的提高,增强细胞增殖因子PCNA的表达,但是运动是否促进了Isl1+细胞的增殖,或者运动促进细胞增殖的细胞来源是否为Isl1+细胞?目前尚不能明确,后续需要进行谱系示踪研究来确定适宜的运动促进心脏细胞增殖的来源。
本研究体现了发育生物学、心脏医学和运动人体科学等多学科交叉融合的科学发展思想,研究结果将有助于验证或补充成体心肌祖细胞自我更新和分化的影响及机制。
4 结论
运动诱导成体野生型小鼠心脏Isl1基因表达上调,且促进心脏细胞增殖因子PCNA的表达上调,有氧运动比超负荷运动的效果更显著。超声心动图结果显示,有氧运动可以显著改善心功能,提高心系数。
[1] 常芸,杨红霞.不同力竭运动对心脏传导系统HIF-1α的影响[J].中国运动医学杂志,2014,(6): 535-541.
[2] 李彦明,鲁华菲,李涛,等.心肌分化过程中经典Wnt信号促进Isl1表达[J].中国生物化学与分子生物学报,2015,(8): 827-835.
[3] 田振军,蔡梦昕,邢维新.有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨[J].体育科学,2012,32(3): 60-66.
[4] 周云鹤.有氧运动诱导心肌肥大和心肌细胞增殖的研究进展[J].中国细胞生物学学报,2013,(10): 1551-1558.
[5] ARCECI R J,KING A A,SIMON M C,.Mouse GATA-4: A retinoic acid-inducible GATA-binding transcription factor expressed in endodermally derived tissues and heart[J]. Mol Cell Biol,1993,13(4): 2235-2246.
[6] BEDFORD T G,LOI P K,CRANDALL C C.A model of dynamic exercise: The decerebrate rat locomotor preparation[J]. J Appl Physiol (1985),1992,72(1): 121-127.
[7] BELTRAMI A P, BARLUCCHI L, TORELLA D,Adult cardiac stem cells are multipotent and support myocardial regeneration[J]. Cell,2003, 114(6): 763-776.
[8] BU L,JIANG X,MARTIN-PUIG S,.Human ISL1 heart progenitors generate diverse multipotent cardiovascular cell lineages[J]. Nature,2009, 460(7251): 113-117.
[9] BUTANY J,LEONG S W,CARMICHAEL K,et al. A 30-year analysis of cardiac neoplasms at autopsy[J]. Can J Cardiol. 2005, 21(8): 675-680.
[10] CAI C L, LIANG X, SHI Y, et al. Isl1 identifies a cardiac progenitor population that proliferates prior to differentiation and contributes a majority of cells to the heart[J]. Dev Cell. 2003, 5(6): 877-889.
[11] DODOU E, VERZI M P, ANDERSON J P, et al. Mef2c is a direct transcriptional target of ISL1 and GATA factors in the anterior heart field during mouse embryonic development[J]. Developm-ent. 2004, 131(16): 3931-3942.
[12] ELLISON G M, VICINANZA C, SMITH A J,. Adult c-kit(pos) cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair[J]. Cell,2013,154(4): 827-842.
[13] GENEAD R,DANIELSSON C,ANDERSSON A B,. Islet-1 cells are cardiac progenitors present during the entire lifespan: From the embryonic stage to adulthood[J]. Stem Cells Dev,2010, 19(10): 1601-1615.
[14] KARLSSON O,THOR S,NORBERG T,. Insulin gene enha-ncer binding protein Isl-1 is a member of a novel class of proteins containing both a homeo- and a Cys-His domain[J].Nature,1990, 344(6269): 879-882.
[15] LERMAN D A, ALOTTI N, UME K L,. Cardiac Repair and Regeneration: The Value of Cell Therapies[J]. Eur Cardiol,2016,11(1): 43-48.
[16] MORETTI A, CARON L, NAKANO A,. Multipotent embryonic isl1+ progenitor cells lead to cardiac, smooth muscle, and endothelial cell diversification[J].Cell,2006,127(6): 1151-1165.
[17] MORETTI A,LAM J,EVANS S M,. Biology of Isl1+ cardiac progenitor cells in development and disease[J]. Cell Mol Life Sci,2007, 64(6): 674-682.
[18] PARMACEK M S, EPSTEIN J A. Pursuing cardiac progenitors: regeneration redux[J]. Cell,2005, 120(3): 295-298.
[19] PFAFF S L, MENDELSOHN M, STEWART C L,. Require-ment for LIM homeobox gene Isl1 in motor neuron generation reveals a motor neuron-dependent step in interneuron differentia-tion[J]. Cell,1996, 84(2): 309-320.
[20] SA J C, COSTA E C, DA S E,. Aerobic exercise improves cardiac autonomic modulation in women with polycystic ovary syndrome[J]. Int J Cardiol,2016,202: 356-361.
[21] SNARR B S, O'NEAL J L, CHINTALAPUDI M R,. Isl1 expression at the venous pole identifies a novel role for the second heart field in cardiac development[J]. Circ Res,2007,101(10): 971-974.
[22] STEVENS K N, HAKONARSON H, KIM C E,. Common variation in ISL1 confers genetic susceptibility for human congen-ital heart disease[J].PLoS One,2010, 5(5): e10855.
[23] SUN Y, LIANG X, NAJAFI N,. Islet 1 is expressed in distinct cardiovascular lineages, including pacemaker and coron-ary vascular cells[J]. Dev Biol,2007,304(1): 286-296.
[24] THALER J P,LEE S K,JURATA L W,. LIM factor Lhx3 contributes to the specification of motor neuron and interneuron identity through cell-type-specific protein-protein interactions[J]. Cell,2002,110(2): 237-249.
[25] WEHMAN B,SHARMA S,PIETRIS N,. Mesenchymal stem cells preserve neonatal right ventricular function in a porcine model of pressure overload[J].Am J Physiol Heart Circ Physiol,2016, 310(11): H1816-H1826.
[26] ZHUANG S,ZHANG Q,ZHUANG T,. Expression of Isl1 during mouse development[J]. Gene Expr Patterns,2013,13(8): 407-412.
[27] COLOMBO S,de SENA-TOMAS C,GEORGE V,. Nkx genes establish second heart field cardiomyocyte progenitors at the arterial pole and pattern the venous pole through Isl1 repression[J]. Development,2018,145(UNSP dev1614973).
[28] DORN T,GOEDEL A,LAM J T,. Direct Nkx2-5 Transcriptional Repression of Isl1 Controls Cardiomyocyte Subtype Identity[J]. Stem Cells,2015,33(4): 1113-1129.
[29] GOEDEL A,DORN T,LAM J T,. Direct Nkx2-5 Transcript-ional Repression of Isl1 Controls Cardiomyocyte Subtype Identity[J].Circulation,2014,1302.
[30] SANTINI M P,FORTE E,HARVEY R P,. Developmental origin and lineage plasticity of endogenous cardiac stem cells[J].Development,2016,143(8): 1242-1258.
[31] WANG L, MEIER E M, TIAN S,. Transplantation of Isl1(+) cardiac progenitor cells in small intestinal submucosa improves infarcted heart function[J]. Stem Cell Res Ther,2017, 8(230).
[32] YUAN X, QI H, LI X, et al. Disruption of spatiotemporal hypoxic signaling causes congenital heart disease in mice[J]. J Clinical Investigation,2017, 127(6): 2235-2248.
Different Exercise Intensity Up-regulate Marker of Cardiac Progenitor Cells and Induce Cell Proliferation in Adult Heart
ZHOU Yun-he1, FEI Jian1, YANG Hua1, QIN Li-li1, SUN Jing-yu1, Li Qing2
1. Tongji University, Shanghai 200092, China; 2. Fudan University, Shanghai 200433, China.
Objectives: The aim of this study is to dissect the function of marker of cardiac progenitor cells (Isl1) in cardiac cell proliferation in adult mammals under different exercise Intensity.Methods:2-month old adult male C57BL/6J mice were randomly divided into 3 groups(n=6): control(C), aerobic training(A) and excessive exercise (E).Mice in A and E were underwent 4-week’s training program using small animal treadmill with gradually increasing intensity.Heart function was evaluated by small animal echocardiography. Marker of Cardiac Progenitor Cells (Isl1) and Proliferating cell nuclear antigen (PCNA) were observed and analyzed by Real Time PCR. Myocardium was observed hematoxylin-eosin staining. Myocardial enzymes were measured by blood biochemical tests.Results: Exercise resulted in the up-regulation of gene expression both for Marker of Cardiac Progenitor Cells (Isl1) and cell proliferation factor (PCNA). Different exercise intensity could increase the expression of cardiac progenitor cell marker. The effect of aerobic training was more significant than overload exercise. The results of echocardiography show that aerobic exercise can significantly improve cardiac function and heart coefficient. Conclusions: Exercise can effectively stimulate the mouse heart, increase the expression of endogenous marker of cardiac progenitor cells(Isl1), promote the expression of Proliferating cell nuclear antigen (PCNA), and improve heart function. The effect of aerobic training was more significant than excessive exercise for the heart shape and function improvement. Exploring the effects of different exercise intensity on cardiac cell regeneration will help to validate or supplement the influences and mechanisms of cell proliferation and differentiation of adult cardiac progenitor cells, and provide valuable practical basis for sports medicine, sports rehabilitation and preventive medicine.
G804.5
A
1000-677X(2018)06-0053-07
10.16469/j.css.201806006
2018-01-08;
2018-06-10
国家自然科学基金资助项目(31401019)。
周云鹤,女,博士,讲师,主要研究方向为运动与干细胞,E-mail:maggie211@tongji.edu.cn; 费俭,男,教授,博士研究生导师,主要研究方向为组织干细胞与模式生物,E-mail:Jfei@tongji.edu.cn。
