地西他滨对肥胖小鼠胰岛素抵抗的作用及机制研究
2018-06-29高杰清母义明
高杰清,薛 静,程 愈,张 琪,母义明,王 莹
0 引言
胰岛素抵抗作为多种代谢性疾病的共同病理生理基础,已经被证实是一种低度慢性炎症[1-2]。巨噬细胞在该炎症的发生发展中发挥着重要作用,表现为巨噬细胞数量明显增加,且由原来的M2型(抑炎型)为主转变为M1型(促炎型)巨噬细胞为主[3-5]。随后研究发现,促进M1巨噬细胞向M2型转变,增加 M2型巨噬细胞的比例可以显著改善胰岛素抵抗[6-8]。地西他滨是一种表观调控药物,早期大剂量应用于治疗血液系统肿瘤;近年研究发现,小剂量地西他滨具有免疫调节作用[9-10]。在急性肺损伤、急性心肌梗死、动脉粥样硬化模型中发现,表观调控药物可以作用于巨噬细胞,促进M1巨噬细胞向M2极化,抑制过度炎症发生[11-13]。前期研究中,笔者将小剂量地西他滨作用于M1型巨噬细胞,发现其可抑制促炎因子的表达,促使M1型巨噬细胞向M2极化[14]。基于巨噬细胞表型转变在胰岛素抵抗中的重要性,以及地西他滨对巨噬细胞极化的影响,本研究首次将地西他滨作用于高脂喂养的胰岛素抵抗模型,探讨小剂量地西他滨对小鼠胰岛素抵抗的作用及机制。
1 材料与方法
1.1 材料与试剂 8周龄、雄性C57BL/6小鼠,18~20 g,SPF级,购自解放军总医院医学实验动物中心。高脂饲料(D12492,美国);地西他滨(中国西安杨森);胰岛素试剂盒 (Ultrasensitive Rat Insulin ELISA,Mercodia);Trizol RNA 提取试剂(invitrogen,美国);PrimeScript®RT reagent Kit(Thermo,美国)和SYBR®Premix Ex TaqTM(TOYOBO,日本);PCR引物由美国invitrogen合成;Q-PCR 仪器(Bio-Rad,美国)。
1.2 实验方法
1.2.1 胰岛素抵抗模型的构建及分组 8周龄、雄性C57BL/6小鼠普通饲料适应喂养1周后,采用高脂饲料饲养12周,检测小鼠空腹血糖、空腹胰岛素,行IPGTT、IPITT试验,检测胰岛素抵抗模型是否成功。选造模成功小鼠12只,随机分为模型组(HFD组,n=6)、地西他滨组(DAC组,n=6),另选6只同期正常饲料饲养小鼠作为对照组(NC组,n=6)。地西他滨组给予地西他滨0.25 mg/kg腹腔注射,1次/d,连续5 d,其余两组同期给予等量PBS腹腔注射。所有操作均符合实验动物保护法。
1.2.2 指标检测 地西他滨治疗后连续监测小鼠体重,并于治疗2周后,禁食12 h,经腹腔注射葡萄糖(2 g/kg)或胰岛素(1 U/kg),行腹腔注射葡萄糖耐量试验(IPGTT)或胰岛素耐量试验(IPITT),分别于注射前和注射后30、60、90、120 min检测血糖。ELISA检测空腹胰岛素(FINS)水平。稳态模型评估的胰岛素抵抗指数(HOMA-IR)=空腹血糖(FPG,mmol/L)×FINS (mU/L)/22.5。实验结束后,小鼠断颈处死,收集两侧附睾脂肪并称重,一部分附睾脂肪组织冻存于液氮中用于提取RNA,另一部分置于中性甲醛溶液中固定用于制做5 μm厚度的连续石蜡切片。
1.2.3 HE 染色 新鲜脂肪组织浸入4%中性甲醛溶液中固定48 h,梯度乙醇脱水,二甲苯透明,石蜡包埋,5 μm切片后常规HE染色,光镜下观察。
1.2.4 qRT-PCR 检测炎症相关因子及巨噬细胞表面标志物的表达 脂肪组织研磨后,用Trizol法提取总RNA,微量分光光度计(美国Bio-Rad公司)检测RNA样品及纯度。每50 μL体系各取2.5 μg总RNA为模板反转录合成cDNA,反转录条件为42 ℃ 60 min、70 ℃ 5 min,-20 ℃保存。取1 μL cDNA进行实时定量PCR,加入上下游引物各1 μL,SYBER Green mix 12.5 μL,无菌双蒸水补齐至总反应体系20 μL。以β-actin作为内参照,基因表达相对倍数变化用 2-ΔΔCt计算。
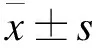
2 结果
2.1 胰岛素抵抗模型建立 开始时两组小鼠体重相当,饲养4周后,高脂喂养组小鼠(HFD组)较对照组(NC)体重增加,但差异无统计学意义;饲养8周后,HFD组小鼠体重增长迅速,与NC组比较差异有统计学意义(P<0.01),且差异越来越大(图1A)。IPGTT、IPITT结果显示,与NC组相比,HFD组小鼠糖耐量明显减低(各时点P均<0.01,见图1B),胰岛素敏感性显著下降(各时点P均<0.01,见图1C),提示胰岛素抵抗模型建立成功。
2.2 地西他滨对肥胖小鼠胰岛素敏感性的影响 地西他滨治疗后小鼠体重无明显变化。与HFD组相比,地西他滨组(DAC组)小鼠葡萄糖调节能力得到明显改善(P<0.01)(图2A),HOMA-IR明显降低(P<0.01)。见图2B。IPITT结果显示,腹腔注射胰岛素30 min时,DAC组和HFD组血糖分别下降到原来的88.0%±3.00%、92.7%±2.52%(P=0.092);60 min时,DAC组和HFD组血糖分别下降到77.67%±2.51%、84.0%±3.00%(P=0.034);90 min时,DAC组血糖下降幅度较HFD组高,达10%(P=0.004);120 min时,DAC组血糖与HFD组差异仍有统计学意义(P=0.015,图2C),提示小鼠胰岛素抵抗得到改善。
2.3 地西他滨对小鼠脂肪组织相关慢性炎症的影响 与HFD组相比,DAC处理后,附睾脂肪重量明显减轻(P=0.045,图3A)。HE染色结果显示,高脂喂养后脂肪细胞明显增大,间质区细胞数量增多;DAC处理后,不仅脂肪细胞减小,间质区细胞数量也明显减少(图3C)。进一步检测脂肪组织炎症因子的表达情况,结果显示,HFD组促炎因子MCP-1、TNF-α、IL-1β的表达明显增加,抑炎因子IL-4、IL-10的表达明显减少(P<0.05);经地西他滨处理后,MCP-1、IL-1β的表达被显著抑制 (P<0.05),TNF-α的表达略有下降的趋势(P=0.12);抑炎因子IL-4、IL-10的表达得到明显改善 (P<0.01,图 3B),提示地西他滨可明显减轻脂肪组织相关的慢性炎症。
2.4 地西他滨对巨噬细胞表型的影响 与NC组比较,HFD组M1型巨噬细胞的表面标志物iNOS、CD11c的表达明显增加(P<0.01);M2 型巨噬细胞表面标志物Arg的表达明显减少(P<0.05)。经DAC处理后,iNOS、CD11c表达分别下降了31.89%、24.07% (P<0.01);CD206、Arg的表达分别上调了144.44%、28.97%(P<0.01,图4),提示地西他滨对脂肪组织中巨噬细胞的表型起到调节作用。
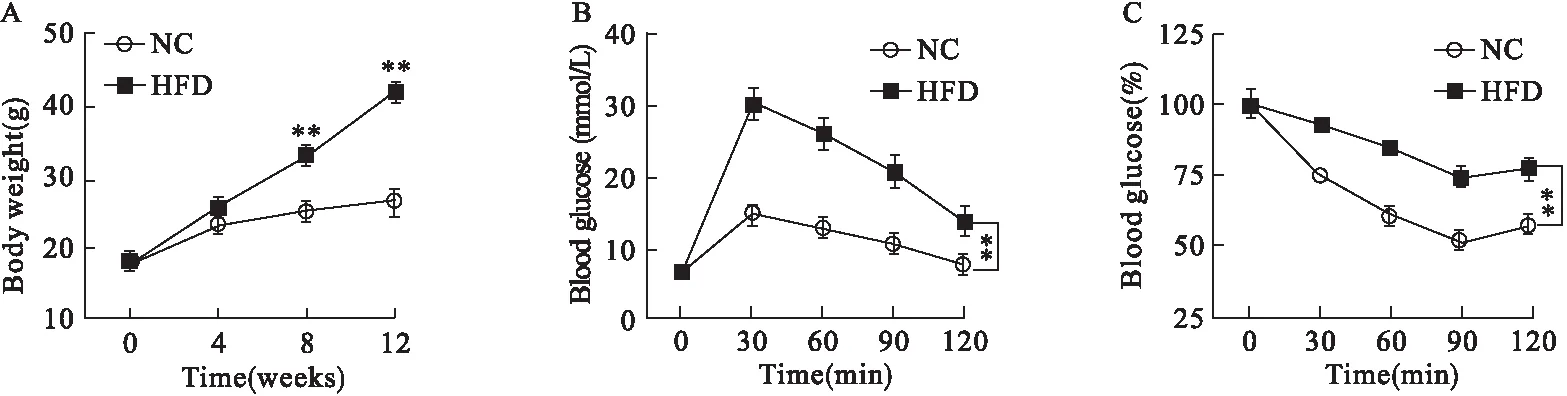
图1 胰岛素抵抗小鼠模型的鉴定
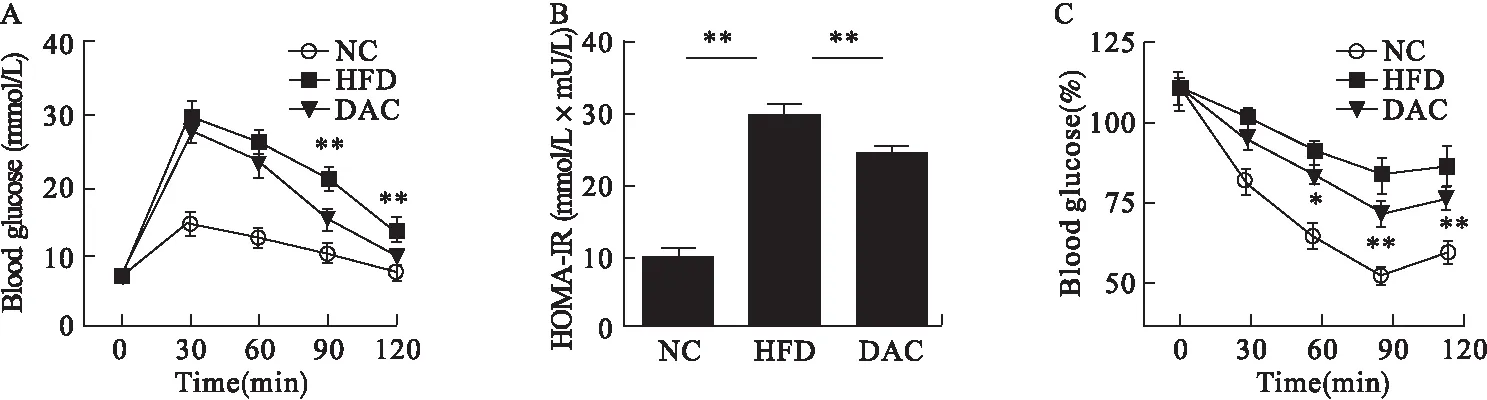
图2 地西他滨对肥胖小鼠胰岛素抵抗的改善作用
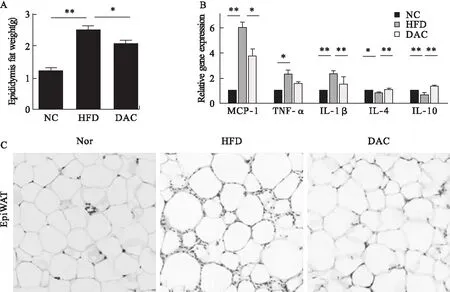
图3 地西他滨对肥胖小鼠附睾脂肪组织及其慢性炎症的影响(HE×50)
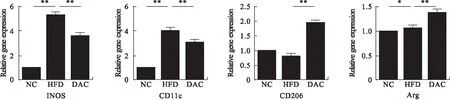
图4 地西他滨对脂肪组织中巨噬细胞表型的影响
3 讨论
胰岛素抵抗是指机体组织对胰岛素的敏感性降低的一种病理状态,由此引起的糖、脂代谢紊乱可导致糖尿病、高血压、动脉粥样硬化、冠心病等多种疾病,危害巨大。然而,目前有效的治疗措施仍然非常有限。越来越多的研究探讨胰岛素抵抗的发病机制,目前认为,肥胖过程中大量巨噬细胞浸润脂肪组织,并在组织中产生一系列炎症因子如TNF-α、IL-1β,导致机体呈现慢性低度炎症状态,进而引起胰岛素抵抗的产生[1-2]。随后的研究发现,随着体重的增加,脂肪组织中巨噬细胞的类型也发生变化,由消瘦时的M2型巨噬细胞为主转变为M1型巨噬细胞为主[15]。另外,促进 M1 型巨噬细胞向 M2 型极化,增加组织中M2 型巨噬细胞数量可以减轻上述炎症反应,显著改善胰岛素抵抗[5-8]。因此,调节巨噬细胞异常极化状态及其相关炎症将成为改善胰岛素抵抗的重要靶点。
地西他滨是一种表观调控药物,早期用于血液系统肿瘤的治疗。2015年《cell》的1篇文献报道,小剂量地西他滨的抑癌作用主要是通过调节免疫反应实现的[10]。Tsai 等[16]的研究发现,地西他滨可以抑制促炎型T细胞的增殖,促进CD4+T细胞向抑炎型的Treg细胞转化,抑制过度炎症发生。地西他滨对DC细胞、NK细胞的研究也时有报道[17-18]。近年来,有研究者将表观调控药物应用于急性肺损伤、急性心肌梗死及动脉粥样硬化的治疗,发现其可以作用于巨噬细胞,促进M1巨噬细胞向M2极化,抑制过度炎症的发生[11-13]。本课题组将小剂量地西他滨直接作用于LPS诱导的M1型骨髓巨噬细胞,发现M1型巨噬细胞的促炎能力明显被抑制,巨噬细胞表型向M2极化[14]。关于地西他滨对巨噬细胞的这种调节作用在体内是否同样存在值得我们进一步探讨。
本研究首次将地西他滨作用于高脂喂养的胰岛素抵抗小鼠模型,治疗2周后,脂肪组织中M1型巨噬细胞的表面标志物明显下调,M2型巨噬细胞表面标志物得到明显上调,与体外实验相一致。同时,DAC治疗组小鼠附睾脂肪含量较HFD组减少,脂肪细胞减小,促炎因子MCP-1、IL-1β的表达被显著抑制,抑炎因子IL-4、IL-10的表达得到明显改善,提示脂肪组织相关慢性炎症减轻。同时,与HFD组相比,DAC组小鼠的糖耐量明显改善、胰岛素敏感性明显提高。该结果提示,地西他滨在体内同样可以调节巨噬细胞表型,进而减轻巨噬细胞相关慢性炎症,改善胰岛素抵抗。
综上所述,地西他滨不仅可以在体外促进M1型巨噬细胞向M2极化,抑制M1型巨噬细胞的促炎能力,而且在胰岛素抵抗模型中同样可以减少肥胖小鼠脂肪组织中M1型巨噬细胞数量,增加M2型巨噬细胞的数量,减轻脂肪组织相关的慢性炎症,改善胰岛素抵抗。这些特点在一定程度上为探索新型改善胰岛素抵抗的药物提供基础。但是,本研究没有揭示地西他滨调控巨噬细胞极化、改善胰岛素抵抗的具体机制。因此,下一步研究将聚焦地西他滨调节巨噬细胞极化的信号通路,这可能为胰岛素抵抗的治疗提供新的靶点。
参考文献:
[1] Ferrante AW.Macrophages,fat,and the emergence of immunometabolism[J] .J Clin Invest,2013,123(12):4992-4993.
[2] McNelis JC,Olefsky JM.Macrophages,immunity,and metabolic disease[J] .Immunity,2014,41(1):36-48.
[3] Lumeng CN,DelProposto JB,Westcott DJ,et al.Phenotypic switching of adipose tissue macrophages with obesity is generated by spatiotemporal differences in macrophage subtypes[J] .Diabetes,2008,57(12):3239-3246.
[4] Chawla A,Nguyen KD,Goh YP.Macrophage-mediated inflammation in metabolic disease[J] .Nat Rev Immunol,2011,11(11):738-749.
[6] Murray PJ,Wynn TA.Protective and pathogenic functions of macrophage subsets[J] .Nat Rev Immunol,2011,11(11):723-737.
[7] Ji Y,Sun S,Xu A,et al.Activation of natural killer T cells promotes M2 Macrophage polarization in adipose tissue and improves systemic glucose tolerance via interleukin-4 (IL-4)/STAT6 protein signaling axis in obesity[J] .J Biol Chem,2012,287(17):13561-13571.
[8] Xie Z,Hao H,Tong C,et al.Human umbilical cord-derived mesenchymal stem cells elicit macrophages into an anti-inflammatory phenotype to alleviate insulin resistance in type 2 diabetic rats[J] .Stem Cells,2016,34(3):627-639.
[9] Sánchez-Abarca LI,Gutierrez-Cosio S,Santamaría C,et al.Immunomodulatory effect of 5-azacytidine (5-azaC):potential role in the transplantation setting[J] .Blood,2010,115(1):107-121.
[10] Chiappinelli KB,Strissel PL,Desrichard A,et al.Inhibiting DNA methylation causes an interferon response in cancer via dsRNA including endogenous retroviruses[J] .Cell,2015,162(5):974-986.
[11] Thangavel J,Samanta S,Rajasingh S,et al.Epigenetic modifiers reduce inflammation and modulate macrophage phenotype during endotoxemia-induced acute lung injury[J] .J Cell Sci,2015,128(16):3094-3105.
[12] Kim YS,Kang WS,Kwon JS,et al.Protective role of 5-azacytidine on myocardial infarction is associated with modulation of macrophage phenotype and inhibition of fibrosis[J] .J Cell Mol Med,2014,18(6):1018-1027.
[13] Cao Q,Wang X,Jia L,et al.Inhibiting DNA Methylation by 5-Aza-2'-deoxycytidine ameliorates atherosclerosis through suppressing macrophage inflammation[J] .Endocrinology,2014,155(12):4925-4938.
[14] 高杰清,张琪,尹雅琪,等.低剂量地西他滨对巨噬细胞极化的调节作用[J] .解放军医学院学报,2017,38(8):793-797.
[15] Shu CJ,Benoist C,Marhis D.The immune system′s involvement in obesity-driven type 2 diabetes[J] .Semin Immunol,2012,24(6):436-442.
[16] Tsai HC,Li H,Van Neste L,et al.Transient low doses of DNA-demethylating agents exert durable antitumor effects on hematological and epithelial tumor cells[J] .Cancer Cell,2012,21(3):430-446.
[17] Kopp LM,Ray A,Denman CJ,et al.Decitabine has a biphasic effect on natural killer cell viability,phenotype,and function under proliferative conditions[J] .Mol Immunol,2013,54(3-4):296-301.
[18] Zhang X,Ulm A,Somineni HK,et al.DNA methylation dynamics during ex vivo differentiation and maturation of human dendritic cells[J] .Epigenetics Chromatin,2014,7:21.
