大鼠心肌缺血再灌注损伤模型的改进与评判
2018-06-26张卫强王涛张志明雍文兴刘永琦李娟梁艳
张卫强,王涛,张志明,雍文兴,刘永琦,李娟,梁艳
(1. 甘肃中医药大学,兰州 730000; 2. 甘肃中医药大学附属医院,兰州 730000)
急性心肌梗死(acute myocardial infarction,AMI)是危害人类健康的重大疾病,是全球的主要死亡原因之一。经马尔科夫模型预测,未来20年间中国将新增2100万例急性冠脉事件,发生700万例心源性死亡[1]。当前以溶栓治疗或急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)为代表的方法,虽能开通闭塞血管,挽救濒死心肌,但在减少急性心肌梗死面积的同时,由于冠状动脉的骤然开通与血流恢复引发心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MI/RI),诱发病死率依然居高不下。因此,模拟人类MI/RI模型并探索新的防治方法成为基础研究迫切需要解决的课题。大鼠一方面在进化关系上比较接近人类,另一方面便于饲养繁殖且造模成本低廉,从而成为制备MI/RI模型的首选。传统制备大鼠心肌缺血再灌注损伤模型方法主要有两种,即:使用人工辅助通气的心脏原位结扎和不使用人工辅助通气的胸腔外结扎[2]。本实验在前人原位结扎法的基础上进行了改进,不但降低了手术难度,而且成功建立了MI/RI模型。
1 材料与方法
1.1 材料
1.1.1实验动物与分组
7~8周龄清洁级成年Wistar大鼠36只,雌雄比为1∶1,体重230~260 g,购自甘肃中医药大学实验动物中心【SCXK(甘)2015-0002】,饲养于甘肃中医药大学实验动物中心屏障环境中【SYXK(甘)2015-0002】。饲养期间给予大鼠标准饲料及洁净饮用水(均由甘肃中医药大学实验动物中心提供)。饲养环境:昼夜各半交替,湿度恒定,温度20~25℃。所有操作均符合实验动物伦理学要求(伦理审批号:IACUC2016-039)。将大鼠随机分为3组:正常组(Normal组);假手术组(Sham组),仅穿线,不结扎左冠状动脉前降支(LAD);缺血再灌注组(MI/RI组),结扎LAD 30 min,再灌注120 min。
肝脏具有调节合成重要蛋白及调节内分泌功能的作用,合成重要蛋白指患者在急性期蛋白合成大多数血浆蛋白,其不仅决定了血浆胶体的渗透压等重要的物质,而且为重要载体的功能,可以和多种的药物结合而影响药物作用[6]。
1.1.2试剂与仪器
小动物呼吸机HX-100E (成都泰盟科技有限公司), Powerlab数据采集分析系统(埃德仪器国际贸易有限公司),结扎材料及各种手术器械,如手术刀、止血钳、持针器、小镊子、眼科剪、缝合针,医用缝合线等。水合氯醛、注射用青霉素钠、无菌生理盐水注射液、碘伏等。
1.2 方法
1.2.1MI/RI模型的建立
根据参考文献[3]的方法进行改进,大鼠术前禁食、不禁水12 h,称重标记。10%的水合氯醛(0.3 mL/100 g) ip麻醉后,仰卧位固定于手术台上,颈部、胸前手术野备皮,碘伏消毒,铺无菌孔巾。连接Powerlab数据采集分析系统,记录标准Ⅱ导联心电图,有异常者剔除。切开颈部气管接人工呼吸机进行辅助呼吸(潮气量5 mL/100 g,频率60~80次/min,呼吸比为2∶1,予呼气末持续正压呼吸)。胸骨左侧0.5 cm处以第3、4肋骨作为上下边界纵行剪开皮肤约3 cm,用镊子及手术刀钝性分离皮下组织、胸大肌直至肋间肌,用弯止血钳将皮肤和肌肉夹起固定于两侧,于心肌搏动明显处纵行剪开3、4肋骨,用撑开器撑开胸腔,用眼科镊夹破心包膜,暴露心脏,在左心耳下缘与肺动脉圆锥间找到左冠状静脉主干,LAD与之伴行,在棉签的协助下挤出心脏,用眼科缝合线在左心耳下缘与肺动脉圆锥间距主动脉根部约2 mm处进针,进针宽度及深度均在2 mm左右,穿线后于左冠状静脉主干上置一自制小塑料管(管中间剪一小孔,方便固定)结扎。结扎成功后肉眼见左心室前壁变青紫或苍白,搏动减弱,心电图呈示ST段抬高(≥0.25 mV)为心肌缺血标志。结扎30 min后用剪刀将结扎线剪断形成再灌注,心电图显示ST段逐渐下降50%左右。造模结束后,按层次依次缝合胸腔、肌肉、皮肤,再次碘伏消毒,术后腹腔注射少量青霉素注射液预防感染。
1.2.2外周血中心梗三项的含量测定
再灌注2 h后右心房取血4 mL,离心,取血清,以全自动生化分析仪检测天门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)的含量。
1.2.3心梗面积测定
抽血完毕后取出心脏,去除非心脏组织,用生理盐水把残血洗净,用滤纸吸去水分后置于-20℃冷冻25 min。然后沿着垂直于心脏长轴将其切成2.0 mm厚的薄片,立即转到预温37℃的1% TTC磷酸盐缓冲液中染15 min,肉眼可观察到:梗死区心肌为白色,非缺血区为红色,然后将切片置于4%多聚甲醛溶液固定24 h,拍照,通过计算机图像分析软件(Image-Pro Plus)计算梗死区面积(IA)占左心室面积(LV)百分比(IA/LV%)。
1.2.4心肌病理组织学检查
每组取3只大鼠开胸切取心脏,生理盐水漂洗,滤纸吸干,取结扎线以下心肌组织置于4%多聚甲醛溶液中进行固定,酒精梯度脱水,石蜡包埋,切片,进行苏木素一伊红(hematoxylin-eosin,HE)染色,光学显微镜下观察心肌组织形态学变化。
1.3 统计学方法
2 结果
2.1 大鼠成活情况
采用LAD上垫一带凹槽塑料管的方法,一方面方便结扎时把握力度和充分固定,另一方面方便再灌注时剪短缝线而不造成撕裂伤,成功地建立了大鼠缺血再灌注模型(如图1)。Sham组、MI/RI组造模成功数分别为11只、11只。各组间大鼠成活率的比较差异无显著性(P> 0.05)。
2.2 大鼠心电图的表现
同Normal组和sham组比较,MI/RI组心电图有明显ST-T动态改变,MI/RI组结扎后ST段显著抬高伴或不伴有T波低平或倒置,再灌注后ST段逐渐回落50%左右伴T波高耸, 这是建立模型成功的标志(如图2-4)。
2.3 心肌酶含量变化(如表1)
2.4 心肌梗死面积
如图所示,TTC染色将心肌非缺血区染成红色,梗死区染成苍白色。用IA/LV评价心肌梗死面积。本实验心肌梗死面积(IA/LV%): Sham组为(0.00±0.00)%;MI/RI组为(26.80±1.60)%。与Sham组比较,MI/RI组差异有显著性(P< 0.05)(如图5)。

图1 大鼠在体心肌缺血再灌注损伤模型的手术方法及结扎后表现Fig.1 Surgical operation to generate the rat model of myocardial ischemia reperfusion injury and the view after ligation
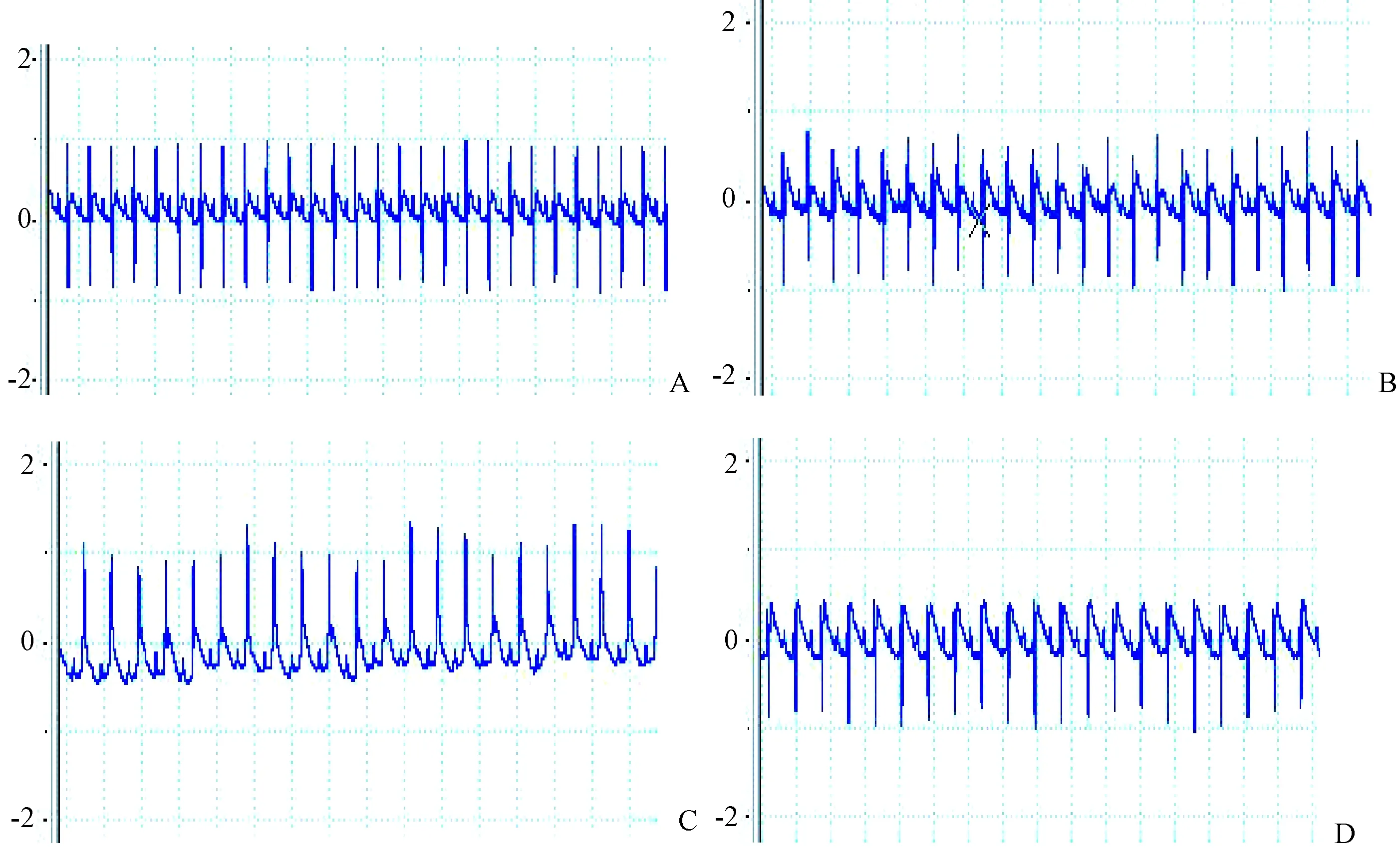
注:A.正常心电图;B.开胸穿线未结扎;C.LAD结扎后;D.再灌注。图2 大鼠心电图表现Note. A. Normal ECG. B. Open chest and putting thread without ligation. C. After ligation of the LAD. D. Reperfusion.Fig.2 ECG changes in the rats

注:A.正常波形;B.开胸穿线后ST段轻度抬高;C.LAD结扎后ST段显著抬高(≥0.25 mV);D.再灌注后ST段回落,T波高耸。图3 大鼠心电图分析Note. A. Normal waveform. B. Slight elevation of ST segment after thoracotomy. C. Significant elevation of ST segment after ligation of the LAD (≥0.25 mV). D. ST segment fall after reperfusion and a higher T wave.Fig.3 ECG analysis of the rats
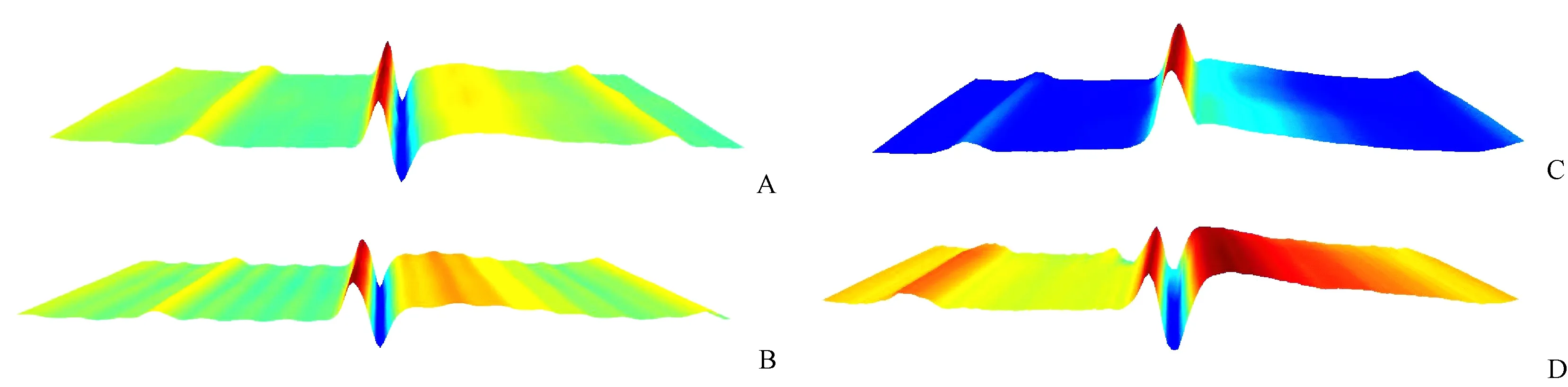
注:A.正常波形;B.开胸穿线后ST段轻度抬高;C.LAD结扎后ST段显著抬高;D.再灌注后ST段回落,高耸T波。图4 大鼠心电图动态演变情况Note. A. Normal waveform. B. Slight elevation of ST segment after thoracotomy. C. Significant elevation of ST segment after ligation of LAD. D. ST segment falls after reperfusion, and a higher T wave.Fig.4 Dynamic evolution of ECG in the rats

组别Groups LDH(U/L)CK-MB(U/L)AST(U/L)正常组Normal group476±262 437±217 91±30 假手术组Sham group2421±1307*1059±595* 749±512*缺血再灌注组MI/RI group3021±1238**1887±449**Δ782±522*
注:与Normal组比较*P< 0.05,**P< 0.01;与Sham组比较ΔP< 0.01。
Note. Compared with the normal group,*P< 0.05,**P< 0.01; Compared with the Sham operation group,ΔP< 0.01.
2.5 心肌病理组织学检查
Sham组:心肌细胞排列整齐,间质无水肿,未见明显心肌结构破坏;MI/RI组:部分肌纤维溶解液化,心外膜下见带状梗死灶,广泛炎性细胞浸润(如图6)。

图5 TTC染色结果Fig.5 Appearance of the rat heart cut surfaces(TTC staining)
3 讨论
急性心肌梗死(acute myocardial infarction,AMI)在欧美发达国家有“头号杀手”之称。在我国随着人民生活水平的提高,AMI的发病率和死亡率逐年上升[1]。当前通过溶栓、介入及搭桥术虽然能够挽救濒死的心肌细胞,改善心功能,但恢复血供后往往出现“再灌注损伤”,诱发病死率居高不下。由此MI/RI成为当前医学研究的热点。目前国内外基础研究中模拟人类MI/RI模型应用最广泛的方法是结扎大鼠左冠状动脉前降支使其供应区血流阻断,造成心肌缺血。心肌因缺血、缺氧而发生代谢紊乱以致发生凝固性坏死。然而在大鼠MI/RI模型制造中所采用人工辅助呼吸的心脏原位结扎法存在诸多问题:如邓宇珺等[4]认为既往利用垫片法实施缺血再灌注实验时,结扎线有可能划破垫片表面陷入垫片,加之实验过程中血液沾染垫片导致松解活结时出现松解障碍而影响再灌注的顺利开始。成玲俐等[5]则认为传统方法在阻断冠状动脉造成缺血后实现再通时, 结扎线不易剪断,常导致左心耳破裂,引起心脏撕脱伤,造成大出血;冠状动脉定位不一,会造成模型缺血损伤部位及损伤程度不一致等。我们在前人造模的基础上,利用大鼠撑开器扩大胸腔术野,然后在肺动脉圆锥与左心耳之间下2 mm处在结扎线下垫一凹槽型塑料软圆管,不但避免了垫片较软且容易沾染血液的弊端,且可以利用凹槽形成的高度有效控制结扎的力度,防止结扎太紧或太松导致模型失败,再灌注时,利用凹槽释放的空间易于剪短结扎线而不造成牵拉,避免了结扎线不易剪断的问题,很好地实现了再灌注。造模成功率达90%以上,较好满足了实验需要。在模型鉴定过程中大鼠的心电图显示LAD在结扎后ST段显著抬高伴或不伴有T波低平或倒置,再灌注后ST段逐渐回落50%左右并伴有T波高耸,符合目前大多数学者主张的缺血再灌注的心电图表现形式,由此说明此改进方法是成功的。另外,心肌酶是衡量大鼠心肌损伤的敏感性指标。心肌细胞坏死时可引起细胞膜完整性破坏和心肌标志酶的外漏,CK-MB具有心肌组织特异性而被认为是诊断心肌坏死的“金标准”之一,再灌注后CK-MB 释放增多与心肌组织微灌注不良有关;LDH 增加的程度可间接反映心肌细胞膜的损伤程度,对MI/RI具有诊断价值[6];AST则主要分布在心肌, 在细胞受损时大量溢出。我们在再灌注后检测了AST、LDH、CK-MB变化,与Normal组和Sham组比较,MI/RI组指标 CK-MB 变化最为显著[(1887±449) vs (437±217) U/L、(1887±449) vs (1059±595)U/L],差异有显著性。与Normal组比较,MI/RI组LDH差异有显著性[(3021±1238) vs (476±262) U/L],由此可见MI/RI组心肌细胞损伤明显。尽管有报道[4]认为Sham组较Normal组心肌损伤标准物无差异,但我们发现,差异是存在的,由于LAD存在于心脏内,穿线及结扎过程必然会对心肌造成机械损伤,造成心肌标志酶的外漏。实验动物心肌梗死面积最常见的检测方法是氯化三苯基四氮唑(TTC) 染色[7]。本实验用TTC染色显示MI/RI组梗死面积明显大于Sham组,说明血流再通可以加剧心肌损伤,另外我们从病理形态学上观察到Sham组心肌细胞排列整齐,未见细胞结构明显破坏;而MI/RI组肌纤维溶解液化,心外膜下可见一条很明显的带状梗死灶,说明血流再通后明显加剧了心肌坏死程度和范围。
近年来,天镇县针对流动党员数量多、流动范围广、流动地点不固定的实际,积极采取举措,将流动党员服务管理落到实处,努力让流动党员回归组织怀抱、实现“流而有家”。
综上所述,改进的造模方法成功提高了造模的成功率,降低了手术难度,准确地复制心肌MI/RI的实验模型,为后续开展MI/RI研究奠定良好的模型基础。
