消癌平注射液对原发性肝癌模型大鼠病理形态和肝癌细胞迁移的影响及其作用机制
2018-06-26温丽娜郭杨志仝永娟
温丽娜,郭杨志,仝永娟,李 莎
(首都医科大学附属北京世纪坛医院,北京 100038)
肝细胞癌 (hepatocellular carcinoma,HCC)是全球最常见的恶性肿瘤之一,在世界范围内癌症相关死亡疾病中位居前三位[1-2]。肝细胞癌的发展过程是一个复杂多步的病理过程,期间可以诱发局部低氧,进而刺激血管生成[3-4]。此外,DNA损伤和炎症反应在肝癌进程中也起重要作用[5-6]。二乙基亚硝胺 (diethylnitrosamine,DEN) 可以与DNA形成烷基加成产物,诱发肝细胞染色体畸变和姐妹染色单体交换从而导致肝癌。由于DEN引起大鼠肝脏代谢的形态学、基因组、基因表达等方面的改变与人体相似,DEN诱导的原发性肝癌大鼠模型成为最为认可的实验模型[7]。以DEN诱发大鼠原发性肝癌,其给药途径包括口服给药、灌胃给药和腹腔注射给药。相对而言腹腔注射诱发大鼠肝癌的周期较短。消癌平注射液是从中药乌骨藤的干燥藤茎中提取的有效成分制剂,具有消炎、抗癌、平喘等功效,临床主要用于原发性肝癌、胃癌、食管癌、肺癌等多种晚期恶性肿瘤以及气管炎、支气管哮喘的治疗。目前,关于消癌平注射液的抗癌机制已有部分研究,如抗血管生成,通过抑制PI3K激酶活性抑制癌细胞增殖侵袭,通过下调MMP-9基因表达抑制卵巢癌细胞迁移,通过降低肝癌大鼠血清IL-17、IL-6、TNF-α水平,提高血清IL-2水平提高免疫功能等[8-11],但是消癌平注射液在低氧环境中的抗癌机制尚未明确。本研究改进DEN刺激剂量及时间,以间断性腹腔注射DEN诱发大鼠肝癌模型,探讨消癌平注射液对此肝癌模型大鼠肝组织损伤的影响。肿瘤发生时常常伴随局部低氧。在低氧环境中,消癌平注射液在体外对肝癌细胞迁移有何作用,其作用机制是否与消癌平注射液调控免疫炎性因子密切相关,本文将进一步深入研究。
1 材料和方法
1.1 细胞及实验动物
SMMC-7721细胞株和HepG2细胞株购自中国医学科学院肿瘤细胞库,保存于本实验室液氮中。SPF级雄性SD大鼠60只,体重130~150 g,5周龄,购自北京维通利华实验动物技术有限公司[SCXK(京)2012-0001]。动物实验已通过首都医科大学附属北京世纪坛医院实验动物伦理与管理委员会审批。大鼠每笼4只,于首都医科大学附属北京世纪坛医院实验动物中心SPF级层流室[SYXK(京)2013-0003]饲养,相对湿度40%~60%,12 h明暗交替进行,自由饮食饮水,定期更换垫料,适应性饲养1周。
1.2 主要试剂及仪器
消癌平注射液(Xiao Aiping injection)购自南京圣和药业有限公司,批号:201312261;二乙基亚硝胺(diethylnirtosamine,DEN)、CoCl2·6H2O购自美国Sigma公司;0.9%生理盐水购自华润双鹤药业股份有限公司;4%多聚甲醛购自北京雷根生物技术有限公司;DMEM培养基、RPMI1640培养基、双抗(青霉素-链霉素混合液)、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶、TRIZOL购自美国Thermo公司;胎牛血清(fetal bovine serum,FBS)购自美国Sciencell公司;引物购自北京三博远志生物技术有限责任公司;cDNA逆转录试剂盒SuperRT cDNA Synthesis Kit及荧光定量UltraSYBR Mixture (Low ROX)购自康为世纪生物科技有限公司;苏木精-伊红染色液购自谷歌生物科技有限公司。BSA224S型电子分析天平购自德国赛多利斯公司;YXQ-LS-50SII型高压蒸汽灭菌器购自上海博迅实业有限公司;BY400C型医用离心机购自北京白洋医疗器械有限公司;SW-CJ-2FD型超净工作台购自苏州净化设备有限公司;3111型二氧化碳培养箱购自美国Thermo公司;Elipse TS100型倒置显微镜购自日本Nikon公司;Elipse E200型正置显微镜购自日本Nikon公司;QuantStudioTM6 Flex荧光定量PCR系统购自美国ABI公司;KD-2258型石蜡切片机、KD-BMII型冷冻包埋机、KD-P型摊片机购自浙江省金华市科迪仪器设备有限公司。
1.3 实验方法
1.3.1肝癌大鼠模型的建立及分组给药
60只SD大鼠随机分为正常对照组12只,模型组48只,模型组以50 mg/kg DEN腹腔注射,每周2次,连续4周,第5周开始改为每周腹腔注射一次,连续10周;正常对照组以生理盐水腹腔注射,每次0.1 mL,每周2次,连续4周,第5周开始改为每周腹腔注射一次,每次0.1 mL,连续10周。从第15周开始,将模型组大鼠随机分为三组,即消癌平注射液低剂量组,消癌平注射液高剂量组,无药物干预的模型组。消癌平注射液低剂量组给予消癌平注射液0.25 mL/100 g腹腔注射,消癌平注射液高剂量组给予消癌平注射液0.5 mL/100 g腹腔注射,正常对照组和模型组给予生理盐水0.5 mL/100 g腹腔注射,每天一次,每周5 d,连续4周。期间注意观察大鼠的饮食情况、皮毛变化及精神状态。
1.3.2标本采集和处理
第19周,处死大鼠,称量体重,取出肝脏,称重,比较正常组、模型组、消癌平注射液干预组大鼠肝脏表面色泽、质地、结节形成情况等指标。取病变组织于4%多聚甲醛溶液中固定,经脱水、透明、透蜡处理后,进行石蜡包埋,制作石蜡切片,厚度5 μm,HE染色后封片,于正置显微镜下观察各组肝脏组织变化或病理损伤情况。
1.3.3细胞划痕愈合实验
复苏SMMC7721细胞和HepG2细胞,接种于六孔板中,分别采用RPMI 1640加10% FBS加1%双抗培养基和高糖DMEM加10% FBS加1%双抗培养基,于37℃、5% CO2培养箱中培养。待密度接近90%时,采用无血清培养基培养24 h,用200 μL枪头垂直板底划痕,PBS洗涤3次,加入含CoCl2·6H2O 100 μmol/L的无血清培养基,同时加入消癌平注射液,使其终浓度分别为0、100 μL/mL,于CO2培养箱中继续培养24 h。分别于消癌平注射液干预0 h和24 h时拍照。采用Image J软件分析划痕愈合面积,依据如下公式计算划痕愈合率:

1.3.4Real-time PCR检测肝癌细胞IL-6 mRNA的表达
将SMMC7721细胞和HepG2细胞分别采用RPMI1640加10%FBS加1%双抗培养基和高糖DMEM加10% FBS加1%双抗培养基培养于六孔板中,待密度接近90%时,加入含CoCl2·6H2O 100 μmol/L的培养基,同时加入消癌平注射液,使其终浓度分别为0、100 μL/mL,于CO2培养箱中继续培养24 h后,弃去培养基,用PBS洗涤3次,加入TRIZOL,提取RNA,采用SuperRT cDNA Synthesis Kit试剂盒逆转录为cDNA,采用UltraSYBR Mixture (Low ROX)荧光定量试剂及QuantStudioTM6 Flex荧光定量PCR系统检测肿瘤细胞被消癌平注射液干预前后IL-6 mRNA的表达。引物序列:IL-6:Forward:5’-AACCTGAA CCTTCCAAAGATGG-3’,Reverse:5-TCTGGCTTGTTCCTCACTACT-3’;GAPDH:Forward:5’-GAAGGTGAAGGTCGGAGTC-3’,Reverse 5’-GAAGATGGTGATGGGA TT TC-3’。
1.4 统计学方法

2 结果
2.1 消癌平注射液对大鼠一般状况的影响
实验期间,正常对照组大鼠未见异常生理表现,无自然死亡,解剖后肝脏表面未见病理改变。模型组大鼠截止第14周DEN干预结束,死亡15只,死亡率31.25%(15/48)。模型组剩余大鼠至第18周结束,未见自然死亡。体重与正常对照组大鼠相比,显著减轻。解剖后,模型组大鼠肝脏颜色紫暗,表面粗糙,可见不同程度的结节。消癌平注射液干预组大鼠体重与模型组相比有所增加,与正常对照组相比明显减少,解剖后肝组织损伤与模型组相比有所减轻,高剂量作用更明显。
2.2 消癌平注射液对肝癌大鼠病理学改变的影响
肝脏大体改变:正常对照组大鼠肝脏色泽明亮,表面红润无斑点,光滑无结节,如图1A所示。模型组大鼠肝脏肿大,表面粗糙,呈现多个暗黄色类圆形结节,大小不一,表明形成明显肝癌病灶,如图1B所示。消癌平注射液低剂量组肝脏仍肿大,色泽暗淡,表面粗糙,呈现大小不一的类圆形淡黄色结节,如图1C所示。消癌平注射液高剂量组肝脏肿胀程度略有减轻,表面粗糙色泽暗淡,散在大小不一的类圆形结节,其大小略小于消癌平注射液低剂量组,如图1D所示。

注:(A)正常对照组;(B)模型组;(C)消癌平注射液低剂量组;(D)消癌平注射液高剂量组。图1 肝脏表面变化情况Note.(A) Blank control group. (B) Model group. (C) Xiao Aiping injection low dose group. (D) Xiao Aiping injection high dose group.Fig.1 Macroscopic changes visible on the rat liver surfaces
肝脏组织学改变:对各组大鼠肝组织进行HE染色,在光镜下观察组织学改变。结果表明正常对照组大鼠肝细胞排列整齐,大小均一,细胞核清晰可见,无炎性细胞浸润,如图2A所示。模型组大鼠肝细胞排列不规则,细胞膜不规则,细胞核异常增大裸露,可见多核性,核深染,密度增加,细胞质呈颗粒状具有空泡,一般具有高核质比(细胞核/细胞质),肝细胞明显发育不良,形成肝细胞癌病理特征,如图2B所示;消癌平注射液低剂量组与模型组相比肝细胞排列仍不规则,细胞核深染及密集程度有所减轻,如图2C所示;消癌平高剂量组与低剂量组相比肝细胞排列略规则,核深染及密集程度进一步减轻,如图2D所示。

注:(A)正常对照组;(B)模型组;(C)消癌平注射液低剂量组;(D)消癌平注射液高剂量组。图2 肝组织病理改变的HE染色图(×100)Note. (A) Control group. (B) Model group. (C) Xiao Aiping injection low dose group. (D) Xiao Aiping injection high dose group.Fig.2 Pathological changes of the rat liver tissues. HE staining
2.3 消癌平注射液对低氧环境下肝癌细胞迁移能力的影响
如图3 A、B所示,在CoCl2·6H2O引起的化学低氧环境下,SMMC-7721细胞正常对照组和消癌平注射液干预组在划痕后0 h无明显差异;划痕后24 h,100 μL/mL消癌平注射液组与正常对照组相比,划痕愈合程度减小,其愈合率分别为(63.20±3.00)% 和 (38.83±2.00)%,P<0.01,t=10.88,表明消癌平注射液能够抑制SMMC-7721细胞的划痕愈合。
如图4A、B所示,同样在CoCl2·6H2O引起的化学低氧环境下,划痕后24 h,HepG2细胞正常对照组划痕明显愈合,100 μL/mL的消癌平注射液干预组的划痕愈合程度明显减小,其划痕愈合率分别为(70.17±3.00)% 和 (12.06±2.00)%,P<0.01,t=29.289,表明消癌平注射液能够显著抑制HepG2细胞的划痕愈合。图3、图4对比可以看出,消癌平注射液对HepG2细胞划痕愈合的抑制作用更显著。

注:(A)干预24 h消癌平注射液对SMMC-7721细胞划痕愈合的影响;(B)干预24 h SMMC-7721细胞划痕愈合的百分比;与正常对照组相比,*P< 0.01。图3 消癌平注射液对SMMC-7721细胞迁移的影响Note. (A) After intervention for 24 h, effect of Xiao Aiping injection on the wound healing ability of SMMC-7721. Cells. (B) After intervention for 24 h, wound healing percentages of the blank control group and Xiao Aiping treatment group of SMMC-7721 cells. Compared with the NC group,*P< 0.01.Fig.3 Effect of Xiao Aiping injection on the migration of SMMC-7721 cells
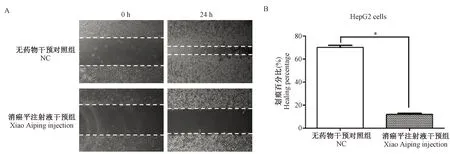
注:(A)干预24 h消癌平注射液对HepG2细胞划痕愈合的影响;(B)干预24 h HepG2细胞划痕愈合的百分比。与正常对照组相比,*P< 0.01。图4 消癌平注射液对HepG2细胞迁移的影响Note.(A) After intervention for 24 h, effect of Xiao Aiping injection on the healing ability of HepG2 cells. (B) After inntervention for 24 h, the healing percentage of blank control group and Xiao Aiping injection group of HepG2 cells. Compared with the NC group,*P< 0.01.Fig.4 Effect of Xiao Aiping injection on the migration of HepG2 cells
2.4 消癌平注射液对低氧环境下肝癌细胞IL-6 mRNA表达的影响
如图5所示,在CoCl2·6H2O模拟的化学低氧环境下,100 μL/mL的消癌平注射液作用24 h后,可以抑制HepG2细胞IL-6 mRNA的表达,与正常对照组相比,差异有显著性(P<0.05)。对于SMMC-7721细胞,消癌平注射液具有抑制其IL-6 mRNA表达的作用趋势,但是与正常对照组相比,差异无显著性(P>0.05)。这与消癌平注射液干预组对HepG2和SMMC-7721细胞划痕愈合抑制作用趋势一致。

注:与正常对照组相比,*P<0.05。图5 消癌平注射液对SMMC-7721和HepG2细胞IL-6 mRNA表达的影响Note. Compared with the NC group,*P<0.05.Fig.5 Effect of Xiao Aiping injection on the expression of IL-6 mRNA of SMMC-7721and HepG2 cells
3 讨论
本研究证实不同剂量的消癌平注射液可以不同程度地减轻间断性腹腔注射DEN的改良诱导方案成功复制的肝癌模型大鼠肝脏的病理损伤。在CoCl2诱发的化学低氧条件下,消癌平注射液能够不同程度地抑制肝癌细胞SMMC-7721和HepG2细胞的迁移,其作用程度与消癌平注射液在低氧条件下抑制SMMC-7721和HepG2细胞IL-6 mRNA表达的作用程度正向相关,但是消癌平注射液抑制SMMC-7721细胞IL-6 mRNA表达的作用与正常对照组相比差异无统计学意义,仅对HepG2细胞IL-6 mRNA表达的抑制作用与正常对照组相比差异有显著性,说明抑制IL-6 mRNA表达可能只是消癌平注射液在低氧环境中抑制肝癌细胞迁移的作用机制之一。
将DEN溶解于饮用水中饲养大鼠或每日灌胃给予DEN诱发大鼠肝癌是最常见的造模方法。但是这两种方法均需每日给予DEN,操作繁琐,致癌周期相对也较长。每周定期腹腔注射DEN诱发肝癌,既可减少操作,又可增加肝细胞损伤恢复期,降低大鼠死亡率[12]。本研究采用前4周每周腹腔注射2次DEN 50 mg/kg体重,后10周每周腹腔注射1次DEN 50 mg/kg体重的改良方案诱发大鼠肝癌,进而研究消癌平注射液对此模型的作用,研究结果与文献报道的消癌平注射液具有减轻灌胃给予DEN诱发的原发性肝癌大鼠肝组织病理损伤作用的研究结果一致[11]。
研究表明消癌平注射液可减轻原发性肝癌模型大鼠肝功能的损伤,提高肿瘤个体的免疫功能[11]。但是在肿瘤微环境中消癌平注射液是否通过调控免疫炎性因子抑制肝癌的侵袭转移尚未明确。低氧作为肿瘤微环境的常见现象,在各类肿瘤的侵袭和转移中发挥着重要的作用。低氧微环境可以显著促进乳腺癌的侵袭和转移已被报道,其作用机制错综复杂[14]。因此,在低氧环境下研究药物对肿瘤细胞迁移能力的影响,更有利于模拟患者体内环境的肿瘤发生发展过程。免疫炎性细胞是肿瘤微环境的重要组成成员之一。IL-6作为免疫炎性细胞释放的重要促炎因子,具有调节细胞增殖、存活和迁移等多种功能。IL-6的高表达已经成为乳腺癌、前列腺癌和头颈癌复发、转移和低存活率的独立预测指标[15-17]。IL-6可以通过多种信号通路促进肿瘤进程[18-20],其表达水平与肝癌化疗药物抵抗密切相关[21]。既往研究表明消癌平注射液可以下调肝癌大鼠血清IL-6水平,本研究证实消癌平注射液可在低氧条件下抑制肝癌细胞的迁移,并抑制HepG2细胞IL-6 mRNA的表达。除IL-6之外,消癌平注射液在复杂的肿瘤微环境中抑制肝癌细胞迁移的作用机制是否还与其它免疫炎性因子相关,还有待于进一步研究。
参考文献:
