BNP和Cys-c检测在致心律失常右室发育不良患者心衰预测及预后评估中的价值
2018-06-26吴献豪刘宝宏
吴献豪,刘宝宏
致心律失常右室发育不良(ARVD)又称致心律失常型右室心肌病,是一种已确认的遗传性心肌病,特征为右心室心肌被进行性纤维脂肪组织所置换,起初为区域性,逐渐呈全心弥漫性受累的心肌病变。研究表明,纤维脂肪化不仅累及右心室,约50%的病例同时累及左心室[1]。ARVD常为家族性发病,临床表现为心律失常、心力衰竭(心衰)、右心扩大和猝死。ARVD是临床常见的可致猝死的器质性心脏病,个体差异较大,可能是致病基因多样性及外显率不同所致[2]。脑钠肽(BNP)是一种主要由心脏分泌的利尿钠肽家族的一员,心功能障碍能够极大激活利钠肽系统,心室负荷增加导致BNP释放,是反映心室功能的敏感和特异性指标,既往研究证实,其对慢性心衰诊断及预后有重要价值[3],肾功能不全是评估心衰患者预后和存活能力的重要指标[4]。血清胱抑素C(Cys-c)是一种与各类心血管疾病的发生、发展密切的肾功能内源性标记物,研究证实,对心衰的预后有重要价值,并优于肌酐[5]。本研究通过观察ARVD患者BNP、Cys-c表达水平与心衰发生的相关性,旨在探讨其对心衰预测及预后评估中的价值。
1 资料与方法
1.1 基本资料选择2013年5月~2016年1月于上海交通大学医学院附属同仁医院收治的ARVD患者81例为研究对象,入选患者均符合《2015年国际专家小组共识:致心律失常性右室心肌病/发育不良的治疗》中的诊断标准[6],其中男性48例,女性33例,年龄40~75岁,平均(57.64±8.24)岁,按NYHA心功能分为:心功能Ⅱ级组(n=24)、心功能Ⅲ级组(n=30)和心功能Ⅳ级组(n=27)。排除标准:①已确诊为心力衰竭者;②合并恶性肿瘤者;③扩张型、肥厚型等原发性心肌病者;④急性冠脉综合征、存在严重血流动力学改变的心律失常者;⑤合并肺栓塞、甲状腺功能异常及慢性肾功能衰竭者,妊娠或哺乳期妇女。患者均符合《2015年国际专家小组共识:致心律失常性右室心肌病/发育不良的治疗》中的诊断标准[6],其中男性48例,女性33例,年龄40~75岁,平均(57.64±8.24)岁,参照美国纽约心脏协会(NYHA)心功能分级分为:心功能Ⅱ级组(n=24)、心功能Ⅲ级组(n=30)和心功能Ⅳ级组(n=27)。选择同期在我院体检的健康人群40例作为对照组,其中男性23例,女性17例,年龄38~70岁,平均(55.97±8.67)岁。所有研究对象均知情同意,并签署知情同意书。两组患者在年龄、性别等一般资料比较,无明显差异,具有可比性。
1.2 方法所有受试者均于入院24 h内采空腹静脉血5 ml,将其分为两份。一份置于ED-TA抗凝管内,采用Access2型化学发光仪(美国贝克曼库尔特有限公司生产)化学发光法测定BNP水平;另一份于室温静置30 min后,经5000 r/min离心后,取上清液,采用日立7600-020全自动生化分析仪,胶乳增强免疫透射比浊法测定Cys-c水平。采用飞利浦Sonos-7500型多普勒彩色超声诊断仪,探头频率2.0~2.5 Hz,测定左室射血分数(LVEF)和左室舒张末期内径(LVEDD)。ARVD患者出院后均随访18个月(每2月门诊复查一次),观察其心力衰竭的发生情况[7]。
1.3 统计学分析本研究采用SPSS 22.0进行数据分析,多组计量资料的比较采用单因素方差分析,采用多因素Logistic回归分析影响患者心衰的因素,应用Kaplan-Meier生存曲线分析计算患者累计生存率,采用Log-ranK检验进行比较,以P<0.05为差异有统计学意义。
2 结果
2.1 各组患者入院时的BNP、Cys-c、LVEF及LVEDD比较入院时不同心功能分级的ARVD患者与对照组比较,BNP、Cys-c、LVEF及LVEDD均有显著差异(P<0.05);随着心功能降低,BNP、Cys-c水平及LVEDD升高,而LVEF呈下降趋势,不同心功能的ARVD患者间差异显著(P<0.05),表1。
表1 各组患者入院时的BNP、Cys-c、LVEF及LVEDD比较(±s)
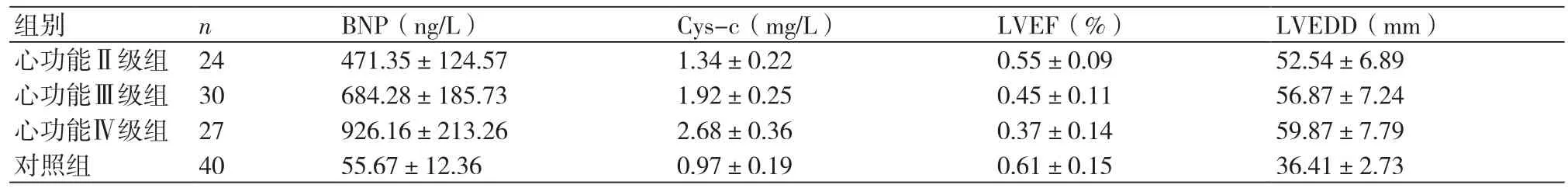
表1 各组患者入院时的BNP、Cys-c、LVEF及LVEDD比较(±s)
注:BNP:脑钠肽;Cys-c:血清胱抑素C;LVEF:左室射血分数;LVEDD:左室舒张末期内径
组别 n BNP(ng/L) Cys-c(mg/L) LVEF(%) LVEDD(mm)心功能Ⅱ级组 24 471.35±124.57 1.34±0.22 0.55±0.09 52.54±6.89心功能Ⅲ级组 30 684.28±185.73 1.92±0.25 0.45±0.11 56.87±7.24心功能Ⅳ级组 27 926.16±213.26 2.68±0.36 0.37±0.14 59.87±7.79对照组 40 55.67±12.36 0.97±0.19 0.61±0.15 36.41±2.73
2.2 影响患者心力衰竭的多因素Logistic回归分析81例ARVD患者随访18个月(随访率100%),共49.38%(40/81)的患者出现心衰,以出现心衰为应变量,把年龄、性别、BNP、Cys-c、LVEF及LVEDD为自变量,进行多因素Logistic回归分析。结果显示,BNP与Cys-c进入模型,BNP与Cys-c是ARVD患者心衰的独立预测因子,表2。
2.3 BNP、Cys C单项及联合预测ARVD患者心衰的效能评价BNP预测ARVD患者心衰的ROC下AUC面积为0.804,95%CI为:0.710~0.897,BNP为731.43 ng/L时,其预测心衰的灵敏度为68.18%,特异度70.27%,阳性预测值73.17%,阴性预测值65.00%;Cys-c预测ARVD患者心衰的ROC下AUC面积为0.852,95%CI为:0.770~0.934,Cys-c为2.14 mg/L时其预测心衰的灵敏度为78.57%,特异度79.49%,阳性预测值80.49%,阴性预测值77.50%;联合预测ARVD患者心衰的ROC下AUC面积为0.905,95%CI为:0.839~0.971,其预测心衰的灵敏度为81.40%,特异度84.21%,阳性预测值85.37%,阴性预测值80.00%(图1,表3)。
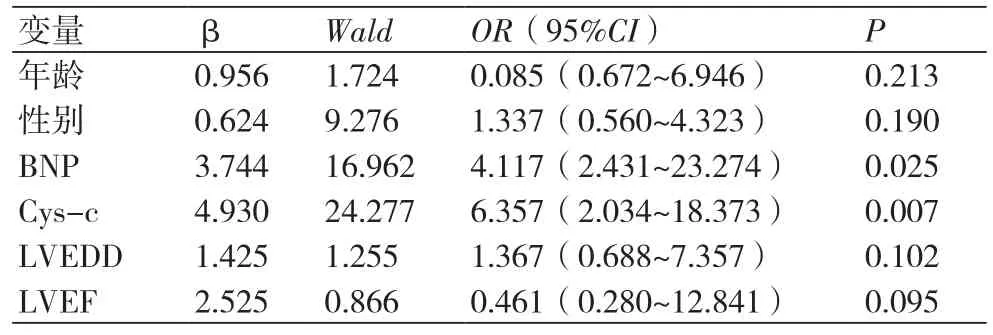
表2 影响患者心力衰竭的多因素Logistic回归分析
2.4 Kaplan-Meier生存曲线分析以BNP值731.43 ng/L作为危险分界值,分为低危组(BNP<731.43 ng/L)和高危组(BNP≥731.43 ng/L),以Cys-c值2.14 mg/L作为危险分界值,分为低危组(Cys-c<2.14 mg/L)和高危组(Cys-c≥2.14mg/L),以出现心衰为终点结局观察各组的生存率。结果显示,BNP高危组的生存曲线明显低于低危组,经Log-ranK检验差异有统计学意义(χ2=36.897,P=0.000),图2;Cys-c高危组的生存曲线明显低于低危组,经Log-ranK检验差异有统计学意义(χ2=36.892,P=0.000),图3。
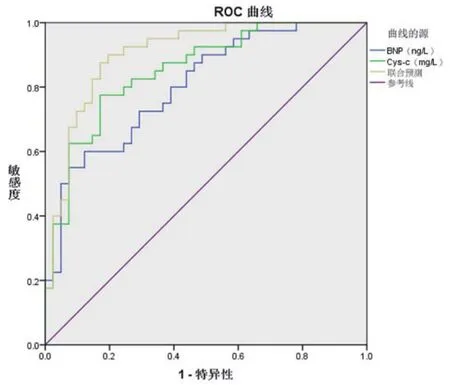
图1 BNP、Cys-c单项及联合预测ARVD患者心衰的ROC曲线
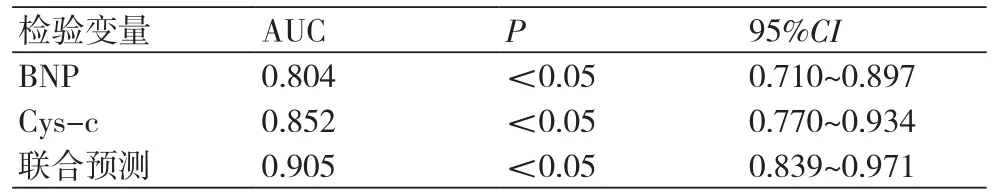
表3 BNP、Cys-c单项及联合预测ARVD患者心力衰竭的ROC曲线下面积比较
3 讨论
慢性心力衰竭(CHF)是心血管疾病的最终归宿,也是疾病发展的终末阶段,是导致死亡的主要原因之一[8,9],心衰患者的5年存活率仅为50%[10]。心肌病是引起心衰的常见原因之一,ARVD临床上表现为右心室功能障碍、心律失常等,易发展为心力衰竭。因此,寻找灵敏、高效的早期心衰诊断及预后评估方法,是临床的研究热点。
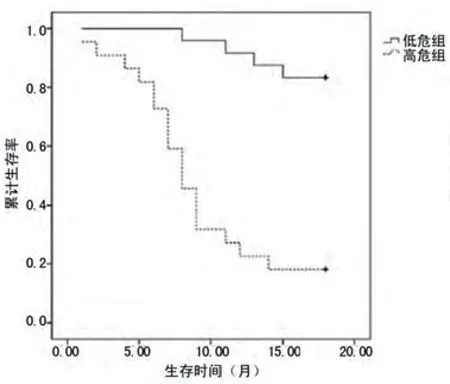
图2 BNP高危组与低危组的生存曲线
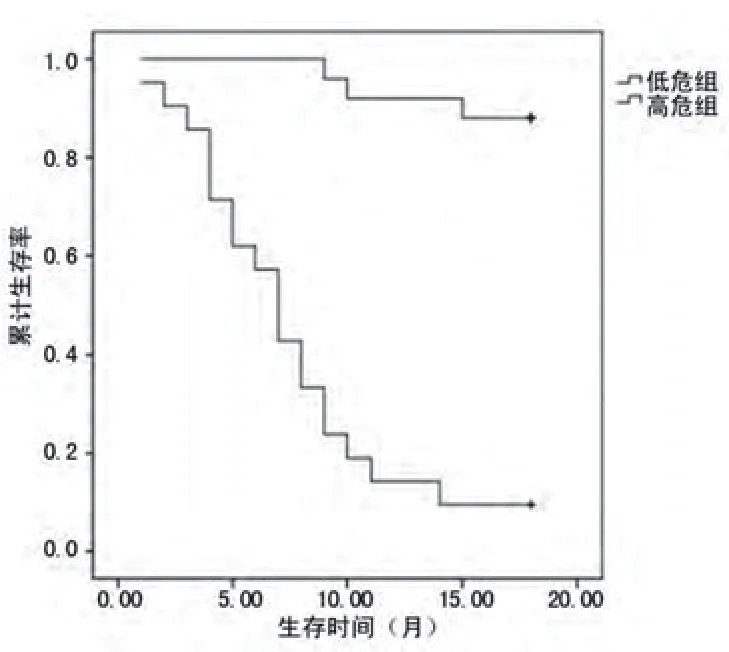
图3 Cys-c高危组与低危组的生存曲线
BNP属于脑钠肽系统的一员,其主要由心肌细胞合成与分泌,同时也存在于脑组织中,正常人群血浆中的BNP浓度低且稳定,其具有利尿利钠、舒张血管及抑制肾素活性和醛固酮的分泌等作用,有助于调节心脏功能[11]。患者因心脏压力负荷过重,心室容积增加致使心室壁张力升高,增加了BNP的分泌与释放。既往研究证实,BNP能够敏感地反映心功能状况,可用于预测心衰的发生[12]。Cys-C是一种半胱氨酸蛋白酶抑制剂,广泛存在于各种组织的有核细胞和体液中,是一种低分子量、碱性非糖化蛋白质。Cys-C最初在早期肾功能损害中被作为灵敏指标广泛应用,而肾功能损害在心衰的预后评估中具有重要意义。胡安义等[13]研究表明,心衰患者肾功能的下降程度与病死率呈正相关。多项研究表明,血清Cys-C表达水平升高与心血管疾病、心衰的发生率关系密切[14,15]。本研究观察到,入院时不同心功能分级的ARVD患者与对照组比较,BNP、Cys-C水平均显著高于对照组,ARVD患者随着心功能降低,BNP、Cys-C水平及LVEDD呈升高趋势,而LVEF呈下降趋势,且不同心功能组别之间的BNP、Cys-C、LVEF及LVEDD均存在显著性差异(P<0.05)。将以出现心衰为应变量,把可能影响心衰的年龄、性别、BNP、Cys-c、LVEF及LVEDD为自变量,进行多因素Logistic回归分析,发现BNP与Cys-C进入模型,表明BNP与Cys-C是ARVD患者心衰的独立预测因子。Peters等研究显示,BNP是心衰患者发生不良心脏事件的独立预测因素[16]。
本研究中,我们对81例ARVD患者进行了18个月的随访,共49.38%(40/81)的患者出现心衰。进一步对采用ROC受试者工作特征曲线对BNP、Cys-C单项及联合预测ARVD患者心力衰竭的效能评价,BNP为731.43 ng/L时其预测心衰的灵敏度为68.18%,特异度为70.27%,Cys-c为2.14 mg/L时其预测心衰的灵敏度为78.57%,特异度为79.49%,而联合检测预测心衰的灵敏度为81.40%,特异度为84.21%,联合检测灵敏度、特异度均得到提高。本研究以出现心衰为终点结局观察不同心功能分级各组ARVD患者的累计生存率,发现BNP高危组(BNP≥731.43 ng/L)的生存曲线明显低于低危组(BNP<731.43 ng/L),Cys-c高危组(Cys-c≥2.14 mg/L)的生存曲线明显低于低危组(Cys-c<2.14 mg/L),差异均有统计学意义(P<0.05)。提示BNP与Cys-C水平升高,ARVD患者心衰发生率相应上升,与Camm和Saguner等[17,18]研究结果类似。本研究局限性在于,样本例数偏少,仅为单中心研究,也为日后的大样本、多种研究指明了方向。
综上所述,BNP和Cys-c联合检测对ARVD引起的心力衰竭具有较高的预测价值,可为预后评估提供参考依据。
[1]Iyer VR,Chin AJ. Arrhythmogenic right ventricular cardiomyopathy/dysplasia (ARVC/D)[J]. Am J Med Genet C Semin Med Genet,2013,163(3):185-97.
[2]朱文根,贺文凤,洪葵. 心律失常基质与致心律失常性右室心肌病[J]. 临床心血管病杂志,2015,31(1):73-6.
[3]Calkins H,Corrado D,Marcus F. Risk Stratification in Arrhythmogenic Right Ventricular Cardiomyopathy[J]. Circulation,2017,136(21):2068-82.
[4]Zimmerman SL. Arrhythmogenic right ventricular cardiomyopathy/dysplasia:an updated imaging approach[J]. Magn Reson Imaging Clin N Am,2015,23(1):69-79.
[5]Cadrin-Tourigny J,Tadros R,Talajic M,et al. Risk stratification for sudden death in arrhythmogenic right ventricular cardiomyopathy[J].Expert Rev Cardiovasc Ther,2015,13(6):653-64.
[6]Corrado D,Wichter T,Link MS,et al. Treatment of arrhythmogenic right ventricular cardiomyopathy/dysplasia: an international task force consensus statement[J]. Eur Heart J,2015,36(46):3227-37.
[7]中华医学会心血管病学分会. 慢性心力衰竭诊断治疗指南[J]. 中华心血管病杂志,2007,35(12):1076-95.
[8]Chung FP,Lin YJ,Chang SL,et al. Current and state of the art on the electrophysiologic characteristics and catheter ablation of arrhythmogenic right ventricular dysplasia/cardiomyopathy[J]. J Cardiol,2015,65(6):441-50.
[9]袁方,刘华,王雯霞,等. 急性失代偿性心力衰竭合并急性肾损伤的早期诊断研究[J]. 上海交通大学学报(医学版),2014,34(12):1771-4,1779.
[10]Berte B,Denis A,Amraoui S,et al. Characterization of the Left-Sided Substrate in Arrhythmogenic Right Ventricular Cardiomyopathy[J].Circ Arrhythm Electrophysiol,2015,8(6):1403-12.
[11]唐洁,周孟君,刘运双,等. 基于血清胱抑素C估算的肾小球滤过率在慢性心力衰竭患者中的检测意义[J]. 重庆医学,2015,44(23):3262-4.
[12]Que D,Yang P,Song X,et al. Traditional vs. genetic pathogenesis of arrhythmogenic right ventricular cardiomyopathy[J].Europace,2015,17(12).
[13]胡安义,梅尚文,胡曙阳,等. 慢性心力衰竭患者心率震荡与左室射血分数、N末端脑钠肽前体的相关性研究[J]. 临床心血管病杂志,2015,31(1):77-9.
[14]Zorzi A,Rigato I,Migliore F,et al. Diagnosis and therapy of arrhythmogenic right ventricular cardiomyopathy[J]. G Ital Cardiol(Rome),2014,15(11):616-25.
[15]Santangeli P,Zado ES,Supple GE,et al. Long-Term Outcome With Catheter Ablation of Ventricular Tachycardia in Patients With Arrhythmogenic Right Ventricular Cardiomyopathy[J]. Circ Arrhythm Electrophysiol,2015,8(6):1413-21.
[16]Peters S. QRS fragmentation and epsilon waves in Fontaine leads in arrhythmogenic right ventricular cardiomyopathy: re: "The use of fontaine leads in the diagnosis of arrhythmogenic right ventricular dysplasia" and "Arrhythmogenic right ventricular cardiomyopathy:c[J].International Journal of Cardiology,2014,176(3):1015-6.
[17]Camm CF,Tichnell C,James CA,et al. Premature ventricular contraction variability in arrhythmogenic right ventricular dysplasia/cardiomyopathy[J]. J Cardiovasc Electrophysiol,2015,26(1):53-7.
[18]Saguner AM,Vecchiati A,Baldinger SH,et al. Different prognostic value of functional right ventricular parameters in arrhythmogenic right ventricular cardiomyopathy/dysplasia[J]. Circ Cardiovasc Imaging,2014,7(2):230-9.
