不同饲粮条件下奶牛胃肠道中内毒素浓度与炎症反应相关关系研究进展
2018-06-25唐志文孙福昱熊本海蒋林树
唐志文,孙福昱,杨 亮,熊本海*,蒋林树
(1.中国农业科学院 北京畜牧兽医研究所动物营养学国家重点实验室,北京 100193;2.北京农学院 奶牛营养学北京市重点实验室,北京 102206)
内毒素又称脂多糖,是革兰氏阴性细菌细胞外膜的主要组成成分,细菌快速生长或裂解死亡时都会释放大量内毒素[1]。Rodríguez-Lecompte等[2]研究表明,当奶牛饲喂精料比例过高或物理有效中性洗涤纤维(peNDF)缺乏的饲粮时,胃肠道中内毒素浓度显著增加, pH水平显著降低。高浓度的内毒素与低水平pH共同作用,损伤胃肠道上皮屏障功能[3],从而使内毒素易位进入机体外周循环系统。内毒素进入外周循环系统后会被免疫细胞识别,导致大量促炎细胞因子分泌[4],引发机体炎症反应,影响奶牛健康。而炎症反应会导致机体营养物质的重新分配,大量营养物质被用于机体免疫,影响动物生产性能[5]。本文从内毒素、奶牛胃肠道内毒素、胃肠道内毒素与炎症反应关系等方面进行综述,以期为奶牛生产中减少胃肠道内毒素易位,降低炎症发病率,保障奶牛健康提供理论依据。
1 内毒素
内毒素由多糖O抗原(O-specific side chain)、核心多糖(core region)、类脂A(lipid A)三部分组成,其中lipid A是内毒素结构中最保守的部分,也是内毒素的毒性中心,并具有相对完整的内毒素毒性作用。内毒素作为一个渗透性屏障,严格调控革兰氏阴性细菌细胞外膜通透性,因此只有分子量较小且亲水的分子才可进入细胞内部,这可以有效阻止消化道中的溶菌酶、胆汁盐以及抗菌物质等损坏细菌结构的完整性[6]。革兰氏阴性细菌在快速生长阶段和裂解死亡时都会释放内毒素,其中高达60%的内毒素是由于细菌的快速生长释放的[1]。
2 奶牛胃肠道内毒素浓度
2.1 奶牛瘤胃内毒素浓度
在现代集约化奶牛养殖中,由于饲粮中精料比例过高或peNDF缺乏,导致奶牛瘤胃发酵速率加快,挥发性脂肪酸(Volatile Fatty Acid,VFA)等有机酸快速积累,瘤胃pH显著下降,大量革兰氏阴性菌裂解死亡,释放内毒素进入瘤胃。饲粮成分、精料比例以及peNDF含量的差异会显著影响奶牛瘤胃内毒素水平。关于在不同饲粮条件下瘤胃内毒素浓度的研究,国内外有很多报道,见表1。
增加饲粮精料比例可以增加瘤胃中内毒素浓度,因为增加精料比例,可能使瘤胃中革兰氏阴性细菌快速生长,释放大量的内毒素,同时瘤胃内易发酵碳水化合物比例增加,致使VFA等有机酸加速积累,瘤胃pH快速下降,大量革兰氏阴性细菌裂解死亡,进一步释放大量内毒素。而且,随着NDF含量的降低,瘤胃内毒素浓度也会显著增加。例如,使用苜蓿颗粒代替苜蓿干草时,尽管饲粮精粗比及NDF含量保持不变,但由于peNDF含量降低,奶牛反刍效率降低,唾液分泌量减少[14-15],瘤胃pH下降,同时瘤胃内纤维分解菌受到抑制,瘤胃微生物菌群失衡,这将导致瘤胃内革兰氏阴性细菌大量死亡,释放大量内毒素。
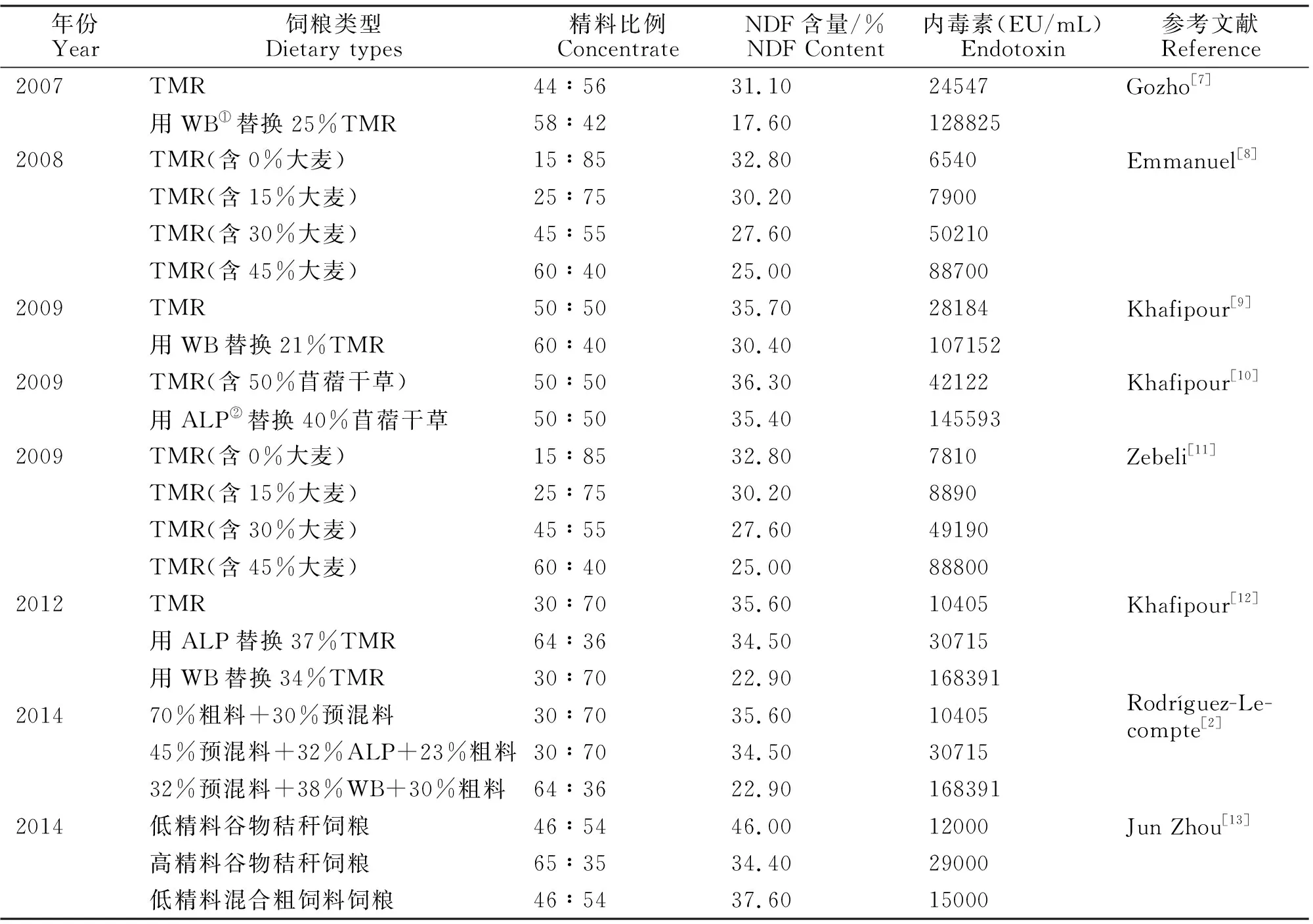
表1 不同饲粮条件下瘤胃内毒素浓度Table 1 Rumen endotoxin concentration under different dietary conditions
注:①由50%大麦颗粒+50%小麦颗粒组成的精料;②苜蓿颗粒。
Notes:①Pellets containing 50% wheat and 50% barley;②Alfalfa pellets.
2.2 奶牛后肠内毒素浓度
不同饲粮条件下,奶牛后肠内毒素浓度有很大差异。Plaizier等[16]研究发现,给奶牛持续饲喂高精料饲粮会显著增加回肠和盲肠消化物中内毒素浓度,且回肠消化物内毒素浓度比其他肠道部位更高,接近于瘤胃内毒素浓度。Jun等[13]试验结果显示,与低精料谷物秸秆(46∶54)及低精料混合粗饲料饲粮(46∶54)组相比,高精料谷物秸秆饲粮(65∶35)组粪便中LPS浓度更高,这表明饲喂高精料会增加奶牛后肠道内毒素浓度。此外,Khafipour等[12,17]利用高精料饲粮和苜蓿颗粒饲粮进行试验,结果与对照组相比,高精料饲粮组显著提高了盲肠消化物的内毒素浓度,而苜蓿颗粒组对盲肠消化物的内毒素浓度没有影响,由此可见,高精料饲粮与苜蓿颗粒饲粮虽然都增加了瘤胃内毒素的浓度,但只有高精料饲粮组可以增加后肠道内毒素浓度,也就是说相对于peNDF含量,饲粮中精料比例会更大程度地影响后肠道内毒素浓度。研究显示,瘤胃内毒素很难到达后肠部位[18-19],Van等[20]研究发现,在瘤胃后端的消化道灌注淀粉,可增加盲肠消化物中革兰氏阴性菌的浓度。因此,高谷物饲粮引起的后肠内毒素浓度增加可能是由于增加了后肠中的淀粉量,加快了内毒素产生菌的生长及裂解速度,从而增加了内毒素的释放。
3 奶牛胃肠道内毒素与炎症反应
3.1 奶牛胃肠道内毒素与急性期蛋白
内毒素是一种炎症急性期反应的高效诱导物,正常情况下由于胃肠道上皮的屏障功能,消化道内毒素只有极少量可以易位进入机体,但当消化道上皮发生损伤,内毒素就会大量易位进入机体内部循环系统,导致机体发生炎症急性期反应。急性期反应的特征包括白细胞增多、发烧、组织器官新陈代谢改变以及血浆中各种急性期反应蛋白浓度的改变等[8]。尽管内毒素由胃肠消化道易位进入机体内部循环系统,会引起诸如血清淀粉样蛋白A、触珠蛋白等急性期反应蛋白浓度的增加,但这些急性期反应蛋白浓度的增加不能证明肠道内毒素发生易位,因为其他的炎症刺激物 也会引起这些急性期反应蛋白浓度的增加,而脂多糖结合蛋白(LBP)在外周循环中浓度的增加则可以证明内毒素发生了易位[21]。
国内外大量的研究结果显示,以高精料饲粮作为试验饲粮可引起瘤胃及后肠道内毒素浓度以及血浆急性期反应蛋白浓度的改变[2,7-9,12-13,22-23],且这些试验中有部分试验发现了LBP浓度的增加[2,8-9,12],LBP浓度增加就意味着胃肠道内毒素已经易位进入外周循环系统。然而利用苜蓿颗粒饲粮饲喂奶牛,虽然增加了瘤胃内毒素浓度,但却没有引起血浆急性期反应蛋白浓度的改变,即没有触发炎症反应[2,10,12]。这可能是因为相对于高精料日粮,苜蓿颗粒日粮没有引起奶牛后肠道内毒素浓度增加,而后肠道的单层上皮比瘤胃复层上皮更容易发生内毒素易位。Steele等[24]研究发现,用含精料79%的饲粮替换全干草饲粮,饲喂超过7 d时出现明显的瘤胃上皮损伤以及角质层脱落现象。Steele等[25]又通过微观检测发现,在饲喂高谷物饲粮阶段,瘤胃上皮各层厚度均减小,检查瘤胃乳头发现细胞紧密连接减少,大量角质层脱落,角质层附近出现未分化细胞,这表明瘤胃上皮结构的完整性在饲喂高谷物饲粮阶段被损坏。因此,相比较于苜蓿颗粒组,高精料组可以使急性期蛋白浓度增加,一方面是由于高精料组损伤了瘤胃上皮屏障功能,另一方面是高精料组增加了后肠道内毒素浓度。
3.2 奶牛胃肠道内毒素触发炎症反应的过程
胃肠道上皮屏障功能作为先天性免疫的一部分,在正常情况不允许内毒素易位通过,当奶牛胃肠道上皮屏障功能受损,内毒素会通过旁细胞通路和跨细胞转运两种方式易位进入机体外周循环系统。内毒素透过胃肠道上皮或者进入外周血液循环后将会被白细胞识别,从而激活一个免疫反应,引起促炎细胞因子的分泌[26]。胃肠道上皮细胞和外周血液白细胞的受体CD14、MD2、TLR4对于内毒素的识别是必不可少的,且CD14-TLR4-MD2是最常见的内毒素识别途径。LBP是一种内毒素特异性结合蛋白,对内毒素有很高的亲和力,LBP与内毒素结合后会被细胞表面的CD14受体识别[27]。CD14是一种糖基化磷脂酰肌醇膜结合蛋白,没有跨膜部分, 因此需要通过TLR4 将信号进行跨膜转运[28],且TLR4与MD2相连接,进一步激活细胞内通路[29]。NF-κB(核转录因子-κB )信号传导通路是内毒素介导的最重要的细胞内下游通路,NF-κB广泛存在于哺乳动物细胞中,参与动物机体的炎症反应、细胞分化与凋亡等多种反应。当细胞内通路激活,会导致一系列的级联反应,使得NF-κB抑制被解除,解除抑制的NF-κB转位进入细胞核,启动靶基因的转录[30]。NF-κB的靶基因包括细胞因子、趋化因子、急性期蛋白、转录调节因子、炎症相关酶类及一些受体等[31], NF-κB进入细胞核后作用于这些靶基因并诱导其快速表达,结果产生大量促炎细胞因子,如IL-1(白介素-1)、IL-6(白介素-6)、TNF-α(肿瘤坏死因子-α)等。促炎细胞因子将信号传递至机体不同组织器官,进一步触发下游炎症反应。
3.3 炎症反应对奶牛机体的影响
胃肠道内毒素易位进入奶牛机体外周循环系统后将会引发机体炎症反应,影响动物健康。炎症反应发生时机体能量会被重新分配,大量营养物质用于免疫应答,从而影响动物生产性能,如产奶性能[9]和繁殖性能[32]等。且当胃肠道上皮发生炎症反应时,其吸收营养物质的能力下降,这将降低饲料利用效率。Plaizier等[33]研究发现,急性期反应、肝脓肿、蹄叶炎等亚急性瘤胃酸中毒症状,也是由内毒素易位引起的。因此,胃肠道内毒素易位引起的奶牛生理异常,会给奶牛生产带来严重的经济损失。
3.4 防止胃肠道内毒素触发炎症反应的措施
奶牛胃肠道内毒素触发机体炎症反应的前提是易位进入机体外周循环系统,因此可通过减少胃肠道内毒素易位来降低炎症发生的可能性。减少内毒素易位可从减少革兰氏阴性细菌内毒素释放、降低胃肠道内毒素浓度以及增强胃肠道屏障功能等方面进行。通过合理配置奶牛饲粮精料比例及增加饲粮peNDF含量,可有效减少胃肠道内毒素释放,从而降低内毒素浓度;使用活性炭等吸附剂吸收胃肠道内毒素,也可降低内毒素浓度,从而减少内毒素易位[34];在饲粮中添加益生菌,可有效增强胃肠道上皮的屏障功能,同样可减少内毒素易位[35]。
4 展 望
在现代集约化养殖模式下,奶牛饲粮中精料含量过高或peNDF缺乏的现象越来越普遍。饲粮精料比例过高,一方面使奶牛胃肠道发酵速率加快,VFA等有机酸大量积累,胃肠道pH快速下降,大量革兰氏阴性菌裂解死亡释放内毒素进入胃肠道,另一方面加快了革兰氏阴性菌的增长速率,大量内毒素脱落进入胃肠道。而且peNDF缺乏会减少奶牛反刍活动,致使唾液分泌减少,胃肠道pH水平降低,进一步增加胃肠道内毒素浓度。高浓度的内毒素与低水平pH共同作用,损伤胃肠道上皮屏障功能,导致内毒素易位进入机体外周循环系统,一旦内毒素进入机体将会被免疫细胞识别,其中CD14-TLR4 -MD2为最常见的识别通路,内毒素被识别后信号传递到细胞内,并通过NF-κB等传导通路将信号传递给细胞核,快速诱导靶基因表达,结果引起大量促炎细胞因子分泌,引发机体炎症反应。炎症反应会影响奶牛健康及生产性能。建议在今后的研究中,应进一步关注奶牛胃肠道内毒素水平,有效阻止其易位,降低奶牛炎症反应的发生率。
参考文献:
[1] ANDERSEN P. Bovine Endotoxicosis - Some Aspects of Relevance to Production Diseases. A Review[J].Acta Veterinaria Scandinavica,2003,98(S1):141-155.
[3] PENNER G B,STEELE M A,ASCHENBACH J R,et al. Ruminant Nutrition Symposium: Molecular adaptation of ruminal epithelia to highly fermentable diets[J].Journal of Animal Science,2010,89(4):1 108-1 119.
[4] M Y,S S,H H,et al. Role of adaptor TRIF in the MyD88-independent toll-like receptor signaling pathway.[J].Science,2003,301(5633):640-643.
[5] AMETAJ B N,ZEBELI Q,IQBAL S. Nutrition, microbiota, and endotoxin-related diseases in dairy cows.[J].Revista Brasileira De Zootecnia,2010,39(S):433-444.
[6] T R E,T K,U S F. Bacterial endotoxin: Molecular relationships of structure to activity and function[J]. Faseb Journal Official Publication of the Federation of American Societies for Experimental Biology,1994,2(8):217-225.
[7] GOZHO G,KRAUSE D,PLAIZIER J. Ruminal Lipopolysaccharide Concentration and Inflammatory Response During Grain-Induced Subacute Ruminal Acidosis in Dairy Cows[J].Journal of Dairy Science,2007,90(2):856-866.
[8] EMMANUEL D,DUNN S M,AMETAJ B N. Feeding High Proportions of Barley Grain Stimulates an Inflammatory Response in Dairy Cows[J].Journal of Dairy Science,2008,91(2):606-614.
[9] KHAFIPOUR E,KRAUSE D,PLAIZIER J. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation[J].Journal of Dairy Science,2009,92(3):1 060-1 070.
[10] KHAFIPOUR E,KRAUSE D,PLAIZIER J. Alfalfa pellet-induced subacute ruminal acidosis in dairy cows increases bacterial endotoxin in the rumen without causing inflammation[J].Journal of Dairy Science,2009,92(4):1 712-1 724.
[11] ZEBELI Q,AMETAJ B N. Relationships between rumen lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J].Journal of Dairy Science,2009,92(8):3 800-3 809.
[12] LI S,KHAFIPOUR E,KRAUSE D O,et al. Effects of subacute ruminal acidosis challenges on fermentation and endotoxins in the rumen and hindgut of dairy cows[J].Journal of Dairy Science,2012,95(1):294-303.
[13] ZHOU J,DONG G,AO C,et al. Feeding a high-concentrate corn straw diet increased the release of endotoxin in the rumen and pro-inflammatory cytokines in the mammary gland of dairy cows[J].BMC Veterinary Research,2014,10(1):1-10.
[14] BEAUCHEMIN K A,YANG W Z,RODE L M. Effects of particle size of alfalfa-based dairy cow diets on chewing activity, ruminal fermentation, and milk production[J].Journal of Dairy Science,2003,86(2):630-643.
[15] KRAUSE K M,COMBS D K,BEAUCHEMIN K A. Effects of forage particle size and grain fermentability in midlactation cows. I. Milk production and diet digestibility[J].Journal of Dairy Science,2002,85(8):1 936-1 946.
[16] PLAIZIER J,LI S,SCIELLOUR M,et al. Effects of duration of moderate increases in grain feeding on endotoxins in the digestive tract and acute phase proteins in peripheral blood of yearling calves[J].Journal of Dairy Science,2014,97(11):7 076-7 084.
[17] ZEBELI Q,DUNN S M,AMETAJ B N. Strong associations among rumen endotoxin and acute phase proteins with plasma minerals in lactating cows fed graded amounts of concentrate[J].Journal of Animal Science,2009,88(4):1 545-1 553.
[19] RIBEIRO M M,XU X,KLEIN D,et al. Endotoxin deactivation by transient acidification[J]. Cell Transplantation,2010,19(8):1 047-1 054.
[20] VAN KESSEL J S,NEDOLUHA P C,WILLIAMSCAMPBELL A,et al. Effects of ruminal and postruminal infusion of starch hydrolysate or glucose on the microbial ecology of the gastrointestinal tract in growing steers[J].Journal of Animal Science,2002,80(11):3 027-3 034.
[21] SRISKANDAN S,ALTMANN D. The immunology of sepsis[J].Journal of Pathology, 2008, 214(2):211-223.
[22] GOZHO G,PLAIZIER J,KRAUSE D,et al. Subacute Ruminal Acidosis Induces Ruminal Lipopolysaccharide Endotoxin Release and Triggers an Inflammatory Response[J].Journal of Dairy Science,2005,88(4):1 399-1 403.
[23] GOZHO G,KRAUSE D,PLAIZIER J. Rumen Lipopolysaccharide and Inflammation During Grain Adaptation and Subacute Ruminal Acidosis in Steers[J].Journal of Dairy Science, 2006,89(11):4 404-4 413.
[24] STEELE M A. Ruminal acidosis and the rapid onset of ruminal parakeratosis in a mature dairy cow: a case report[J].Acta Veterinaria Scandinavica,2009,51(1):39-44.
[25] STEELE M A,CROOM J,KAHLER M,et al. Bovine rumen epithelium undergoes rapid structural adaptations during grain-induced subacute ruminal acidosis[J].Ajp Regulatory Integrative & Comparative Physiology,2011,300(6):1 515-1 523.
[26] DA S C J,SOLDAU K,CHRISTEN U,et al. Lipopolysaccharide is in close proximity to each of the proteins in its membrane receptor complex. transfer from CD14 to TLR4 and MD-2[J].Journal of Biological Chemistry,2001,276(24):21 129-21 135.
[27] HAILMAN E,LICHENSTEIN H S,WURFEL M M,et al. Lipopolysaccharide (LPS)-binding protein accelerates the binding of LPS to CD14[J].Journal of Experimental Medicine, 1994, 179(1):269-277.
[28] HOSHINO K,TAKEUCHI O,KAWAI T,et al. Cutting edge: Toll-like receptor 4 (TLR4) -deficient mice are hyporesponsive to lipopolysaccharide: evidence for TLR4 as the Lps gene product[J].Journal of Immunology,1999,162(7):3 749-3 752.
[29] SAUTER K S,BRCIC M,FRANCHINI M,et al. Stable transduction of bovine TLR4 and bovine MD-2 into LPS-nonresponsive cells and soluble CD14 promote the ability to respond to LPS[J].Veterinary Immunology & Immunopathology,2007,118(1-2):92-104.
[30] ADEREM A,ULEVITCH R J. Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-787.
[31] 张劲松,王兴宇,单佑安,等.转录因子NF-κB的研究进展[J].科学通报,2002,47(5):323-329.
[32] SHELDON I M,CRONIN J,GOETZE L,et al. Defining Postpartum Uterine Disease and the Mechanisms of Infection and Immunity in the Female Reproductive Tract in Cattle[J].Biology of Reproduction,2001,81(6):1 025-1 032.
[33] PLAIZIER J C,KRAUSE D O,GOZHO G N,et al. Subacute ruminal acidosis in dairy cows: The physiological causes, incidence and consequences[J].The Veterinary Journal, 2008, 176(1):21-31.
[34] GARDINER K R,ANDERSON N H,MCCAIGUE M D,et al. Adsorbents as antiendotoxin agents in experimental colitis[J].Gut,1993,34(1):51-55.
[35] MENNIGEN R,BRUEWER M. Effect of Probiotics on Intestinal Barrier Function[J].Annals of the New York Academy of Sciences,2009,1165(1):183-189.
