盐穗木HcDMC1的原核表达和抗血清的制备
2018-06-23张丽丽张贝贝张富春
张 冀 张丽丽 张贝贝 张富春*
(1.新疆大学生命科学与技术学院,乌鲁木齐 830046; 2.新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
脱氧核糖核酸(DNA)作为细胞生命活动的主要遗传物质,在遗传信息的携带和传递上起着至关重要的作用,保持DNA分子结构的完整性和稳定性对细胞正常的生长和活动具有有重要的意义[1~4]。然而在各种生物和非生物的胁迫(例如细菌病毒、电离辐射、紫外照射、高盐、干旱和细胞代谢物质等)下,多种因素都能够导致DNA发生断裂损伤[5~7]。由于植物的不可移动性,其能量代谢依赖于阳光,长时间滴暴露在各种胁迫之下,因此植物细胞的基因组DNA更容易受损。
在不同因素诱导的DNA损伤中,DNA双链断裂(double-strand break,DSB)是常见的形式之一,主要由异常的复制和修复引起[8]。DNA的双链断裂可以导致细胞遗传不稳定,促使细胞死亡。研究表明DNA双链断裂的修复主要有非同源的末端连接(NHEJ)和同源重组(HR)这两种途径[9],其中同源重组修复途径以姊妹染色单体为模板修复DSB,为无误的修复途径,主要发生在S期和G2期[10]。而DNA损伤修复蛋白(DMC1)是细胞减数分裂的特异性重组蛋白,参与细胞的同源重组[11]。例如大肠杆菌和DMC1为同源蛋白的RecA蛋白,能够促进Rad52介导的Rad51装载到单链DNA上,形成前联会核蛋白纤维,并帮助联会复合体配对和重组完成双链断裂修复[12]。大量植物基因组的测序表明,植物DMC1的氨基酸序列具有较高的同源性(90%以上),说明植物DMC1的氨基酸序列在进化上是高度保守的,其编码的氨基酸序列顺序和长度变异较小[13~16]。DMC1和Rad51要发挥其基本的功能还需要和其他蛋白的相互作用[17],例如Hop2和Mnd1就是HR通路中的两个保守蛋白,但Hop2和Mnd1能够与DMC1和Rad51发生相互作用。在Hop2和Mnd1突变的小鼠精母细胞中,DMC1和Rad51可以被装配到断裂的DNA末端,但却没有重组的活性。生化分析表明,Hop2和Mnd1参与DMC1和Rad51激活的DNA链的入侵[18]。因此DMC1可以通过同源重组途径参与DNA双链断裂的修复。
盐穗木(Halostachyscaspica)是藜科(Chenopodiaceae)盐穗木属(Halostachys)的盐生植物,生长于新疆极端干旱的荒漠盐碱地。根据盐胁迫下盐穗木转录组数据库,克隆获得了盐穗木DNA损伤修复基因HcDMC1[19]。为深入探讨HcDMC1的耐盐性功能,本研究通过构建原核表达载体pET30a-HcDMC1,利用融合蛋白免疫小鼠,期望获得抗HcDMC1的小鼠抗血清,为进行盐穗木HcDMC1蛋白的功能鉴定和免疫检测提供实验材料。
1 材料和方法
1.1 实验材料
盐穗木(Halostachyscaspica)的种子采于新疆五家渠103团野外盐碱地(东经87.31°北纬44.29°)。播种于实验室花盆中,基质为:珍珠岩∶蛭石∶花土=1∶1∶3。在24±2℃,16 h/8 h:昼/夜,以120 d左右的幼苗为实验材料。
1.2 实验方法
1.2.1 盐穗木总RNA的提取及cDNA的合成
称取盐穗木同化枝0.1~0.5 g,迅速至于预冷的研钵中,充分研磨,按照OMEGA植物总RNA提取试剂盒的说明书提取盐穗木同化枝总RNA,NanoDrop定量仪和琼脂糖凝胶电泳检测RNA的浓度(ng·μL-1)和纯度(OD260/280),RNA置于-80℃冰箱保存。选取纯度和浓度较高的RNA,取1 μg RNA为模板反转录cDNA第一条链,步骤参照Takara M-MLV逆转录酶的说明书进行操作,合成的cDNA保存于-80℃冰箱待用。
1.2.2 原核表达载体pET30a-HcDMC1的构建
根据已经获得的盐穗木HcDMC1基因序列,设计合成了扩增HcDMC1所需的上下游引物(FpHcDMC1-pET30a 5′-CGCGGATCCATGTATGCACTCAAATCTG-3′,RpHcDMC1-pET30a5′-GACG TCGACTCAGTCCTTTGCATCTCC-3′),扩增的目的片段为1 035 bp。以盐穗木cDNA为模板采用高保真酶pfu进行PCR反应,反应条件为:预热至94℃ 300 s;然后94℃ 40 s,62℃ 40 s,72℃ 100 s,进行35个循环;最后72℃ 600 s结束PCR。PCR的扩增产物经回收纯化,分别用BamHⅠ和SalⅠ对PCR纯化产物和pET30a表达载体进行双酶切,回收目的基因片段和表达载体后,T4连接酶16℃水浴中过夜连接,连接产物转化大肠杆菌DH5α,鉴定阳性克隆送测序。将测序正确的质粒,转化大肠杆菌表达菌株BL21。
1.2.3 His-HcDMC1蛋白的诱导表达和纯化
将原核表达载体pET30a-HcDMC1转化大肠杆菌表达菌株BL21后,挑选阳性克隆,分别用不同浓度的IPTG(0.3、0.5和0.7 mmol·L-1)进行诱导表达3~4 h。各取1 mL诱导前和诱导后的菌液,12 000 r·min-1离心2 min,收集菌体细胞,用1 mL PBS洗涤菌体细胞一次,加入80 μL PBS,20 μL 5×上样缓冲液液,混匀后在沸水浴中15 min,12 000 r·min-1离心10 min,取上清SDS-PAGE进行蛋白检测。将处理好的诱导前和诱导后的蛋白样品经12%的SDS-PAGE分离后,转移到PVDF膜(聚偏二氟乙烯膜)上,5%脱脂奶粉4℃过夜封闭,TBST洗膜3次,用HIS鼠源单克隆抗体作为一抗37℃孵育2 h,PBST洗膜3次,每次10 min,用HRP标记的山羊抗鼠IgG作为二抗37℃孵育1 h,TBST洗膜3次,每次10 min,用DAB显色液显色。将能表达His-HcDMC1融合蛋白的菌种菌株按1/100接入1 L含1/1 000卡那霉素的LB培养基中,37℃高速振荡(220 r·min-1)培养至OD595=0.6~0.8时,取1 mL不加IPTG的菌液为诱前作对照,然后加入IPTG(终浓度为0.5 mmol·L-1),培养4 h后取1 mL菌液作诱后蛋白,然后4℃离心收集菌液。用PBS(pH7.2~7.4)缓冲液洗涤菌体一次,用20 mL的PBS重悬菌体,超生破碎细胞,离心收集沉淀,用含6 mol·L-1尿素的结合缓冲液充分溶解包涵体沉淀,离心后上清用0.45 mm滤器过滤上镍柱纯化包涵体蛋白。SDS-PAGE检测纯化的包涵体蛋白,将含有目的蛋白的洗脱液装入选取合适孔径的透析袋内,分别用4、2和0 mol·L-1浓度尿素逐步梯度降低的方法分别透析12 h,再将透析袋内的蛋白用合适孔径的超滤管进行超滤浓缩,定量后置于-80℃保存待用。
1.2.4 His-HcDMC1融合蛋白含量的测定
以BSA为标准蛋白制作标准曲线,按Thermo BCA蛋白定量试剂盒说明书测定盐穗木His-HcDMC1融合蛋白的含量。
1.2.5 免疫小鼠制备His-HcDMC1抗血清
以纯化的融合蛋白His-HcDMC1为抗原,将等体积的融合蛋白His-HcDMC1与弗氏完全佐剂充分乳化,采用背部多点皮下的免疫方法,每只小鼠免疫50 μg融合蛋白His-HcDMC1,分别在2和4周后,将等体积融合蛋白与弗氏不完全佐剂充分乳化,以相同的剂量和免疫途径加强免疫小鼠,每次免疫前对小鼠进行眼眶采血法收集血清,进行抗血清滴度的检测。
1.2.6 抗体效价及特异性检测
将纯化的盐穗木HcDMC1融合蛋白作为抗原每孔2 μg过夜包被于ELISA板,用PBS-T缓冲液洗涤3次,每次3 min,5%的脱脂奶粉37℃封闭2 h。PBS-T缓冲液洗涤3次,每次3 min,加入5%的脱脂奶粉梯度稀释的小鼠血清,37℃孵育2 h。PBS-T缓冲液洗涤3次,每次3 min,HRP标记的山羊抗鼠IgG(1∶5 000)作为二抗,37℃孵育1.5 h,PBST缓冲液洗涤3次,最后用TMB显色15~30 min,ELISA终止液终止反应后用酶标仪检测在450 nm波长下的吸光值。未免疫前的血清为对照,其A450值为N;免疫后的A450值为P,以P/N>2.1判断为阳性。
将抗原蛋白His-HcDMC1蛋白进行12% SDS-PAGE电泳后转移至PVDF膜上。用含有5%的脱脂奶粉的TBST 4℃过夜封闭PCDF膜,TBS-T洗膜3次,每次10 min,加入一抗(HcDMC1抗血清),37℃孵育2 h,TBST洗膜3次,加入二抗(HRP标记的山羊抗鼠IgG),37℃孵育1 h后用DAB显色液中显色。
2 结果与分析
2.1 原核表达载体pET30a-HcDMC1的构建
提取构建获得的pET30a-HcDMC1重组质粒,用BamHⅠ和SalⅠ进行双酶切鉴定,结果获得的酶切产物片段大小与预期的1 035 bp大小一致,初步证明重组质粒pET30a-HcDMC1构建成功,测序结果表明重组质粒pET30a-HcDMC1构建正确。

图1 重组质粒pET30a-HcDMC1的双酶切分析 M. 5000DNA标准分子量;1~4.重组质粒pET28a-HcDMC1的BamHⅠ和SalⅠ的双酶切Fig.1 Analysis of recombinant plasmid pET28a-HcDMC1 by BamHⅠ and SalⅠ digestion M. 5000DNA standard molecular weight;1-4. Double enzyme digestion of recombinant plasmid pET28a-HcDMC1 BamHⅠ and SalⅠ
2.2 His-HcDMC1蛋白的诱导表达和纯化
将构建成功的pET30a-HcDMC1转化到大肠杆菌BL21中,挑选阳性克隆,利用不同浓度的IPTG(0.3、0.5和0.7 mmol·L-1)进行重组蛋白的诱导表达。结果表明12%的SDS-PAGE可以检测到大量诱导的His-HcDMC1融合蛋白(图2),与诱导表达前相比较,携带重组质粒pET30a-HcDMC1的菌种经IPTG诱导表达后,沉淀中出现一条蛋白增强条带,分子量约为47 kD,与预期的His-HcDMC1融合蛋白相对分子量相似,证明His-HcDMC1融合蛋白被诱导表达。随后通过Western Blot检测了His-HcDMC1融合蛋白在细胞中的表达状态,表明His-HcDMC1融合蛋白主要以包涵体的形式在大肠杆菌中表达(图3)。由于His-HcDMC1的融合蛋白具有组蛋白标签,所以采用Ni-NTA-agarose亲和层析柱进行纯化后用12%的SDS-PAGE进行检测。浓度为10、20和200 mmol·L-1咪唑洗脱的融合蛋白His-HcDMC1条带单一且表达量较大,而纯化的融合蛋白与期望目的蛋白大小一致(图4)。经过透析和超滤后进行SDS-PAGE进行检测(图5),再利用BCA蛋白定量方法建立标准曲线(图6)计算后,确认纯化的融合蛋白His-HcDMC1浓度约1.0 mg·mL-1。

图2 不同浓度IPTG诱导融合蛋白His-HcDMC1的表达 1.IPTG诱导前;M.蛋白标准分子量;2. 0.3 mmol·L-1 IPTG诱导;3. 0.5 mmol·L-1 IPTG诱导;4. 0.7 mmol·L-1 IPTG诱导Fig.2 Expression of fusion protein His-HcDMC1 induced by IPTG at different concentrations 1. Before IPTG induction;M. Protein standard molecular weight;2. 0.3 mmol·L-1 IPTG induction;3. 0.5 mmol·L-1 IPTG induction;4. 0.7 mmol·L-1 IPTG induction

图3 免疫印迹法检测融合蛋白His-HcDMC1的表达1.IPTG诱导前;2. 0.5 mmol·L-1 IPTG诱导后;3.表达的上清液;4.表达的沉淀;M.蛋白标准分子量Fig.3 Western blot detection of the expression of fusion protein His-HcDMC1 1.Before IPTG induction;2.After 0.5 mmol·L-1 IPTG induction;3.Supernatant of expression;4.Precipitation of expression;M.Protein standard molecular weight

图4 融合蛋白His-HcDMC1的纯化 1.穿流液;M.蛋白标准分子量;2.结合缓冲液;3.咪唑浓度10 mmol·L-1; 4.咪唑浓度20 mmol·L-1;5.咪唑浓度50mmol·L-1;6.咪唑浓度200 mmol·L-1;7.咪唑浓度300 mmol·L-1;8.咪唑浓度500 mmol·L-1Fig.4 Purification of fusion protein His-HcDMC1 1. Flow-through fluid;M. Protein standard molecular weight;2. Binded buffer solution;3. Imidazole concentration 10 mmol·L-1; 4. Imidazole concentration 20 mmol·L-1;5. Imidazole concentration 50 mmol·L-1;6. Imidazole concentration 200 mmol·L-1;7. Imidazole concentration 300 mmol·L-1;8. Imidazole concentration 500 mmol·L-1

图5 SDS-PAGE检测透析超滤后的融合蛋白His-HcDMC1 M.蛋白标准分子量;1~3.咪唑洗脱的融合蛋白His-HcDMC1Fig.5 SDS-PAGE detection of fusion protein His-HcDMC1 after dialysis and ultrafiltration M.Protein standard molecular weight;1-3.Imidazole eluted fusion protein His-HcDMC1

图6 蛋白定量的标准曲线Fig.6 Standard curve for protein quantitation
2.3 小鼠多克隆抗体效价和特异性检测
His-HcDMC1融合蛋白免疫小鼠3次后,利用ELISA检测小鼠血清的抗体效价。小鼠抗血清ELISA检测的A450值与阴性对照相比大于2.1。3次His-HcDMC1融合蛋白免疫小鼠后的血清效价约为1∶400 000(图7),小鼠的抗体效价达到了预期目标。免疫印迹进行特异性检测(图8),表明已经成功的制备了抗His-HcDMC1融合蛋白的抗血清。
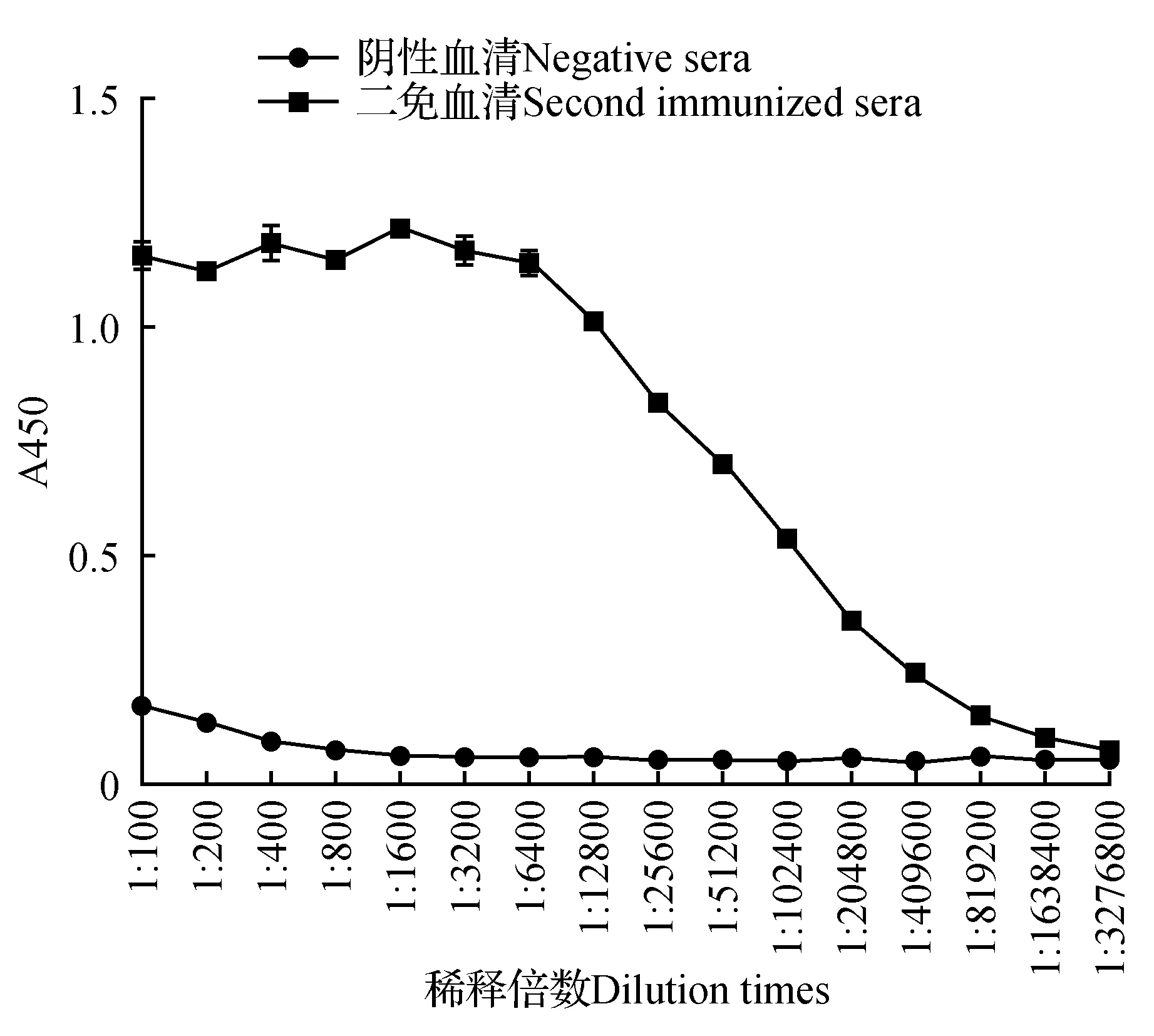
图7 小鼠抗血清抗体效价的酶联免疫吸附检测Fig.7 ELISA detection of mouse antiserum titer against His-HcDMC1

图8 免疫印迹检测小鼠抗血清的特异性 1.诱导前蛋白;2.诱导后His-HcDMC1Fig.8 Western blot detection of mouse antiserum specificity against His-HcDMC1 1.Protein before induction;2.His-HcDMC1 after induction
3 讨论
DNA的复制、修复和重组对于活的有机体的遗传信息的复制、传递以及维护基因组的稳定性上起着十分重要的作用[20]。研究发现,DMC1定位于减数分裂前1期的偶线期,为减数分裂的特异性重组蛋白,是减数分裂重组和联会复合体的重要组成部分,参与同源染色体的配对[21]。利用荧光共振能量转移技术对DMC1参与调节DNA链交换,结果证明DMC1调节DNA链交换对于位置、类型和分布具有高的敏感性,并且DMC1可以抑制在入侵的DNA和同源DNA之间不频发的错配。DMC1还可以促进减数分裂中多形态的母本和父本同源染色体之间的重组[22]。近期的研究结果进一步证明[23~25],敲除DMC1的小鼠卵母细胞无法形成联会复合体,细胞周期停滞于减数分裂前Ⅰ期,从而导致卵泡数目急剧减少。DMC1的敲除使得小鼠无法修复断裂的DNA双链,而引起卵母细胞不断封闭和凋亡。
酵母细胞中相关也研究表明[26],DMC1基因突变的酵母菌丧失了重组的功能,不能形成联会复合体,减数分裂被阻断在前前Ⅰ期。DMC1是哺乳动物细胞的特异性重组蛋白,与它的一个同源蛋白Rad51形成异源二聚体,并且和断裂的单链DNA分子形成核蛋白纤维,对减数分裂中重组分子之间D-loop的形成有一定的促进作用[27],DMC1还在重组时DNA链的入侵的过程中起重要作用。
近年来已经从人、鼠和拟南芥等高等真核生物中克隆得到DMC1的同源基因,其编码的氨基酸序列在进化上具有高度的保守性,都参与减数分裂时期同源染色体的配对和同源重组修复途径[28]。本研究前期的研究表明,盐穗木HcDMC1基因受到盐胁迫的诱导,特别是在14 d的500和700 mmol·L-1NaCl浓度处理下作为生殖器官的同化枝中的表达量显著升高[19],推测其可能是通过高表达盐穗木HcDMC1来提高其在极端环境下的耐受性和生殖能力。此外已有的研究表明,高盐或丝裂霉素C(MMC)可以诱导植物的基因组DNA发生双链断裂,同时DMC1介导的DNA重组受一定的因子调控,水稻DMC1在水稻减数分裂同源染色体配对中也不是必须的,DMC1还需要其蛋白协助才能进入DNA双链断裂的末端,这些研究结果表明DMC1需要借助各种调控因子来完成减数分裂同源染色体的配对和同源重组的修复,进而发挥作用[29~31]。
4 结论
利用pET30a-HcDMC1进行融合蛋白的诱导表达,在0.3、0.5和0.7 mmol·L-1IPTG诱导表达后,均可获得分子量约为47 kD,经过浓度为10、20和200 mmol·L-1咪唑的洗脱,His-HcDMC1融合蛋白浓度约1.0 mg·mL-1。
免疫小鼠3次后,抗血清效价达到1∶400 000,免疫印迹检测为特异性的抗血清。这表明制备获得了滴度较高和特异性较好的抗血清,为盐穗木HcDMC1蛋白的功能减低和免疫检测提供了物质基础。
1.Prentiss M,Prévost C,Danilowicz C.Structure/function relationships in RecA protein-mediated homology recognition and strand exchange[J].Critical Reviews in Biochemistry and Molecular Biology,2015,50(6):453-476.
2.Shen J P,Srivas R,Gross A,et al.Chemogenetic profiling identifiesRAD17 as synthetically lethal with checkpoint kinase inhibition[J].Oncotarget,2015,6(34):35755-35769.
3.Wan L,Han J H,Liu T,et al.Scaffolding protein SPIDR/KIAA0146 connects the Bloom syndrome helicase with homologous recombination repair[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(26):10646-10651.
4.Gohlke G,Scholz C J,Kneitz S,et al.DNA methylation mediated control of gene expression is critical for development of crown gall tumors[J].PLoS Genetics,2013,9(2):e1003267.
5.Brown M S,Grubb J,Zhang A N,et al.Small Rad51 and Dmc1 complexes often Co-occupy both ends of a meiotic DNA double strand break[J].PLoS Genetics,2015,11(12):e1005653.
6.郭传玲,王菊芳,李文建.细胞辐射敏感性与DNA双链断裂及修复相关性研究[J].中华放射医学与防护杂志,2007,27(3):303-306.
Guo C L,Wang J F,Li W J.The study of the correlation between cell radiosensitivity and DNA double strand breaks & repair [J].Chinese Journal of Radiological Medicine and Protection,2007,27(3):303-306.
7.陈红霞.SOSS1和ZNHIT1/SRCAP参与同源重组修复的分子机制研究[D].杭州:浙江大学,2015.
Chen H X.Understanding the roles of SOSS1and ZNHIT1/SRCAP in homologous recombination repair[D].Hangzhou:Zhejiang University,2015.
8.Khoronenkova S V,Dianov G L.ATM prevents DSB formation by coordinating SSB repair and cell cycle progression[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(13):3997-4002.
9.李启娟,王德荣.检控蛋白Rad17及其在肿瘤中的意义[J].国际肿瘤学杂志,2011,38(5):336-338.
Li Q J,Wang D R.Rad17 and its significance in tumor[J].Journal of International Oncology,2011,38(5):336-338.
10.Ma L J,Milman N,Nambiar M,et al.Two separable functions of Ctp1 in the early steps of meiotic DNA double-strand break repair[J].Nucleic Acids Research,2015,43(15):7349-7359.
11.陶敏,刘少军,龙昱,等.不同倍性鲫鲤鱼Dmc1基因cDNA的克隆及其表达分析[J].中国科学 C辑:生命科学,2007,37(6):625-633.
Tao M,Liu S J,Long Y,et al.The cloning ofDmc1 cDNAs and a comparative study of its expression in different ploidy cyprinid fishes[J].Science in China Series C:Life Sciences,2008,51(1):38-46.
12.Resseguie E A,Staversky R J,Brookes P S,et al.Hyperoxia activates ATM independent from mitochondrial ROS and dysfunction[J].Redox Biology,2015,5:176-185.
13.江瑞胜,刘敏,李程,等.细胞周期检控蛋白Rad17[J].中国细胞生物学学报,2008,30(4):417-420.
Jiang R S,Liu M,Li C,et al.Cell cycle checkpoint protein Rad17[J].Chinese Journal of Cell Biology,2008,30(4):417-420.
14.Tripathi K,Hussein U K,Anupalli R,et al.Allyl isothiocyanate induces replication-associated DNA damage response in NSCLC cells and sensitizes to ionizing radiation[J].Oncotarget,2015,6(7):5237-5252.
15.程龙,李茜,熊焰,等.紫外诱导植物产生DNA损伤的修复机制[J].生命的化学,2005,25(6):504-506.
Cheng L,Li Q,Xiong Y,et al.Mechanism of repair of DNA damage in plants induced by UV[J].Chemistry of Life,2005,25(6):504-506.
16.Zafar F,Seidler S B,Kronenberg A,et al.Homologous recombination contributes to the repair of DNA Double-strand breaks induced by High-energy iron ions[J].Radiation Research,2010,173(1):27-39.
17.Yu X,Egelman E H.Helical filaments of human Dmc1 protein on single-Stranded DNA:a cautionary tale[J].Journal of Molecular Biology,2010,401(3):544-551.
18.Sharma D,Say A F,Ledford L L,et al.Role of the conserved lysine within the Walker A motif of human DMC1[J].DNA Repair,2013,12(1):53-62.
19.杜驰,张富春.盐穗木HcDmc1基因的克隆和表达分析[J].西北植物学报,2015,35(2):220-226.
Du C,Zhang F C.Clone and expression analysis ofHcDmc1 gene fromHalostachyscaspica[J].Acta Botanica Boreali-Occidentalia Sinica,2015,35(2):220-226.
20.Chi P,Van Komen S,Sehorn M G,et al.Roles of ATP binding and ATP hydrolysis in human Rad51 recombinase function[J].DNA Repair,2006,5(3):381-391.
21.Dai J Q,Voloshin O,Potapova S,et al.Meiotic knockdown and complementation reveals essential role of RAD51 in mouse spermatogenesis[J].Cell Reports,2017,18(6):1383-1394.
22.Busygina V,Gaines W A,Xu Y Y,et al.Functional attributes of theSaccharomycescerevisiaemeiotic recombinase Dmc1[J].DNA Repair,2013,12(9):707-712.
23.Amunugama R,Groden J,Fishel R.The HsRAD51B-HsRAD51C stabilizes the HsRAD51 nucleoprotein filament[J].DNA Repair,2013,12(9):723-732.
24.Bendjilali N,Macleon S,Kalra G,et al.Time-course analysis of gene expression during theSaccharomycescerevisiaehypoxic response[J].G3:Genes,Genomes,Genetics(Bethesda),2017,7(1):221-231.
25.Finsterbusch F,Ravindranathan R,Dereli I,et al.Alignment of homologous chromosomes and effective repair of programmed DNA Double-strand breaks during mouse meiosis require the Minichromosome Maintenance Domain Containing 2(MCMDC2) protein[J].PLoS Genetics,2016,12(10):e1006393.
26.Chen J,Cui X J,Jia S T,et al.Disruption ofdmc1 produces abnormal sperm in Medaka(Oryziaslatipes)[J].Scientific Reports,2016,6:30912.
27.Callender T L,Laureau R,Wan L H,et al.Mek1 down regulates Rad51 activity during yeast meiosis by phosphorylation of Hed1[J].PLoS Genetics,2016,12(8):e1006226.
28.Kobayashi W,Takaku M,Machida S,et al.Chromatin architecture may dictate the target site for DMC1,but not for RAD51,during homologous pairing[J].Scientific Reports,2016,6:24228.
29.Martinez J S,Von Nicolai C,Kim T,et al.BRCA2 regulates DMC1-mediated recombination through the BRC repeats[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(13):3515-3520.
30.Wang H J,Hu Q,Tang D,et al.OsDMC1 is not required for homologous pairing in rice meiosis[J].Plant Physiology,2016,171(1):230-241.
31.Macqueen A J.Catching a(double-strand) Break:the Rad51 and Dmc1 strand exchange proteins can Co-occupy both ends of a meiotic DNA double-strand break[J].PLoS Genetics,2015,11(12):e1005741.
