长链非编码RNA lucat1对胃癌细胞侵袭和迁移能力的影响及其机制
2018-06-19于贵林林杰赵国华艾福禄王越
于贵林,林杰,赵国华,艾福禄,王越
(辽宁省肿瘤医院,沈阳110042)
长链非编码RNA(lncRNA)是一类长度大于200个核苷酸、不具有编码能力的核苷酸序列[1,2]。大量研究表明,lncRNA广泛参与肿瘤细胞的多种生物学过程,如细胞增殖、分化、凋亡等[3];还可通过调节转录、调节各种转录后过程和招募染色质重组复合物等功能发挥作用[4]。识别癌相关的lncRNA并研究其分子和生物学作用具有重要意义。既往研究发现,胃癌细胞lncRNA lucat1过表达,其过表达与胃癌细胞侵袭和迁移能力呈正相关关系。有报道,甲酰肽受体2(FPR2)表达可影响上皮-间充质转化(EMT)而参与胃癌细胞的侵袭和转移[5]。前期我们采用生物信息学方法预测,lncRNA lucat1可能通过调节FPR2发挥作用。2017年3~8月,本研究对这一预测结果进行验证。
1 材料与方法
1.1 材料 人胃腺癌细胞SGC-7901、BGC-823及正常胃黏膜细胞GES-1取自辽宁省肿瘤医院中心实验室,置于含10% FBS的RPMI 1640培养基(Invitrogen公司)中,37 ℃、50 mL/L CO2的培养箱中培养,间隔2 天更换培养基1次。FBS DMEM培养液(美国Gibico公司),CO2无菌培养箱(美国Thermo公司); lucat1 shRNA慢病毒载体及FPR2过表达质粒(ex-FPR2)由上海吉凯生物工程有限公司构建,逆转录试剂盒(武汉博士德生物工程有限公司),定量引物(上海吉凯生物工程有限公司),Transwell小室(美国Corning公司),稀释基质胶(美国BD公司)。
1.2 SGC-7901、BGC-823、GES-1细胞lncRNA lucat1和FPR2 mRNA表达检测 采用实时荧光定量PCR法。采用TRIzol法提取各细胞总RNA并检测RNA的纯度及浓度。将总RNA逆转录为cDNA,用ROCHE实时定量荧光PCR仪行实时荧光定量PCR扩增。lncRNA lucat1上游引物序列5′-ACCAGCTGTCCCTCAGTGTTCT-3′,下游引物序列5′-AGGCCTTTATCCTCGGGTTGCCT-3′;FPR2上游引物序列5′-GAGACCTCAGCTGGTTGTGC-3′,FPR2下游引物序列5′-ACCACCACTTCTGATCCATTCA-3′;内参U6上游引物序列5′-TTATGGGTCCTAGCCTGAC-3′,下游引物序列5′-CACTATTGCGGGCTGC-3′。采用2-ΔΔCt法计算lncRNA lucat1和FPR2 mRNA相对表达量。
1.3 下调lucat1表达对胃癌细胞SGC-7901、BGC-823 FPR2 mRNA表达影响的观察 将体外培养的胃癌细胞SGC-7901、BGC-823分为观察组和对照组。观察组用Lipofectamine2000转染lncRNA lucat1 shRNA,按操作手册操作;对照组不转染。lncRNA lucat1 shRNA正义序列:5′-UUAAGAAGUAGAACACUGAGGGACA-3′,反义序列5′-UGUCCCUCAGUGUUCUACUUCUUAA-3′。转染48 h,采用1.2中的方法检测两组SGC-7901、BGC-823细胞FPR2 mRNA相对表达量。
1.4 转染lncRNA lucat1 shRNA及FPR2过表达质粒对胃癌细胞BGC-823侵袭和迁移能力影响的观察 将体外培养的BGC-823细胞分为A、B、C组。A组转染lncRNA lucat1 shRNA,B组转染lncRNA lucat1 shRNA和FPR2过表达质粒,方法同1.3。C组不转染。转染48 h,观察各组细胞侵袭和转移能力。① Transwell小室实验。在每个8 μm孔径的Transwell小室内加入50 μg ECM 胶进行包被,37 ℃无菌条件下放置6 h。ECM胶充分凝固后,上室接种细胞2×105/孔后加入无抗生素、无血清培养基,下室加入含10%血清的无抗生素培养基,继续培养 24 h。将小室取出,用无菌棉签擦拭去除上室内细胞,以1%结晶紫染液将小室多孔膜下表面的细胞染色,拍照。计数紫色染色的穿膜细胞数。②划痕实验。将细胞接种于6孔板,100 μL枪头垂直于孔板制作细胞划痕,尽量保证各个划痕宽度一致。吸去细胞培养液,用PBS冲洗孔板3次,洗去划痕产生的细胞碎片。加入无血清培养基,拍照记录。将培养板放入培养箱培养,48 h后再取出拍照,计算迁移距离(荧光显微镜拍照,以96孔中心阴影区域为参照,划痕在图片的正中)。
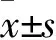
2 结果
2.1 SGC-7901、BGC-823、GES-1细胞lncRNA lucat1和FPR2 mRNA相对表达量比较 SGC-7901、BGC-823、GES-1细胞lncRNA lucat1相对表达量分别为3.651±0.332、3.023±0.331、1.000±0.098,FPR2 mRNA相对表达量分别为3.354±0.433、3.425±0.354、1.000±0.277。SGC-7901、BGC-823细胞lncRNA lucat1、FPR2 mRNA相对表达量均高于GES-1细胞(P均<0.05)。
2.2 下调lncRNA lucat1表达对SGC-7901、BGC-823细胞FPR2 mRNA表达的影响 观察组、对照组SGC-7901细胞FPR2 mRNA相对表达量分别为1.00±0.05、0.48±0.04,BGC-823细胞FPR2 mRNA相对表达量分别为1.00±0.04 、 0.48±0.04,两组比较P均<0.05。
2.3 转染lncRNA lucat1 shRNA及FPR2过表达质粒对胃癌细胞BGC-823侵袭和迁移能力的影响 Transwell小室实验显示,A、B、C组穿膜细胞数分别为(143±7)、(194±9)、(233±8)个,三组穿膜细胞数两两比较P均<0.05。划痕实验显示,A、B、C组细胞迁移距离分别为(0.342±0.027)、(0.534±0.021)、(0.652±0.029)mm,三组细胞迁移距离两两比较P均<0.05。
3 讨论
lncRNA表达改变是肿瘤发生的驱动因素之一。lncRNA可在不同水平调节基因表达[6]:部分lncRNA首先作为信号与蛋白质结合(如激素受体和转录因子),然后复合物与启动子位点结合,调节下游基因表达; lncRNA可作为引导调控蛋白到靶向基因启动子位点的指引;部分lncRNA作为诱饵阻止调控蛋白与启动子位点结合,或作为支架来招募蛋白复合物。
lucat1又名SCAL1,定位于5号染色体,2013年首次在吸烟者的呼吸道上皮细胞中被发现,在非小细胞肺癌细胞系中高表达[7]。有文献报道,lucat1可通过降低人非小细胞肺癌组织p21和p57表达而调控肿瘤细胞周期和增殖[8];并能诱导浆液性卵巢癌对顺铂的耐药[9]。Thai等[10]报道,lucat1可通过DNA甲基化调控甲基转移酶1(DNMT1)的稳定性,抑制抑癌基因表达,从而促进肿瘤的形成。Sun等[11]报道,miR-200c可通过RNA海绵的作用调节ABCB1和lucat1表达。目前lucat1在胃癌侵袭和迁移中的生物学作用和调控机制仍不清楚。本研究结果显示,与胃黏膜上皮细胞相比,BGC-823细胞lncRNA lucat1呈过表达;下调lncRNA lucat1表达可抑制细胞的侵袭和迁移能力。证实lncRNA lucat1过表达参与胃癌的侵袭和迁移。
FPR家族成员共包括FPR1、FPR2和FPR3,三者均在胃癌细胞中表达[12]。FPR2是一种典型的G蛋白偶联受体的化学吸引受体,通过与不同配体和不同细胞结合而被激活,其激活后可触发不同的信号通路:如磷脂酶C、蛋白激酶C、磷酸肌醇3激酶/蛋白激酶B、丝裂原活化蛋白激酶等[13,14],这些通路均参与肿瘤细胞的侵袭和迁移。为研究lncRNA lucat1调控胃癌细胞侵袭和迁移能力的机制,本研究进一步观察了下调lncRNA lucat1表达对BGC-823细胞FPR2表达的影响,结果显示转染lncRNA lucat1 shRNA的观察组FPR2 mRNA相对表达量高于对照组。本研究还观察了转染lncRNA lucat1 shRNA及FPR2过表达质粒对胃癌细胞BGC-823侵袭和迁移能力的影响,结果显示共转染lncRNA lucat1 shRNA及FPR2过表达质粒的B组BGC-823细胞Transwell小室实验的穿膜细胞数和划痕实验的细胞迁移距离均大于转染lncRNA lucat1 shRNA的A组,表明lncRNA lucat1可能通过FPR2调控胃癌细胞侵袭和迁移。
综上所述,lncRNA lucat1可促进胃癌细胞的侵袭和迁移,其机制可能与促进FPR2表达有关,但其具体分子生物学机制仍需进一步研究探讨。lncRNA lucat1和FPR2有望成为胃癌诊断和靶向治疗的新靶点。
参考文献:
[1] Siegel RL,Miller KD,Jemal A. Cancer Statistics,2017[J]. CA: Cancer J Clin,2017,67(1):7-30.
[2] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA: Cancer J Clin,2016,66(2):115-132.
[3] Wang XN,Liang H. Some problems in the surgical treatment of gastric cancer[J]. Chin J Cancer,2010,29(4):369-373.
[4] Ponting CP,Oliver PL,Reik W. Evolution and functions of long noncoding RNAs[J]. Cell,2009,136(4):629-641.
[5] Schmitz SU,Grote P,Herrmann BG. Mechanisms of long noncoding RNA function in development and disease[J]. Cell Mol Life Sci,2016,73(13):2491-2509.
[6] Batista PJ,Chang HY. Long noncoding RNAs: cellular address codes in development and disease[J]. Cell,2013,152(6):1298-1307.
[7] Khalil AM,Guttman M,Huarte M,et al. Many human large intergenic noncoding RNAs associate with chromatin-modifying complexes and affect gene expression[J]. Proc Nat Acad Sci U S A,2009,106(28):11667-11672.
[8] Hou XL,Ji CD,Tang J,et al. FPR2 promotes invasion and metastasis of gastric cancer cells and predicts theprognosis of patients[J]. Sci Rep,2017,7(1):3153.
[9] Kung JT,Colognori D,Lee JT. Long noncoding RNAs: past,present,and future[J]. Genetics,2013,193(3):651-669.
[10] Thai P,Statt S,Chen CH,et al. Characterization of a novel long noncoding RNA,SCAL1,induced by cigarette smoke and elevated in lung cancer cell lines[J]. Am J Respir Cell Mol Biol,2013,49(2):204-211.
[11] Sun Y,Jin SD,Zhu Q,et al. Long non-coding RNA LUCAT1 is associated with poor prognosis in human non-small lung cancer and regulates cell proliferation via epigenetically repressing p21 and p57 expression[J]. Oncotarget,2017,8(17):28297-28311.
[12] Zheng ZG,Xu H,Suo SS,et al. The essential role of H19 contributing to cisplatin resistance by regulating glutathione metabolism in high-grade serous ovarian cancer[J]. Sci Rep,2016(6):26093.
[13] Yoon JH,You BH,Park CH,et al. The long noncoding RNA LUCAT1 promotes tumorigenesis by controlling ubiquitination and stability of DNA methyltransferase 1 in esophageal squamous cell carcinoma[J]. Cancer Letters,2018(417):47-57.
[14] Han Z,Shi L. Long non-coding RNA LUCAT1 modulates methotrexate resistance in osteosarcoma via miR-200c/ABCB1 axis[J]. Biochem Biophysi Res Commun,2018,495(1):947-953.
[15] de Paulis A,Prevete N,Rossi FW,et al. Helicobacter pylori Hp(2-20) promotes migration and proliferation of gastric epithelial cells by interacting with formyl peptide receptors in vitro and accelerates gastric mucosal healing in vivo[J]. J Immun,2009,183(6):3761-3769.
[16] Reddy KB,Nabha SM,Atanaskova N. Role of MAP kinase in tumor progression and invasion[J]. Cancer Metastasis Rev,2003,22(4):395-403.
[17] Coffelt SB,Tomchuck SL,Zwezdaryk KJ,et al. Leucine leucine-37 uses formyl peptide receptor-like 1 to activate signal transduction pathways,stimulate oncogenic gene expression,and enhance the invasiveness of ovarian cancer cells[J]. Mol Cancer Res,2009,7(6):907-915.
