红三叶根际促生菌中具生防效果菌株筛选、鉴定及特性研究
2018-06-19李海云荣良燕马亚春张惠荣罗慧琴李政璇高亚敏张建贵
李海云,姚 拓*,张 榕,荣良燕,,马亚春,张惠荣,罗慧琴,李政璇,高亚敏,张建贵
(1 甘肃农业大学草业学院,甘肃兰州 730070;2 甘肃省草原技术推广总站,甘肃兰州 730010;3 甘肃省农牧厅外资项目管理办公室,甘肃兰州 730030)
在农业生产中,作物病虫害主要依靠化学农药进行防治,但由此造成的病原菌和害虫的抗药性以及土壤和作物中的农药残留,给人类健康和生态环境造成了严重的危害。近年来,生物防治以其无毒害、不污染环境、不易引起抗药性等特点备受世界各国的广泛关注,许多生防菌剂已成功地应用于农业生产中[1–4]。与此同时,利用微生物进行土壤修复的研究也取得了很大的进展[5]。目前研究报道的生防菌主要包括:恶臭假单胞菌 (Pseudomonas putida)、铜绿假单胞菌 (Pseudomonas aeruginosa)[6]、荧光假单胞菌 (Pseudomonas fluorescens)[7,8]、波纹假单胞菌(Pseudomonas corrugata)[9]、欧文氏菌 (Erwinia chrysantemi)[10]、丁香假单胞菌 (Pseudomonas syringae)[11]、洋葱伯克霍尔德菌 (Burkholderia cepacia)[12]、肠道沙门氏菌 (Salmonella enterica) 等[13]。针对不同生防菌的生防机理开展了大量研究。Helmy等[14]研究发现,从荧光假单胞菌 (Pseudomonas fluorescens) 等分离纯化获得的嗜铁素可以有效抑制黑曲霉 (Aspergillus niger)、烟草赤星病菌 (Alternaria alternata)、黄曲霉 (Aspergillus flavus)、尖孢镰刀菌(Fusarium oxysporum) 等病原菌的生长[15]。此外,植物根际促生菌还可利用抗生素诱导植物产生系统抗性来拮抗病原微生物。
2015年国家农业部明确提出了“一控、两减、三基本”的目标来治理农村环境污染等突出问题。其中“两减”是指把化肥、农药的施用总量减下来。岷山红三叶病害前期防治依靠大量农药的施用,不但使病原菌产生抗药性,而且造成严重的环境污染,同时也严重影响了岷山红三叶的药用价值,因此,本研究旨在通过前期研究从岷山红三叶根际分离筛选出的109株优良促生菌株为供试菌株,从中筛选出具有生防能力的菌种资源并研究其生防特性,为制备促生、生防复合生物菌肥提供菌种资源和科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 本课题组前期从岷山红三叶根际分离的根际促生菌 (固氮、溶磷和分泌IAA) 109株,菌株编号为MHS1~MHS109。
1.1.2 供试病原菌 3种植物病原菌分别为:立枯丝核菌 (Rhizoctonia solani)、黄瓜枯萎菌 (Fusarium oxysporium f. sp. cucumerinum),西瓜尖镰孢菌(Fusarium oxysporum f. niveum)。
1.1.3 培养基 1) 铬天青 (CAS) 培养基:菌株分泌铁载体能力测定采用CAS培养基[16],其成分为:CAS 0.02515 g,氯化铁 0.0027 g,十六烷基三甲基溴化铵(CTMAB) 0.1456 g,补加蒸馏水至0.1 L。
2) SA液体培养基:铁载体定量使用SA液体培养基,具体配方为蔗糖 20.0 g、L-天门冬酰氨2.0 g、KH2PO40.5 g、MgSO4·7H2O 0.5 g、补加蒸馏水至1 L、调节pH为7.0。
3) PDA培养基:马铃薯 200 g、葡萄糖 20 g、琼脂20 g、补加蒸馏水至1 L。
1.2 试验方法
1.2.1 优良生防菌株初筛 采用平板对峙法筛选优良生防菌株。供试菌株经LB平板培养基活化并接种至LB液体培养基,28℃ 150 r/min振荡培养3 d。同时将3种病原真菌活化后接种至PDA平板培养基,28℃培养6 d。并将培养好的病原真菌制成直径5 mm菌饼,接种至PDA培养基中心,同时将供试菌株发酵液接种于PDA培养基,接种位置距培养皿中心点2 cm。接种后,在25℃培养箱中培养6 d,测定3株病原真菌在PDA培养基上的菌落半径 (对照菌落半径) 和病原真菌距离生防菌近端半径 (处理菌落半径),将有拮抗能力的菌株斜面保存。
抑菌率 (%) = (对照菌落直径 – 处理菌落直径)/对照菌落直径 × 100
1.2.2 生防菌发酵液对病原菌拮抗性测定 将初筛生防菌株活化接种至LB液体培养基,在28℃ 150 r/min振荡培养2~3 d后,将菌悬液在10000 g离心20 min,用无菌过滤器 (0.22 μm) 过滤上清液2~3次,在4℃条件下保存。制备PDA平板培养基时,将其与发酵液混合均匀 (配比为9∶1),设不加发酵液为对照。在PDA培养基中心接种病原菌菌饼,接种后,在28℃培养箱中培养7 d。培养期间观察各病原真菌的生长状况,并测量病原真菌形成的菌落大小,计算抑菌率并筛选优良生防菌株进行保存。
1.2.3 生防菌对病原菌菌丝生长的影响 将经过生防菌发酵液处理的病原菌及对照组培养皿置于40 × 光学显微镜下,观察菌落边缘菌丝生长情况,记录并拍照。
1.2.4 生防菌产铁载体能力测定 1) 定性测定 将上述筛选出的生防菌,采用平板划线接种到LB培养基上,28℃培养2 d。培养结束后,将各单菌株分别接种到CAS平板上,在28℃条件下培养6 d。观察并记录菌落及透明圈大小、显色结果以及可溶性指数初步定性判断菌株的产铁载体能力。
2) 定量测定 将活化单菌株接种至SA液体培养基,以不接菌为对照。在28℃ 150 r/min下振荡培养2 d。培养结束后在4℃ 8000 g离心20 min,准确吸取10 mL上清液,加入到10 mL CAS检测液,混合均匀静置1 h。测定其吸光值 (As630)。铁载体活性单位为 (Ar – As)/Ar × 100,其中,Ar为对照组吸光值。
1.2.5 菌株鉴定 将上述筛选的优良生防菌株进行活化,接种于LB液体培养基中,在28℃ 150 r/min条件下培养24 h。培养结束后,在4℃ 10000 r/min离心1 min,弃上清液收集菌体沉淀。采用细菌基因组DNA提取试剂盒提取细菌总DNA,利用细菌通用引物27F,1492R进行16S rRNA基因序列的扩增。反应体系 (50 μL):25 μL 2 × Taq PCR MasterMix,2 μL DNA 模板,引物各 2 μL,19 μL ddH2O。PCR 扩增参数为:预变性 (95℃,5 min),变性 (95℃,30 s),退火 (57℃,60 s),延伸 (72℃,30 s),重复循环30次,总延伸 (72℃,10 min),保存在–20℃待用。序列测定由上海生物工程技术有限公司完成。测序后将16S rRNA基因序列采用EzBioCloud(http://www.ezbiocloud.net) 数据库进行同源性序列比对,采用MEGA5.0软件中的Neighbor-Joining方法构建菌株系统发育树,自展值为1000次。
1.3 数据处理
采用SPSS 19.0软件对试验数据进行单因素分析,采用Duncan氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 生防菌株初筛结果
研究发现,有8株供试生防菌株对3株供试病原菌具有拮抗作用 (表1)。其中,在培养第3 d时,对立枯丝核菌有抑制作用的菌株为MHS3、MHS27、MHS31和MHS39,抑菌率分别是10.1%、43.5%、35.3%和25.4%;对黄瓜枯萎菌有抑制作用的菌株为MHS3、MHS7、MHS38和MHS48,抑菌率在21.0%~40.7%之间,其中MHS7的抑菌率最高;对西瓜尖镰孢菌有抑制作用的菌株为MHS31,MHS27,MHS9和MHS48,抑菌率分别为36.3%、35.6%、30.5%和22.8%。在培养第6 d时,生防菌对3种病原真菌的抑菌率有所提高,如菌株MHS7对黄瓜枯萎菌的抑菌率增长了33.1个百分点,但对其他两种病原真菌没有抑制作用。菌株MHS27、MHS31对立枯丝核菌的抑制率分别达到64.3%、71.2%,对西瓜尖镰孢菌的抑制率分别达到了81.7%、64.5%。综上,菌株MHS3、MHS7、MHS27、MHS31和MHS48对3种病原真菌的拮抗效果较好,故作为下一步研究的供试菌株。
2.2 生防菌发酵液对病原菌的拮抗效果
从表2可以看出,在培养3 d时,菌株MHS7、MHS27和MHS31发酵液对立枯丝核菌有抑制作用,MHS7的抑菌率最低 (8.2%);在培养6 d时,菌株MHS27和MHS31对立枯丝核菌有抑制作用,抑菌率分别为40.1%、47.1%。此外,菌株MHS3在平板对峙试验中表现出拮抗立枯丝核菌,但其发酵液无抑菌作用,说明MHS3抑制该病原真菌的作用机理不是其分泌物,而是需要活体细菌参与。在培养3 d时,菌株MHS7和MHS48发酵液对黄瓜枯萎菌有抑制作用,抑菌率分别为22.4%、25.0%;培养6 d时,抑菌率分别为26.1%、22.8%。在平板对峙试验中表现出拮抗黄瓜枯萎菌的菌株MHS3和MHS38,其发酵液对病原菌没有明显的抑菌作用。菌株MHS3、MHS7、MHS48发酵液对西瓜尖镰孢菌没有抑制作用。综上可知,生防菌株MHS7、MHS48对黄瓜枯萎菌和菌株MHS27、MHS31对立枯丝核菌和西瓜尖镰孢菌的拮抗作用可能与其产生的分泌物及次生代谢产物有关。
2.3 生防菌对病原菌菌丝生长的影响
通过显微镜观察病原菌菌丝生长情况发现,生防菌MHS7能使黄瓜枯萎菌的菌丝生长混乱,MHS27和MHS31能使立枯丝核菌和西瓜尖镰孢菌的菌丝发生变化 (图1)。其中,被菌株MHS7抑制的黄瓜枯萎菌菌丝畸形肿胀,生长杂乱;经过菌株MHS27处理的西瓜尖镰孢菌菌丝扭曲和缠绕,细胞壁变薄和破裂,并有溶解的趋势,细胞质溢出(图1-B);菌株MHS31使立枯丝核菌丝发生扭曲,生长杂乱,菌丝细胞内的原生质溢出,细胞内含物稀少 (图1-D)。所有对照组病原菌的菌丝生长规则,表面光滑,菌丝细胞壁完好,细胞质均匀分布(图 1-A、1-C)。
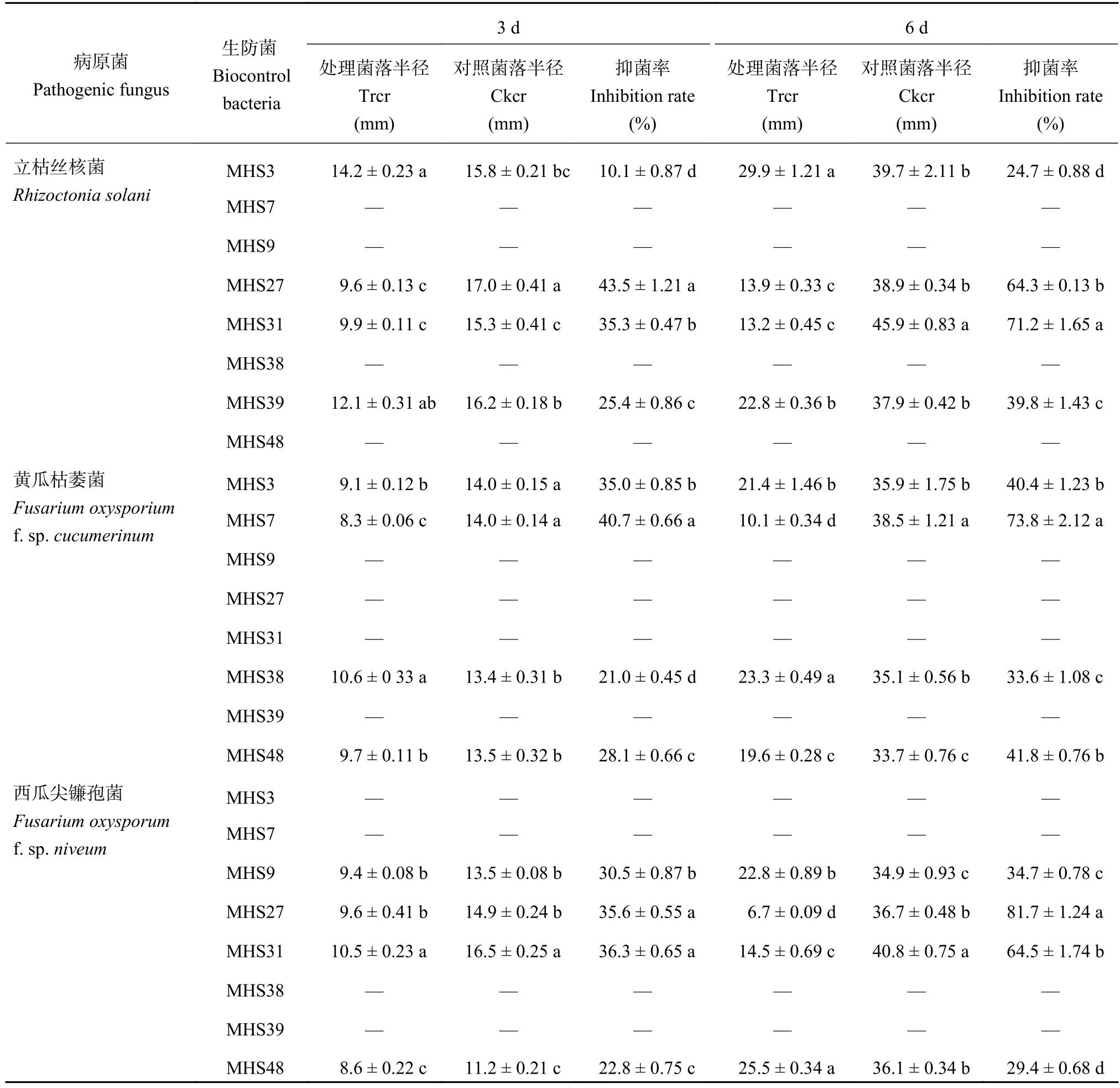
表 1 生防菌培养3 d和6 d对病原菌的拮抗效果Table 1 Antagonistic effect of the biocontrol bacteria on pathogenic fungus on the 3rd and 6th days
2.4 生防菌产铁载体能力测定
2.4.1 生防菌产铁载体定性检测 通过测定8株生防菌株在CAS检测平板上形成的菌落及周围晕圈大小、显色结果 (表3),表明在CAS检测平板上正常生长且形成桔黄色晕圈的菌株有4株,分别是菌株MHS7、MHS27、MHS31和MHS48。其中,晕圈直径大于8 mm的菌株有MHS7、MHS27和MHS31。菌株MHS7晕圈最大 (9.63 mm),其次为菌株MHS27 (9.00 mm),菌株MHS31为8.84 mm。4株生防菌株可溶性指数分别是3.68、3.00、2.46和2.04(数值越大表示菌株分泌的铁载体在培养基上的分布范围就越大,在相同培养条件和时间内,该菌株的产铁载体能力越强)。本研究中产铁载体能力由强到弱的生防菌依次为:MHS7 (3.68) > MHS27 (3.00) >MHS31 (2.46) > MHS48 (2.04)。其余 4株生防菌(MHS3、MHS9、MHS38和MHS39) 在平板对峙试验中能够拮抗病原真菌,但却在CAS检测平板上不产生桔黄色晕圈,即不产生铁载体。
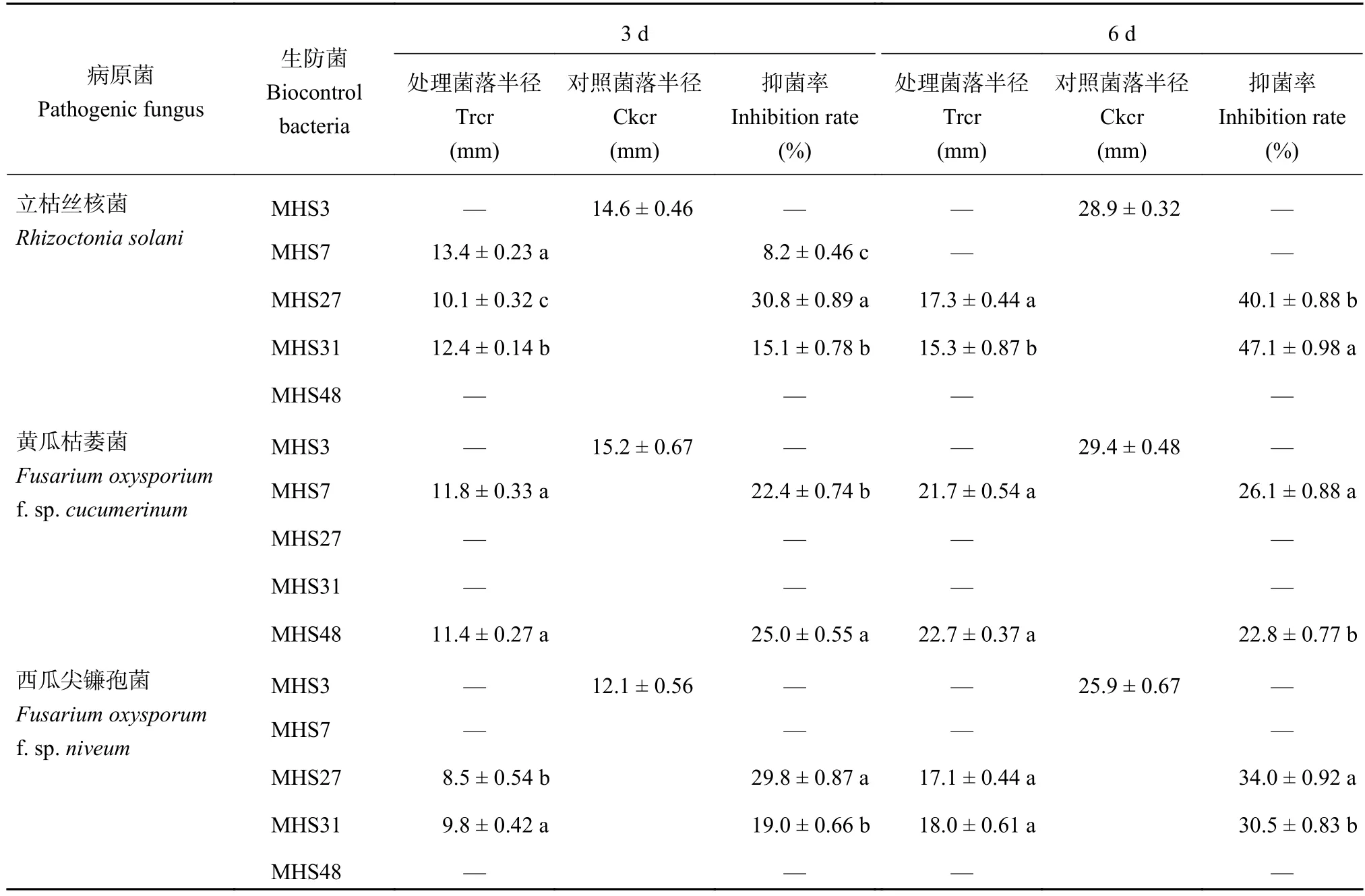
表 2 生防菌发酵液对病原菌的拮抗效果Table 2 Antagonistic effect of the biocontrol bacteria fermentation broth on pathogenic fungus

图 1 生防菌发酵液对病原菌菌丝生长的影响Fig. 1 Effect of biocontrol bacteria fermentation broth on mycelial growth of the pathogenic fungus
2.4.2 生防菌产铁载体定量测定 为准确测定供试菌株的产生铁载体能力,本研究对8株生防菌株进行了定量测试 (表4)。通过定量分析测出各菌株在630nm处的吸光度值,并计算出铁载体活性单位。从表4可以看出,菌株MHS7、MHS27、MHS31和MHS48具有较强的分泌铁载体能力,铁载体活性大小与定性测定结果相同。其它供试菌株在630 nm处的吸光度值 (As) 小于CK (Ar),即表现为产生铁载体能力相对较差或不产生铁载体。
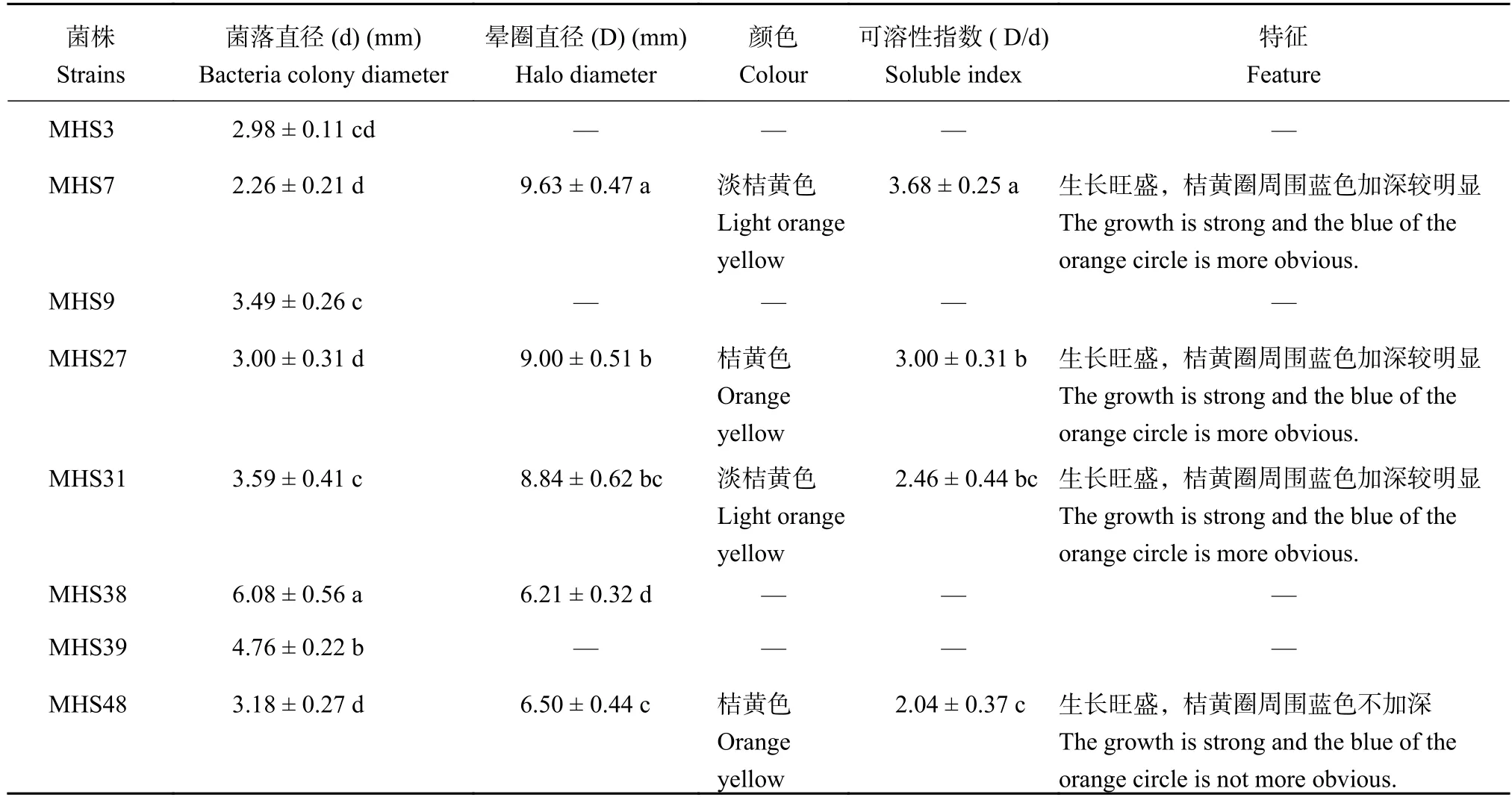
表 3 生防菌产铁载体能力测定Table 3 The siderophore producing capacity of biocontrol bacteria
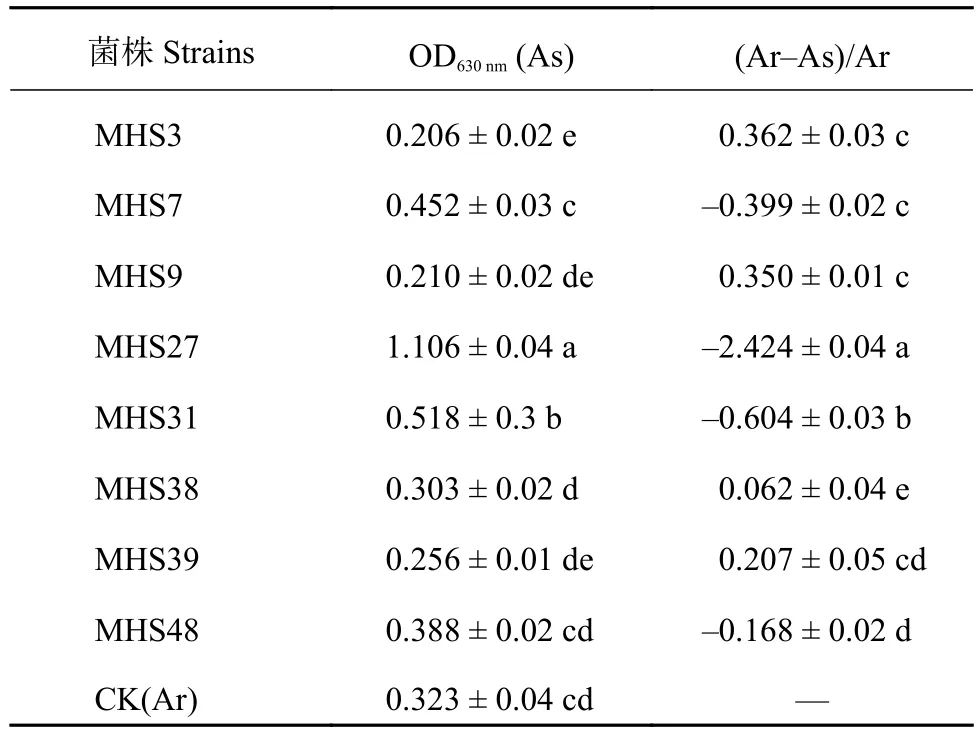
表 4 生防菌产铁载体量Table 4 Amounts of siderophore production from bio-control bacteria
2.5 优良生防菌株鉴定
本研究对4株优良生防菌株进行16S rRNA基因序列分析并构建系统发育树 (图2)。菌株MHS7与特基拉芽孢杆菌 (AYTO01000043) 的相似性为99.73%,初步鉴定为特基拉芽孢杆菌 (Bacillus tequilensis);菌株MHS27与溶蛋白芽孢杆菌(KJ812418) 的相似性为99.56%,初步鉴定为溶蛋白芽孢杆菌 (Bacillus proteolyticus);菌株MHS31与Pseudomonas paralactis (KP756923) 的相似性为99.93%,初步鉴定为Pseudomonas paralactis;菌株MHS48与克雷伯氏菌 (AB004754) 的相似性为99.08%,初步鉴定为克雷伯氏菌 (Klebsiella oxytoca)。
3 讨论
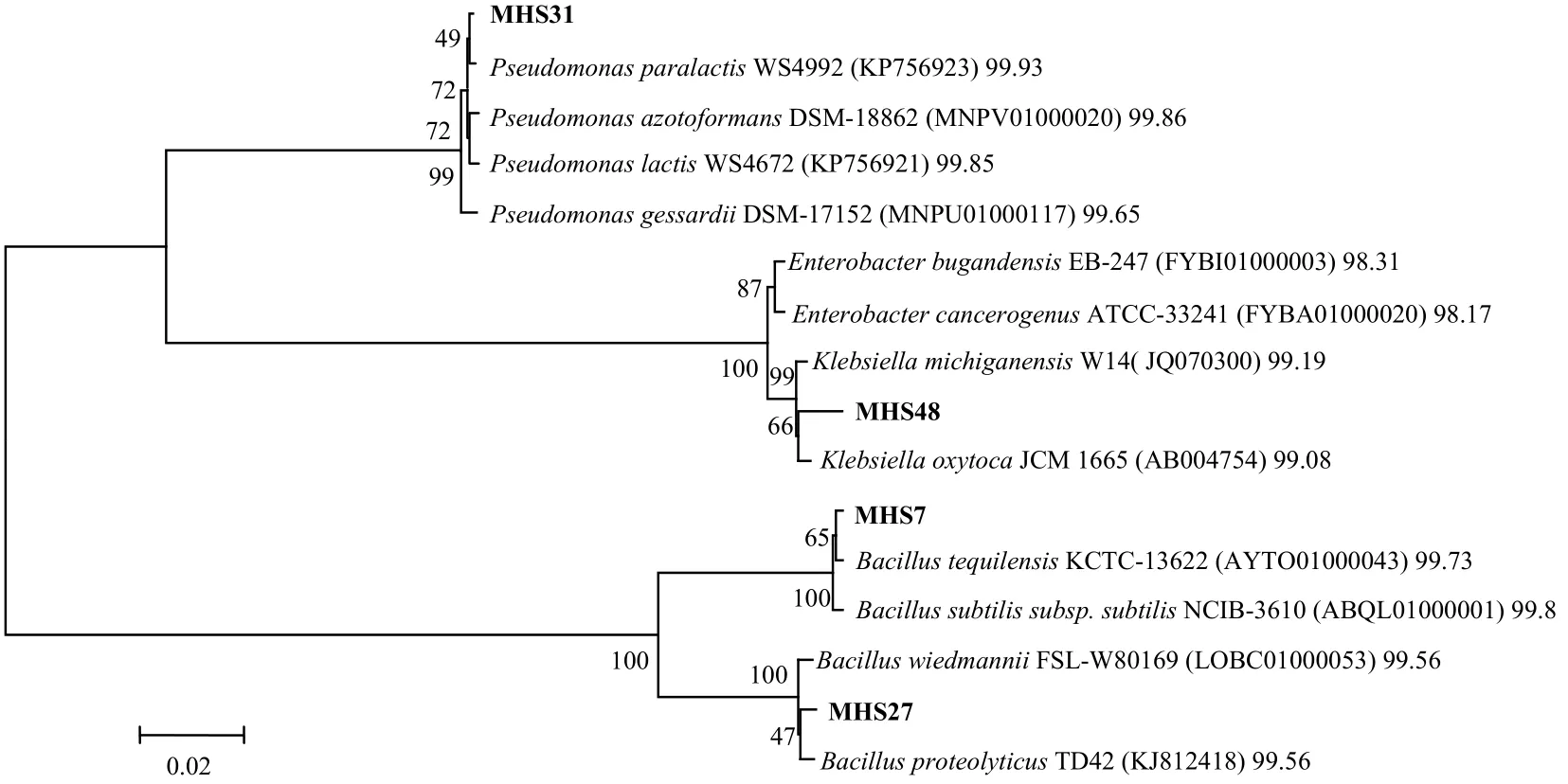
图 2 基于16S rRNA基因序列同源性构建的优良生防菌株的系统发育树Fig. 2 Phylogenetic tree of excellent bio-control bacteria based on the 16S rRNA gene sequences homology
植物根际不同生防菌种对植物病害的生防机制各不相同,主要作用机制有营养和空间位点的竞争、分泌抗菌物质、寄生和诱导植物体抗性等。本研究通过测定生防菌株发酵液对病原菌的抑制作用和产铁载体能力,发现生防菌株MHS7、MHS48发酵液对黄瓜枯萎菌,菌株MHS27、MHS31发酵液对立枯丝核菌和西瓜尖镰孢菌具有拮抗作用。孙广正等[17–19]研究发现,生防菌LHS11使番茄早疫病菌菌丝膨大变粗,菌株FX2使病原菌菌丝中膨大出球形节点,有些细胞中看不到细胞质,仅剩细胞壁,对西葫芦根腐病拮抗病原菌进行筛选,发现菌株LHS11使尖孢镰刀菌菌丝扭曲、肿胀,随着时间的延长,菌丝细胞壁溶解出现断裂;菌株FX2和FX1使菌丝扭曲缠绕,局部变形。韩立荣等[20]研究发现11-3-1菌株对油菜菌核病菌菌丝生长有明显影响,可致使油菜菌核病菌菌丝体畸形、扭曲和原生质浓缩外渗等。说明这些菌株是通过营养竞争和空间位点竞争、诱导系统抗性等其他方式抑制病原菌菌丝的生长。赵帅等[21]研究发现,菌株HD-087所产生的抗菌物质能使黄瓜枯萎病病原菌菌丝畸形、分生孢子萌发受到抑制,抑制率可达72.1%。通过定性、定量测定生防菌株产铁载体能力,生防菌株MHS7、MHS27、MHS31分别对黄瓜枯萎菌(Fusarium oxysporium f. sp. cucumerinum)、西瓜尖镰孢菌 (Fusarium oxysporum f. sp. niveum)、立枯丝核菌(Rhizoctonia solani) 具有一定的生防作用。这3种促生菌都具备较好的产铁载体性能,可见,产铁载体是岷山红三叶根际促生菌 (MHS7、MHS27、MHS31)拮抗上述3种病原真菌的主要原因之一。Helmy等[14]从荧光假单胞菌 (P. fluorescens)、铜绿假单胞菌 (P.aeruginosa) 等菌株分离纯化的嗜铁素可以抑制黑曲霉 (Aspergillus niger)、欧文氏病菌 (Erwinia carotovora)、烟草赤星病菌 (Alternaria alternata)、黄曲霉 (Aspergillus flavus)、尖孢镰刀菌 (Fusarium oxysporum) 等病原菌的生长[15]。林超等[22]将产铁载体的洋葱伯克霍尔德氏菌 (Burkholderia cepacia) 接种至芒果,其炭疽病发病率降低了14%。近年来研究表明,生防菌产生的次级代谢产物对防控植物病害也有一定的作用。其中,报道较多的有荧光假单胞菌,它可以产生胞外壳聚糖酶、溶菌酶、几丁质酶、木聚糖酶等[23-24],通过这些次生代谢产物可以有效控制植物病害。为了证明次生代谢产物的生防途径,研究学者利用基因控制技术,将合成次生代谢产物的前体物质进行基因突变,发现合成次生代谢产物的功能缺失之后,防病能力明显下降,经分离纯化的次生代谢产物可以诱导植物产生抗病性[22]。综上,不同生防菌的生防途径和生防机理存在多样性,即使是同一种生防菌在不同植物上也会产生不同的作用效果。植物病害生物防治从室内到田间还存在很大的差距,本研究筛选的具有生防效果的促生菌株的生防机理和田间防治效果尚需进一步研究和分析。
4 结论
从岷山红三叶根际促生菌中筛选出8株对立枯丝核菌、黄瓜枯萎菌和西瓜尖镰孢菌具有拮抗效果的菌株,即菌株MHS3、MHS7、MHS9、MHS27、MHS31、MHS38、MHS39和MHS48。生防菌株MHS7、MHS48发酵液对黄瓜枯萎菌,菌株MHS27、MHS31发酵液对立枯丝核菌和西瓜尖镰孢菌具有拮抗作用。产嗜铁素是生防菌 (MHS7、MHS27、MHS31、MHS48) 拮抗立枯丝核菌、黄瓜枯萎菌和西瓜尖镰孢菌的主要途径之一。经16S rRNA基因序列分析初步鉴定:菌株MHS7为特基拉芽孢杆菌 (Bacillus tequilensis),菌株MHS27为溶蛋白芽孢杆菌 (Bacillus proteolyticus),菌株MHS31为Pseudomonas paralactis,菌株MHS48为克雷伯氏菌(Klebsiella oxytoca)。
[1]Baker K F. Evolving concepts of biological control of plant pathogens[J]. Annual Review of Phytopathology, 1987, 25(1): 67–85.
[2]Ryu C M, Kim J, Choi O, et al. Improvement of biological control capacity of Paenibacillus polymyxa E681 by seed pelleting on sesame[J]. Biological Control, 2006, 39(3): 282–289.
[3]Compant S, Clement C, Sessitsch A. Plant growth-promoting bacteria in the rhizo and endosphere of plants: their role, colonization,mechanisms involved and prospects for utilization[J]. Soil Biology &Biochemistry, 2010, 42(5): 669–678.
[4]Compant S, Duffy B, Nowak J, et al. Use of plant growth-promoting bacteria for biocontrol of plant diseases: Principles, mechanisms of action, and future prospects[J]. Applied and Environmental Microbiology, 2005, 71(9): 4951–4959.
[5]Singh B K, Walker A, Morgan J A, et al. Effects of soil pH on the biodegradation of chlorpyrifos and isolation of a chlorpyrifosdegrading bacterium[J]. Applied and Environmental Microbiology,2003, 69(9): 5198–5206.
[6]Britigan B E, Rasmussen G T, Cox C D. Augmentation of oxidant injury to human pulmon-ary epithelial cells by the Pseudomonas aeruginosa siderophore pyochelin[J]. Infection and Immunity, 1997,65(3): 1071–1076.
[7]Matthijs S, Tehrani K A, Laus G, et al. Thioquinolobactin, a Pseudomonas siderophore with antifungal and anti-Pythium activity[J]. Environmental Microbiology, 2007, 9(2): 425–434.
[8]Youard Z A, Mislin G L, Majcherczyk P A, et al. Pseudomonas fluorescens CHA0 produces enantio-pyochelin, the optical antipode of the Pseudomonas aeruginosa siderophore pyochelin[J]. Journal of Biological Chemistry, 2007, 282(49): 35546–35553.
[9]Matthijs S, Budzikiewicz H, Schafer M, et al. Ornicorrugatin, a new siderophore from Pseudomonas fluorescens AF76[J]. Zeitschrift Naturforschung, 2008, 63(11): 8–12.
[10]Franza T, Mahé B, Expert D. Erwinia chrysanthemi requires a second iron transport route dependent of the siderophore achromobactin for extracellular growth and plant infection[J]. Molecular Microbiology,2005, 55(1): 261–275.
[11]Jones A M, Lindow S E, Wildermuth M C. Salicylic acid,yersiniabactin, and pyoverdin production by the model phytopathogen Pseudomonas syringae pv. tomato DC3000: synthesis,regulation, and impact on tomato and Arabidopsis host plants[J].Journal of Bacteriology, 2007, 189(19): 6773–6786.
[12]Sun G X, Zhou W Q, Zhong J J. Organotin decomposition by pyochelin, secreted by Pseudomonas aeruginosa even in an ironsufficient environment[J]. Applied and Environmental Microbiology,2006, 72(9): 6411–6413.
[13]Petermann S R, Sherwood J S, Logue C M. The Yersinia high pathogenicity island is present in Salmonella enterica Subspecies I isolated from turkeys[J]. Microbial Pathogenesis, 2008, 45(2):110–114.
[14]Helmy M, Baddar D, Masry M H. Affinity purification of a siderophore that exhibits an antagonistic effect against soft rot bacterium[J]. Biochemistry (Moscow), 2008, 73(7): 776–782.
[15]Sayyed R, Chincholkar S. Siderophore-producing Alcaligenes feacalis exhibited more biocontrol potential Vis-à-Vis chemical fungicide[J]. Current Microbiology, 2009, 58(1): 47–51.
[16]Schwyn B, Neilands J B. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987,160(1): 47–56.
[17]孙广正, 侯栋, 岳宏忠, 等. 番茄早疫病菌拮抗细菌的筛选及其抑制作用[J]. 草原与草坪, 2015, 35(1): 32–36, 43.Sun G Z, Hou D, Yue H Z, et al. Screening of bacteria antagonizing Alternaria solani and its inhibitory effects[J]. Grassland and Turf,2015, 35(1): 32–36, 43.
[18]孙广正, 姚拓, 侯栋, 等. 西葫芦根腐病菌拮抗细菌的防病促生作用[J]. 微生物学通报, 2017, 44(5): 1121–1130.Sun G Z, Yao T, Hou D, et al. Biocontrol potential of antagonistic bacteria strains against Fusarium oxysporum and their growthpromoting effects on zucchini[J]. Microbiology China, 2017, 44(5):1121–1130.
[19]Sun G Z, Yao T, Feng C J, et al. Identification and biocontrol potential of antagonistic bacteria strains against Sclerotinia sclerotinia and their growth-promoting effects on Brassia napus[J].Biological Control, 2017, 104: 35–43.
[20]韩立荣, 张华姣, 高保卫, 等. 放线菌11-3-1对油菜菌核病的防治作用与菌株鉴定[J]. 植物保护学报, 2012, 39(2): 97–102.Han L R, Zhang H J, Gao B W, et al. Antifungal activity against rapeseed Sclerotinia stem rot and identification of actinomycete strain 11-3-1[J]. Journal of Plant Protection, 2012, 39(2): 97–102.
[21]赵帅, 田长彦, 史应武, 等. 黄瓜枯萎病拮抗菌HD-087产抗菌物质条件的优化及抑菌作用初探[J]. 微生物学通报, 2013, 40(5):802–811.Zhao S, Tian C Y, Shi Y W, et al. Fermentation conditions for the biocontrol strain HD-087 against cucumber Fusarium wilt and its antibacterial effect[J]. Microbiology China, 2013, 40(5): 802–811.
[22]林超, 郑服丛, 贺春萍, 等. 嗜铁细菌C19对黄瓜种子发芽的影响及对芒果炭疽病生防效果初步评价[J]. 中国农学通报, 2009, 25(9):232–235.Lin C, Zheng F C, He C P, et al. The effect of siderophore-producing bacteria C19 on cucumber seed germination and biocontrol effects on mango anthracnose[J]. Chinese Agricultural Science Bulletin, 2009,25(9): 232–235.
[23]Sajeli B A, Basha S A, Raghavendra G, et al. Isolation and characterization of antimicrobial cyclic dipeptides from Pseudomonas fluorescens and their efficacy on sorghum grain mold fungi[J].Chemistry and Biodiversity, 2014, 11(1): 92–100.
[24]Yang M M, Wen S S, Mavrodi D V, et al. Biological control of wheat root diseases by the CLP-producing strain Pseudomonas fluorescens HC1-07[J]. Phytopathology, 2014, 104(3): 248–256.
