晚期糖基化终末产物对卵巢原始卵泡的影响
2018-06-14朱楠黄小圆李金晶葛红山
朱楠,黄小圆,李金晶,葛红山,2*
(1.温州医科大学第二临床医学院,温州 325000;2.泰州市人民医院,泰州 225300)
随着二胎政策的全面开放,女性生育年龄普遍推迟。研究表明,女性生育能力在经历21~25岁的生育高峰后,开始逐渐下降,至35岁后发生急剧下降[1]。卵巢作为一种长寿命组织,其衰老的发生早于机体的衰老。卵巢衰老引起的女性不孕及内分泌紊乱等问题已成为影响女性生活质量的重要因素。卵巢衰老主要表现为卵泡数目的减少和卵母细胞质量的下降[2]。作为卵巢中数量最多的卵泡,原始卵泡的激活贯穿于整个生育阶段,且直接影响卵泡的数量,是决定卵巢储备能力的重要因素[3]。原始卵泡处于减数分裂前期的双线期,它由单层扁平的颗粒细胞包绕初级卵母细胞而形成[3]。1992年,Hirshfield[4]提出将原始卵泡分为“第一波原始卵泡”和“成年原始卵泡”,前者位于卵巢髓质部,形成后立即启动;后者位于卵巢皮质部,形成后一直保持静息状态,成年期开始分批启动。目前这一观点被越来越多实验结果所支持。
卵巢衰老的具体机制目前尚不明确。最近的研究认为,晚期糖基化终末产物(AGEs)与卵巢衰老密切相关[5]。AGEs是对非酶糖基化反应(Mailland反应)终末产物的总称,在人体的长寿命组织和器官中发生增龄性积累,与蛋白直接交联引起相关蛋白的变性失活,同时还可与AGEs受体(RAGE)结合形成AGEs-RAGE轴介导细胞氧化应激和羰基应激,是研究衰老的重要指标之一[6]。研究表明,AGEs引起的损伤对配子的形成、胚胎着床、胚胎发育等人类各个生殖阶段均产生重要的影响[7],即AGEs在卵巢中堆积会加速卵巢衰老的发生[8]。本实验主要研究AGEs是否会通过影响原始卵泡激活从而引起卵巢衰老的发生。
材料与方法
一、材料和动物
1.动物:成年 ICR小鼠购自温州医科大学动物实验中心。以雄雌比例1∶2合笼,次日检查阴道栓确认妊娠,单笼饲养直至分娩获得4日龄乳鼠。
2.试剂:AGE-BSA制剂(10 mg/ml)购于美国Merck Millipore公司,培养小室购于美国Millipore公司;DEME/F12(1∶1)培养基、Albumax、青/链霉素双抗购于美国Gibco公司;L-ascorbic acid、ITS购于日本Sigma公司;牛血清白蛋白(BSA)、HE染料试剂盒、BCA试剂盒购于碧云天生物技术有限公司;兔抗RAGE多克隆抗体购于美国Abcam公司、羊抗细胞增殖核抗原(PCNA)多克隆抗体购于美国Santa cruz公司,兔抗β-actin多克隆抗体购于美国Bioworld公司,HRP标记的山羊抗兔、兔抗山羊二抗购自美国Biosharp公司;DAB显色试剂盒、兔二步法检测试剂盒、山羊超敏检测试剂盒购自中杉金桥。
二、方法
1.卵巢培养:将实验组分为空白对照组、溶剂对照组、AGE-BSA组。其中,空白对照组以DEME/F12(1∶1)为基础培养液,其内加入1‰ BSA、1‰ Albumax、0.05 mg/ml L-ascorbic acid、1%ITS和1‰青/链霉素双抗;溶剂对照组使用的培养液是在空白对照组培养液的基础上添加200 μg/ml BSA;AGE-BSA组培养液则是在空白对照组培养液的基础上将购买的10 mg/ml AGE-BSA配制成200 μg/ml AGE-BSA终浓度。取200只4日龄雌性乳鼠为实验对象,解剖显微镜下完整剥离乳鼠卵巢,将其随机转移至各组培养小室内(3颗/室),置于5%CO2、37℃培养箱内培养,隔日换半液,4 d后收集各组卵巢。
2.HE染色:各组收集的卵巢用4%多聚甲醛固定过夜(12~24 h),经脱水、透明、浸蜡、包埋后,选取最大横截面进行切片。将切片置于65℃烤箱内烘烤1 h,二甲苯脱蜡、梯度酒精(100%、95%、75%、蒸馏水)中各5 min,滴加苏木素染料浸染5 min,自来水下返蓝15 min,伊红染料浸染2 min,然后经梯度酒精脱水(95%Ⅰ、95%Ⅱ、100%)、二甲苯透明各5 min后封片;镜下计数各级卵泡数量,分析比较各组中原始卵泡和生长卵泡[9](包括初级卵泡和次级卵泡)构成比。本实验中不计数成熟卵泡和闭锁卵泡。
3.免疫蛋白印迹(Western Blot):收集各组培养4 d后的卵巢组织,每组每批使用30个卵巢,重复3次,分组分批提取总蛋白,BCA试剂盒测量各组蛋白浓度;将抽提蛋白按每孔25 μl在12% SDS-PAGE电泳,然后将分离的目的蛋白电转至PVDF膜,5%脱脂奶粉-TBST摇床上室温封闭2 h,TBST洗涤3次,每次5 min,分别加入对应的一抗[RAGE抗体(1∶1 000)、PCNA抗体(1∶1 000)、β-actin抗体(1∶2 500)]4℃摇床孵育过夜;次日,PVDF膜用TBST洗涤3次,每次5 min,分别与HRP标记的山羊抗兔IgG(1∶5 000)、兔抗山羊IgG(1∶5 000)二抗进行室温摇床孵育2 h,TBST洗涤3次,每次5 min。目的蛋白条带应用化学发光法进行检测,将每次实验中的RAGE和PCNA的灰度值与内参β-actin比较,使用Image Lab 3.0 软件进行半定量分析。
4.免疫组织化学:组织切片烤片、脱蜡、水化同前,将组织切片放入500 ml枸橼酸钠缓冲液中进行高压修复10 min;室温下自然冷却,PBS洗涤3次,每次5 min,3%H2O2室温下湿盒孵育切片组织10 min,PBS洗涤3次,每次5 min,封闭液(10%山羊血清)室温湿盒孵育20 min,甩去封闭液,滴加PCNA抗体(1∶50)4℃湿盒孵育过夜,同时设立阴性对照组即使用PBS进行孵育;次日37℃水浴箱复温30 min,PBS洗涤3次,每次5 min,使用兔二抗、山羊二抗室温孵育20 min,PBS洗涤3次,每次5 min;DAB显色液逐一镜下显色,待组织出现棕黄色后,甩去显色液,苏木素复染1 min,梯度酒精(75%、85%、95%、100%Ⅰ、100%Ⅱ)脱水、二甲苯透明各5 min,封片后镜下观察切片显色情况。
三、统计学方法

结 果
一、AGE促进原始卵泡向生长卵泡转化
为了观察AGE对原始卵泡激活的影响,本实验取每组各10张培养后的卵巢切片,分别代表每组10个不同的卵巢,通过HE染色,分别计数各组原始卵泡和生长卵泡及其占总卵泡数的比例。我们发现在空白对照组和溶剂对照组培养的卵巢在原始卵泡构成比和生长卵泡构成比中均无显著差异(F=2.898,P0.05)(表1),说明较基础培养液而言,BSA不影响卵巢卵泡的发育。而在AGE-BSA组中,生长卵泡构成比显著高于溶剂对照组,而原始卵泡构成比则显著低于溶剂对照组(F=2.776,P<0.001)(表1)。观察HE染色图我们发现,在AGE-BSA组卵巢最大横截面切片中,卵巢髓质部出现大量形态表现为原始卵泡的卵泡(图1)。

表1 各实验组的卵泡计数及卵泡构成比(-±s)
注:每组10个卵巢;与其他两组比较,*P<0.001

A:空白对照组;B:溶剂对照组;C:AGE-BSA组。图中黑色箭头示原始卵泡,红色箭头示初级卵泡,绿色箭头示次级卵泡。标尺为50 μm图1 不同处理组中卵巢卵泡的形态表现(HE染色,×200)
二、AGE促进PCNA表达
为了进一步明确原始卵泡的生长情况,我们检测了卵泡增殖相关指标PCNA的蛋白表达情况,结果发现PCNA在AGE处理组中的表达量显著增加(F=6.72,P<0.05)(图2,图3A)。同时PCNA在空白对照组和溶剂对照组中表达无显著差异(F=4.54,P0.05)(图2,图3A)。免疫组织化学实验发现PCNA表达在各级卵泡的颗粒细胞和卵母细胞中(图4)。

图2 Western Blot检测各实验组中RAGE、PCNA的蛋白表达
三、AGE促进受体RAGE的表达
为了进一步验证AGE对原始卵泡生长的作用,我们用免疫蛋白印迹法半定量检测各实验组内AGE受体RAGE的表达。结果发现,与溶剂对照组相比,RAGE在药物处理(AGE-BSA)组中的表达显著增加(F=3.24,P<0.001),说明AGE可能是通过AGE-RAGE轴引起卵巢内卵泡的变化;RAGE在空白对照组和溶剂对照组中表达无显著差异(F=3.23,P0.05)(图2,图3B)。
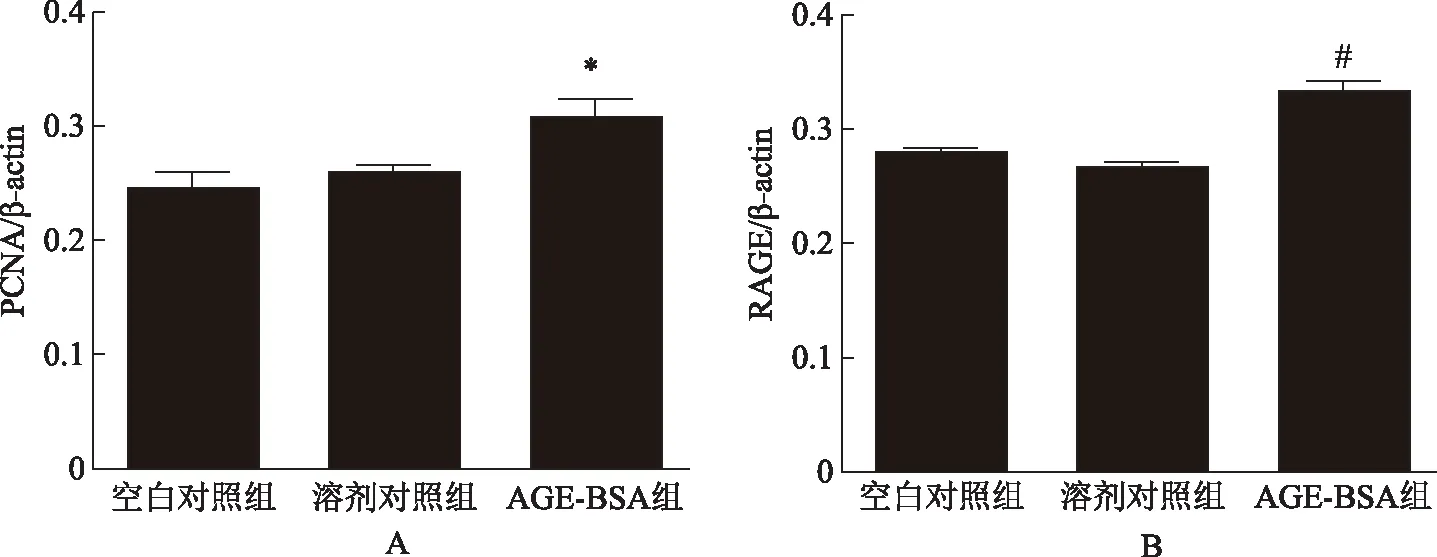
A:PCNA蛋白相对含量;B:RAGE蛋白相对含量;与溶剂对照组比较,*P<0.05,#P<0.001图3 各实验组PCNA、RAGE蛋白的相对含量

左侧为3组的低倍视野图像(×200),右侧为左侧方框区域的高倍视野(×400);图中黑色箭头所指的棕黄色部分为PCNA阳性表达部位。标尺为50 μm图4 PCNA在各实验组中的定位表达(免疫组织化学SP染色)
讨 论
近年来,由于生育年龄的普遍推迟以及一些医源性因素(如手术机械性损伤、肿瘤术后放化疗)导致的卵巢衰老所引起的女性不孕等问题被大家广泛关注。在卵巢衰老过程中,原始卵泡作为卵巢内数量最多的卵泡,其过早激活将直接导致卵泡池的提前耗竭,从而引起卵巢衰老的发生。另外,相关研究表明随着AGEs在卵巢内的增龄性积累,AGEs与原始卵泡的激活具有相关性。多项研究发现AGEs可以通过干扰卵巢颗粒细胞内PI3K/Akt信号通路,导致多囊卵巢综合征(PCOS)患者胰岛素抵抗和无排卵的发生[10-11]。而在化疗药物对卵巢衰老作用机制的研究中发现顺铂能通过激活PTEN/Akt/FOXO3信号通路,增加生长卵泡池,促进卵巢衰老的发生[12]。另外,大量研究表明,细胞内AGEs-RAGE信号通路是AGEs介导产生一系列病理反应的主要机制[13-14]。由此推测,AGE在与其受体RAGE结合后,可能通过以Akt分子为中心的信号通路激活原始卵泡,加速卵巢衰老发生。
为了验证上述猜想,本实验通过体外添加AGE-BSA制剂培养卵巢。研究发现小鼠卵巢内原始卵泡的形成开始于出生前2 d左右,持续至出生后3~4 d[15]。由此,我们选取4日龄小鼠为研究对象。基于本课题组前期研究已经证明200 μg/ml AGE-BSA能明显促进休眠期原始卵泡的激活,我们有了以下发现:经AGE-BSA处理后,生长卵泡占总卵泡数的比例显著增加,同时伴随着卵巢髓质部原始卵泡的出现。结合Hirshfield[4]提出的原始细胞二分类理论,我们猜测AGEs可能在激活皮质部原始卵泡生长的同时激活了卵巢髓质部的原始卵泡,以此耗竭卵泡池。为了进一步验证以上实验结果,我们选取了卵泡计数更为灵敏的指标——细胞增殖核抗原(PCNA)。PCNA被发现存在于多种哺乳动物的卵巢内。研究表明大鼠卵巢PCNA的表达与颗粒细胞、卵母细胞生长同步,因此,PCNA阳性表达可作为卵泡生长的标志[16]。Picut等[17]发现PCNA表达在卵巢各级卵泡的卵母细胞和颗粒细胞内,本实验结果与之一致。免疫印迹法结果表明PCNA在AGE组中高表达,这与卵泡计数中总卵泡数增加的结果一致。另外,有研究发现PCNA开始表达于DNA合成的G1晚期,S期达高峰,之后逐渐下降[18]。由此我们猜测AGEs可以使卵泡中卵母细胞和颗粒细胞处于增殖状态,从而导致其蛋白高表达。
AGEs受体有很多,RAGE作为其高亲和性受体,主要分布于外周血单核-巨噬细胞系统、血管内皮等,在正常女性卵巢颗粒细胞、卵泡内膜细胞、内皮细胞、基质细胞亦有表达[19]。研究表明,随着年龄的增大,颗粒细胞RAGE的表达也随之上升[20]。本实验中,AGE处理后RAGE的蛋白表达显著增加,进一步支持了AGE促进原始卵泡激活的实验结果。
综上,我们认为一定浓度的AGEs可能是通过促进卵巢髓质部原始卵泡的激活,耗竭卵泡池,最终引起卵巢衰老的发生。接下来,我们将进一步研究AGEs促进原始卵泡激活的分子作用机制,通过缓解原始卵泡池的消耗速度,尽可能地减缓女性由于年龄增加引起的卵巢储备功能下降的发生,为治疗由卵巢衰老引起的女性不孕等疾病提供新的思路。
【参 考 文 献】
[1] 靳松,杨业洲. 高龄妇女生育力及其评价[J]. 中国计划生育和妇产科,2016,8:1-3.
[2] Saccon TD,Moreira F,Cruz LA,et al. Ovarian aging and the activation of the primordial follicle reserve in the long-lived Ames dwarf and the short-lived bGH transgenic mice[J]. Mol Cell Endocrinol,2017,455:23-32.
[3] Kerr JB,Myers M,Anderson RA. The dynamics of the primordial follicle reserve[J]. Reproduction,2013,146:R205-R215.
[4] Hirshfield AN. Heterogeneity of cell populations that contribute to the formation of primordial follicles in rats[J].Biol Reprod,1992,47:466-472.
[5] Merhi Z. Advanced glycation end products and their relevance in female reproduction[J].Hum Reprod,2014,29:135-145.
[6] Turner DP. The role of advanced glycation end-products in cancer disparity[J].Adv Cancer Res,2017,133:1-22.
[7] Agarwal A,Gupta S,Sharma RK. Role of oxidative stress in female reproduction[J].Reprod Biol Endocrinol,2005,3:1-21.
[8] Tatone C,Amicarelli F. The aging ovary-the poor granulosa cells[J]. Fertil Steril,2013,99:12-17.
[9] Nilsson E,Parrott JA,Skinner MK. Basic fibroblast growth factor induces primordial follicle development and initiates folliculogenesis[J]. Mol Cell Endocrinol,2001,175:123-130.
[10] Diamanti-Kandarakis E,Chatzigeorgiou A,Papageorgiou E,et al. Advanced glycation end-products and insulin signaling in granulosa cells[J]. Exp Biol Med,2016,241:1438-1445.
[11] Zhang L,Bukulin M,Kojro E,et al. Receptor for advanced glycation end products is subjected to protein ectodomain shedding by metalloproteinases[J]. J Biol Chem,2008,283:35507-35516.
[12] Chang EM,Lim E,Yoon S,et al. Cisplatin induces overactivation of the dormant primordial follicle through PTEN/AKT/FOXO3a pathway which leads to loss of ovarian reserve in mice[J/OL]. PLoS One,2015,10:e0144245.
[13] Pertynska-Marczewska M,Diamanti-Kandarakis E,Zhang J,et al. Advanced glycation end products:A link between metabolic and endothelial dysfunction in polycystic ovary syndrome?[J]. Metabolism,2015,64:1564-1573.
[14] Leung SS,Forbes JM,Borg DJ. Receptor for advanced glycation end products(RAGE)in type 1diabetes pathogenesis[J]. Curr Diab Rep,2016,16:100.
[15] Durlinger AL,Gruijters MJ,Kramer P,et al.Anti-Mullerian hormone inhibits initiation of primordial follicle growth in the mouse ovary[J]. Endocrinology,2002,143:1076-1084.
[16] Muskhelishvili L,Wingard SK,Latendresse JR. Proliferating cell nuclear antigen-a marker for ovarian follicle counts[J]. Toxicol Pathol,2005,33:365-368.
[17] Picut CA,Swanson CL,Scully KL,et al. Ovarian follicle counts using proliferating cell nuclear antigen(PCNA)and semi-automated image analysis in rats[J]. Toxicol Pathol,2008,36:674-679.
[18] Ulrich HD,Takahashi T. Readers of PCNA modifications[J]. Chromosoma,2013,122:259-274.
[19] 潘晓琴,朱依敏.晚期糖基化终产物在女性生殖中的研究进展[J]. 生殖与避孕,2015,35:640-643.
[20] Stensen MH,Tanbo T,Storeng R,et al. Advanced glycation end products and their receptor contribute to ovarian ageing[J]. Hum Reprod,2014,29:125-134.
