双酶耦合催化法合成特定聚合度β-1,3-葡寡糖研究
2018-06-14贺海涛张洪涛曲娟娟郭进郑明仪蒋芸詹晓北
贺海涛,张洪涛,曲娟娟,郭进,郑明仪,蒋芸,詹晓北
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
β-1,3-葡寡糖是一类聚合度在3~10左右的低聚β-1,3-葡聚糖[1],在医药、食品、水产养殖业、农业应用、甚至在化妆品行业都得到广泛应用[2]。法国的Geomer公司成功生产出β-1,3-葡寡糖型的生物农药,其主要通过β-1,3-葡寡糖来激活植物免疫系统从而杀死致病的真菌[3]。此外,β-1,3-葡寡糖还具有抗病毒、抗过敏和调节免疫力、抑制肿瘤细胞生长的功能和潜力[4-5]。侯庆华等[6]研究发现,β-1,3-葡寡糖可以对糖尿病睾丸的损伤起到修复作用,能够提高糖尿病睾丸分泌睾酮的能力;HIDA等[7]研究发现,β-1,3-葡寡糖可诱导老鼠脾脏细胞产生粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)和干扰素-g(interferon-g,IFN-g),诱导树突状细胞产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-6(interleukin-6,IL-6);β-1,3-葡寡糖还可增加单核细胞、粒细胞和巨噬细胞的数量而减少淋巴细胞的数量,并能刺激产生细胞因子提高免疫能力等[8]。
目前β-1,3-葡寡糖的制备主要通过降解和合成两个方向得到。降解方法主要通过酸解或酶解热凝胶(一种线性的β-1,3-葡聚糖)来制备β-1,3-葡寡糖,由于热凝胶不溶于水且在水解热凝胶的过程中所生成的β-1,3-葡寡糖聚合度不可控,所以这一方法的使用具有一定的局限性。合成主要通过化学法和酶法,化学法合成步骤繁琐,且其得到的寡糖难以用于医药、食品等领域;而基于糖基转移酶的酶法寡糖合成,虽然条件温和,过程简单,但却需要昂贵的二磷酸尿苷葡糖(uridine diphosphate glucose, UDPG)作为前体物质,因此,目前酶法合成β-1,3-葡寡糖的研究主要用于实验室中寡糖的微量合成。
昆布二糖磷酸化酶(laminaribiose phosphorylase,LPase)也叫海带二糖磷酸化酶,是一种催化特异的葡萄糖基转移酶,广泛存在于眼虫纲的原生动物中,如Euglenagracilis或Astasiaocellate。且该酶可催化α-D-葡萄糖-1-磷酸(α-D-glucose-1-phosphate,G1P)与β-1,3-葡寡糖之间的可逆反应:在G1P存在的条件下可利用葡萄糖或低聚合度β-1,3-葡寡糖作为引物合成更高聚合度β-1,3-葡寡糖[9];在Pi存在的条件下可磷酸解高聚合度的β-1,3-葡寡糖生成低聚合度的β-1,3-葡寡糖和G1P[10]。
蔗糖磷酸化酶(sucrose phosphorylase,SPase)也是一种催化特异的葡萄糖基转移酶[11]。其可以将蔗糖中的葡萄糖基转移至受体生成G1P和果糖。蔗糖磷酸化酶主要分布在细菌等微生物中,少量植物中也含有该酶。现生产蔗糖磷酸化酶的主要菌株有肠膜明串菌株(Leuconostocmesenteroides)[12]、嗜糖假单胞菌(Pseudomonassaccharophila)[13]、变异链球菌(Streptococcusmutans)[14]、长双歧杆菌(Bifidobacteriumlongum)[15]、青春双歧杆菌(Bifidobacteriumadolescentis)[16]等。
KITAOKA等[17]通过蔗糖磷酸化酶、木糖异构酶和昆布二糖磷酸化酶催化合成昆布二糖,但是对更高聚合度的β-1,3-葡寡糖的合成并没有进行详细的研究,对反应时间与产物聚合度之间的关系也没有进行探索。所以本文在其研究的基础上通过蔗糖磷酸化酶和昆布二糖磷酸化酶粗酶液,以价格低廉的蔗糖和葡萄糖为初始原料,进行耦合催化生成β-1,3-葡寡糖(其耦合反应过程如图1所示),并研究催化反应的时间与产物聚合度的关系,为后续通过控制催化反应的时间来得到不同聚合度的寡糖提供理论指导。与以往的酶法合成相比,该法合成过程不需要昂贵的前体物质UDPG、腺苷三磷酸(adenosine triphosphate,ATP)和辅酶等,只需价格低廉的蔗糖和引物葡萄糖,且反应以纤细眼虫的细胞破碎液中昆布二糖磷酸化酶的粗酶液进行反应,因此大大降低了生产成本,容易实现β-1,3-葡寡糖的大规模、廉价合成。
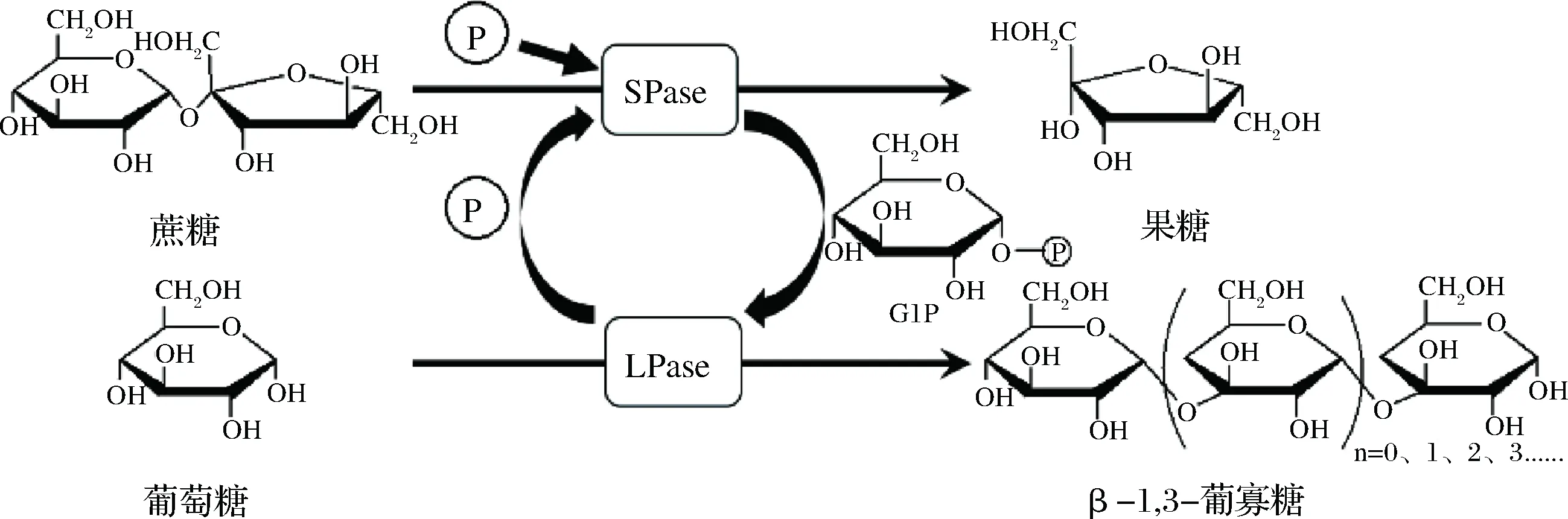
图1 β-1,3-葡寡糖的合成策略Fig.1 Reaction scheme for synthesis of β-1,3-glucooligo-saccharides
1 材料与方法
1.1 材料与试剂
纤细眼虫(Euglenagracilisstrain Z SAG Göttingen 1224-5/25),购于德国哥延根大学藻类菌种保藏中心,现保存于本实验室。
蔗糖磷酸化酶S0937,SIGMA-ALDRICH公司;α-D-葡萄糖-1-磷酸二钠(G1P),Alfa Aesar公司;葡萄糖、蔗糖、氢氧化钠、氯化镁、钼酸铵、抗坏血酸等(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
3K15型冷冻高速离心机,美国Sigma公司;LEICA S系列普通光学显微镜,德国徕卡公司;UV-1800型普通光学显微镜,上海精密仪器仪表有限公司;LC-1200型高效液相色谱,美国Agilent公司;UltrafleXtreme型基质辅助激光解吸电离飞行时间质谱,美国布鲁克·道尔顿公司;ThermoFisher LCQ fleet型电喷雾质谱仪,美国Thermo Fisher Seientific公司;Varian Unity Inova 600型核磁共振仪,美国瓦里安公司。
1.3 方法
1.3.1 纤细眼虫的培养[18]
种子培养基(g/L):醋酸钠1.0,牛肉膏1.0,胰蛋白胨2.0,酵母膏2.0。土壤浸出液体积分数为3%,25 ℃,120 r/min,12 h避光12 h见光(25 μmol/(m2·s))培养。
发酵培养基(g/L):蛋白胨5.0,酵母膏2.0,维生素B1210-6,葡萄糖15。30 ℃,120 r/min避光培养。
1.3.2 昆布二糖磷酸化酶粗酶液的制备及酶活测定
将培养5 d的种子按照5%的接种量接种到发酵培养基中,避光培养9 d,之后离心收集纤细眼虫细胞并悬浮于10 mmol/L的Tris-HCl缓冲液中(pH 7.2),超声波破碎细胞,12 000×g离心30 min,收集离心上清液作为昆布二糖磷酸化酶的粗酶液。此操作在4 ℃条件下进行。
收集离心上清液做酶活性分析,酶活的测定参照KITAOKA的方法[10],即每分钟催化反应生成1 μmol的Pi所需要的酶量定义为1个酶活单位。Pi的测定采用SAHEKI的方法[19],蛋白浓度的测定采用考马斯亮蓝法[20]。其结果如表1所示,将收集的粗酶液冷冻干燥,浓缩之后用于下一步合成反应。

表1 Euglena gracilis发酵培养时的细胞密度及培养基中昆布二糖磷酸化酶粗酶液酶活Table 1 The cell density of Euglena gracilis and the activityof laminarinase phosphorylase
1.3.3 昆布二糖磷酸化酶粗酶液催化合成β-1,3-葡寡糖
酶催化反应体系:50 mmol/L的Tris-HCl缓冲液(pH 7.0),100 mmol/L的G1P,5 mmol/L的MgCl2,50 mmol/L的葡萄糖[21],之后加入一定量的昆布二糖磷酸化酶粗酶液(0.1 U/mL)进行酶催化合成反应,反应时间0.5、4、12、24 h,以反应0 h作为对照组,之后经过基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF-MS)分析产物寡糖的聚合度分布。
1.3.4 昆布二糖磷酸化酶粗酶液和蔗糖磷酸化酶耦合催化合成β-1,3-葡寡糖
反应体系如下:100 mmol/L的磷酸缓冲液(pH 7.0)、100 mmol/L的蔗糖、50 mmol/L的葡萄糖、5 mmol/L的MgCl2[21],之后加入蔗糖磷酸化酶(0.2 U/mL)[22]和昆布二糖磷酸化酶粗酶液(0.1 U/mL),37 ℃反应,反应时间0.5、1、4、12、24 h,以反应0 h作为对照组,之后经过MALDI-TOF-MS分析产物寡糖的聚合度分布。
1.3.5 生成产物的分离纯化
(1)G1P的去除:将1.3.3已沸水浴的不同时间段的样品混合后冷冻干燥,之后加水稀释至1 mL,并过0.22 μm的水系膜,将样品加样于C18固相萃取柱中,此时滤出来的即为反应残留的G1P。再加入3 mL的去离子水进行洗柱并收集,此时收集的即为反应所生成的β-1,3-葡寡糖。按照相同的方法处理1.3.4中反应液。
(2)盐和单糖的去除:将上述收集的2管寡糖溶液分别加样于200 mg级的石墨化碳固相萃取柱中,之后各自加入6 mL的去离子水,此时流出的为盐和单糖的水溶液。待石墨化碳柱下方没有液体流出时再各自依次加入6 mL 体积分数为25%、50%和75%的乙腈进行梯度洗脱,此时收集流出的样品,每管收集的样品即为已去盐和去单糖的不同聚合度范围的β-1,3-葡寡糖,之后将收集的样品冷冻干燥之后用于后续电喷雾串联质谱(electrospray ionization tandem mass spectrometry,ESI-MS/MS)和氢核磁共振(hydrogen nuclear magnetic resonance,1H-NMR)分析。
1.3.6 昆布二糖磷酸化酶粗酶液催化葡萄糖和G1P合成β-1,3-葡寡糖的优化
KITAOKA等[10]研究发现,昆布二糖磷酸化酶在45 ℃条件下保存30 min依然具有一定的酶活。TAKANORI等[23]从莱氏无胆甾原体(Acholeplasmalaidlawii)中克隆表达了昆布二糖磷酸化酶,其在pH 5.0以上具有较高的酶活。因此本研究选择pH 7.2,37 ℃为酶催化最适的条件[10],在此条件下优化昆布二糖磷酸化酶、G1P和葡萄糖的添加量,从而得到最适的生成β-1,3-葡寡糖的催化条件。由于消耗1分子的G1P即生成1分子的Pi,所以可以通过测定反应体系中Pi的生成量来表示G1P的消耗量,可作为反应进程的指标[19]。
1.3.7 耦合催化反应体系的优化
在1.3.6优化的最适条件下引入蔗糖磷酸化酶,双酶耦合催化生成β-1,3-葡寡糖。李恬[22]等研究发现用蔗糖磷酸化酶催化蔗糖产G1P的最适条件为100 mmol/L磷酸缓冲液(pH 6.5)、蔗糖浓度100 mmol/L、温度40 ℃、蔗糖磷酸化酶4.5 U/L、反应4 h,此时G1P的得率可达76.9%。综合考虑1.3.6中昆布二糖磷酸化酶优化结果,本文选用100 mmol/L磷酸缓冲液、100 mmol/L的蔗糖、50 mmol/L的葡萄糖、5 mmol/L的MgCl2、蔗糖磷酸化酶(0.2 U/mL),昆布二糖磷酸化酶粗酶液(0.1 U/mL)为基本的反应条件,在此基础上对双酶耦合催化的pH值、温度进行优化。此时蔗糖磷酸化酶催化蔗糖生成G1P和果糖,且G1P通过昆布二糖磷酸化酶和葡萄糖反应生成β-1,3-葡寡糖,由于G1P作为整个反应体系的中间产物不断产生和消耗,因此难以监测,本文通过测定葡萄糖的转化率作为整体反应进程的指标。按公式(1)计算。
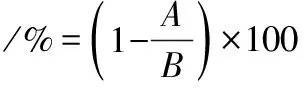
(1)
式(1)中:A为残余的葡萄糖的浓度,mmol/L;B为葡萄糖的初始浓度,mmol/L。
葡萄糖浓度可通过高效液相色谱(HPLC)进行测定,色谱柱Click XAmide(4.6 mm×250 mm);RI检测器;流动相V(乙腈)∶V(水)=85∶15;柱温30 ℃;流速1.0 mL/min;进样量20 μL。
2 结果与分析
2.1 以葡萄糖和G1P为底物时昆布二糖磷酸化酶粗酶液催化反应产物的分析
考虑到双酶耦合催化合成β-1,3-葡寡糖的复杂性,首先用G1P来验证昆布二糖磷酸化酶合成寡糖的聚合度特征。目前主要用MALDI-TOF-MS进行寡糖聚合度分析,该方法具有灵敏度强、分辨率高、测量范围广等特点[24]。对1.3.3中反应0、0.5、4、12、24 h的产物进行MALDI-TOF-MS分析,结果如图2所示。反应0.5 h时,产物的聚合度最高只到4;当反应4 h时,产物的聚合度范围为4~10,即随着反应时间的增加有更高聚合度的寡糖生成;当反应12 h时,产物聚合度范围则变为4~8,即反应12 h时生成的寡糖的聚合度并没有增加反而有所下降。推测这是由于随着合成反应的进行,体系中会伴随着大量游离磷的生成。游离磷的大量积累导致反应并不能继续向合成方向进行,而促进反应向着磷酸解的方向进行,这就使得之前合成的高聚合度寡糖磷酸解成低聚合度的寡糖和G1P。通过上述分析可知昆布二糖磷酸化酶粗酶液可催化G1P和葡萄糖反应合成不同聚合度的寡糖,并且随着反应时间的延长,合成寡糖的聚合度降低,最终出现动态平衡现象。所以可以通过控制反应时间得到一定聚合度范围的β-1,3-葡寡糖。

图2 昆布二糖磷酸化酶粗酶液催化反应产物的MALDI-TOF-MS分析Fig.2 MALDI-TOF-MS specturm of the reaction products catalyzed by Laminaribiose phosphorylase
采用MALDI-TOF-MS分析仅仅可以得到寡糖的聚合度分布,而ESI-MS/MS已经成为解析寡糖糖链组成的高效工具[25],又由于1H-NMR能够提供α-或β-异头碳的构型信息[26],所以本文利用ESI-MS/MS和1H-NMR对昆布二糖磷酸化酶合成的寡糖进行结构解析。以葡萄糖和G1P为底物,利用昆布二糖磷酸化酶粗酶液催化合成β-1,3-葡寡糖,经过石墨化碳柱纯化后,对乙腈体积分数为25%时洗脱出来的样品进行电喷雾质谱(electrospray ionization mass spectrometry,ESI-MS)、ESI-MS/MS和1H-NMR分析,分析结果如图3所示。
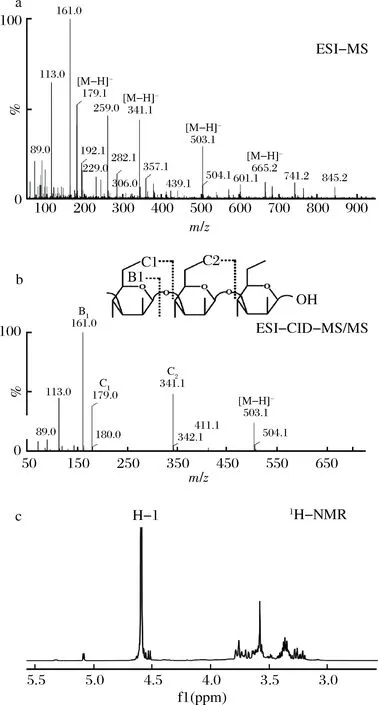
图3 昆布二糖磷酸化酶粗酶液催化反应产物的ESI-MS、ESI-MS/MS和1H-NMR分析Fig.3 ESI-MS,ESI-MS/MS and 1H-NMR specturm of the reaction products catalyzed by Laminaribiose phosphorylase
从图3-a中可以看出,在负离子模式下昆布二糖磷酸化酶粗酶液催化反应产物的ESI-MS结果显示m/z为341.1、503.1和665.2的峰,相对应的聚合度为2、3和4[27]。对于产物中聚合度为3的寡糖进行ESI-MS/MS分析,所测得的产物寡糖的碎片峰如图3-b所示,其质谱碎片峰中主要是C型离子峰:C2(m/z341)、C1(m/z179),仅在末端出现B型离子峰:B1(m/z161),这与1,3-键连接的葡寡糖的碎片峰的特性相同,这表明昆布二糖磷酸化酶粗酶液催化葡萄糖和G1P的反应产物为1,3-键连接的葡寡糖[25]。从图3-c中可以看出,产物寡糖的异头氢的化学位移出现δ4.5~5.0之间,而大多数的α-端基质子化学位移出现δ5~6之间,β-端基质子化学位移出现δ4~5之间,所以可知产物寡糖的立体构型为β-构型,即昆布二糖磷酸化酶粗酶液催化G1P和葡萄糖反应所生成的寡糖为β-1,3-葡寡糖。
2.2 以葡萄糖和蔗糖为底物时双酶耦合催化反应产物的分析
研究结果表明,昆布二糖磷酸化酶可以利用葡萄糖和G1P实现寡糖的合成,但是G1P价格昂贵,所以用成品G1P作为反应底物合成β-1,3-葡寡糖所需成本较高,不利于大规模合成β-1,3-葡寡糖。由于蔗糖磷酸化酶在Pi存在的条件下可以将1分子的蔗糖磷酸解生成1分子G1P和1分子果糖,因此,通过以蔗糖和葡萄糖为底物,用蔗糖磷酸化酶和昆布二糖磷酸化酶双酶耦合催化实现β-1,3-葡寡糖的廉价合成:(1)蔗糖磷酸化酶将蔗糖拆分为G1P和果糖;(2)昆布二糖磷酸化酶利用前者生成的G1P实现糖链聚合度的增加,并解离出游离磷;(3)解离下来的游离磷继续参与蔗糖磷酸化酶磷酸解蔗糖生成G1P。这样通过循环反应不仅大大提高了磷的利用率,同时减少了产物积累对反应的抑制作用。
对1.3.4中反应0、0.5、1、4、12和24 h的产物进行MALDI-TOF-MS分析,结果如图4所示。
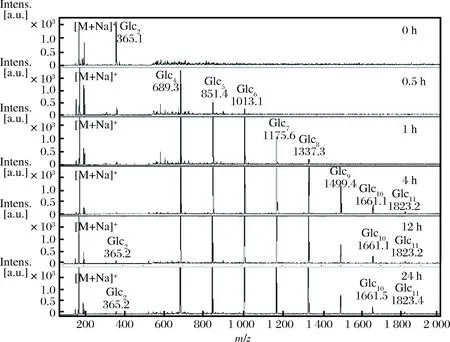
图4 耦合催化反应产物的MALDI-TOF-MS分析Fig.4 MALDI-TOF-MS specturm of the reaction products catalyzed by mixed enzymes
可以看出,0 h时,没有产物寡糖出现,随着反应时间延长到0.5 h时,开始有4糖、5糖和6糖生成,反应1 h时7糖、8糖开始出现。值得注意的是:添加到反应体系中的蔗糖的峰信号强度在不断地减弱,说明蔗糖正被磷酸解生成G1P。反应4 h时,9糖、10糖和11糖开始出现,而当接着增加反应时间时并没有更高聚合度的寡糖生成且产物寡糖的聚合度也没有降低,推测耦合催化循环反应达到了一个平衡的状态。以上结果表明,以蔗糖为G1P的提供者,用蔗糖磷酸化酶和昆布二糖磷酸化酶来催化葡萄糖合成寡糖时,随着时间的延长,最后寡糖的合成达到平衡,并不会出现高聚合度的寡糖被降解的现象。因此,通过蔗糖磷酸化酶催化蔗糖生成G1P来替代成品的G1P,并结合昆布二糖磷酸化酶完全可以实现寡糖的廉价合成。
为鉴定双酶耦合催化合成的寡糖结构,同样对乙腈体积分数为25%时洗脱出来的双酶耦合催化样品进行ESI-MS、ESI-MS/MS和1H-NMR分析,分析结果如图5所示。

图5 耦合催化反应产物的ESI-MS/MS、ESI-CID-MS/MS和1H-NMR分析Fig.5 ESI-MS,ESI-MS/MS and 1H-NMR specturm of the reaction products catalyzed by mixed enzymes
从图5-a中可以看出,在负离子模式下耦合催化反应产物的ESI-MS结果显示m/z为341.1、503.2和665.2,分别对应聚合度为2~4的葡萄糖单体的[M-H]-峰[27]。选择寡糖产物中的3糖进行ESI-MS/MS分析,所测得的产物寡糖的碎片峰如图5-b所示。从图5-b中可以看出,其质谱碎片峰中同样主要为C型离子峰:C2(m/z341)、C1(m/z179),仅仅在末端出现B型离子峰:B1(m/z161),这同样与1,3-键连接的葡寡糖的碎片峰的特性相符[25],这表明昆布二糖磷酸化酶粗酶液和蔗糖磷酸化酶耦合催化反应寡糖产物为1,3-键连接的葡寡糖。从图5-c中可以看出,产物寡糖的异头氢的化学位移同样出现δ 4.5~5.0之间,可知产物寡糖的立体构型为β-构型,即昆布二糖磷酸化酶粗酶液和蔗糖磷酸化酶耦合催化反应所生成的寡糖同样为β-1,3-葡寡糖。
2.3 昆布二糖磷酸化酶粗酶液催化合成β-1,3-葡寡糖反应体系的优化
在KITAOKA等[10]研究的基础上优化昆布二糖磷酸化酶、G1P和葡萄糖的添加量,结果如图6所示。
由图6-a可知,随着反应时间的增加,G1P的消耗量在不断的增加,酶浓度为0.01 U/mL和0.05 U/mL时,G1P的消耗量少,且G1P的消耗在4 h之前不断增加,之后G1P的消耗量增加变缓;当酶浓度为0.1 U/mL时,反应2 h之后趋于稳定,且此时消耗的G1P最多;当酶浓度为0.5 U/mL和1.0 U/mL时,0.5 h之前反应消耗的G1P达到最大,之后由于昆布二糖磷酸化酶催化的双向性使得反应向着磷酸解的方向进行,反应1 h之后趋于稳定。综合考虑G1P的消耗情况及2.1中反应产物的聚合度分布情况选择最适酶浓度为0.1 U/mL。
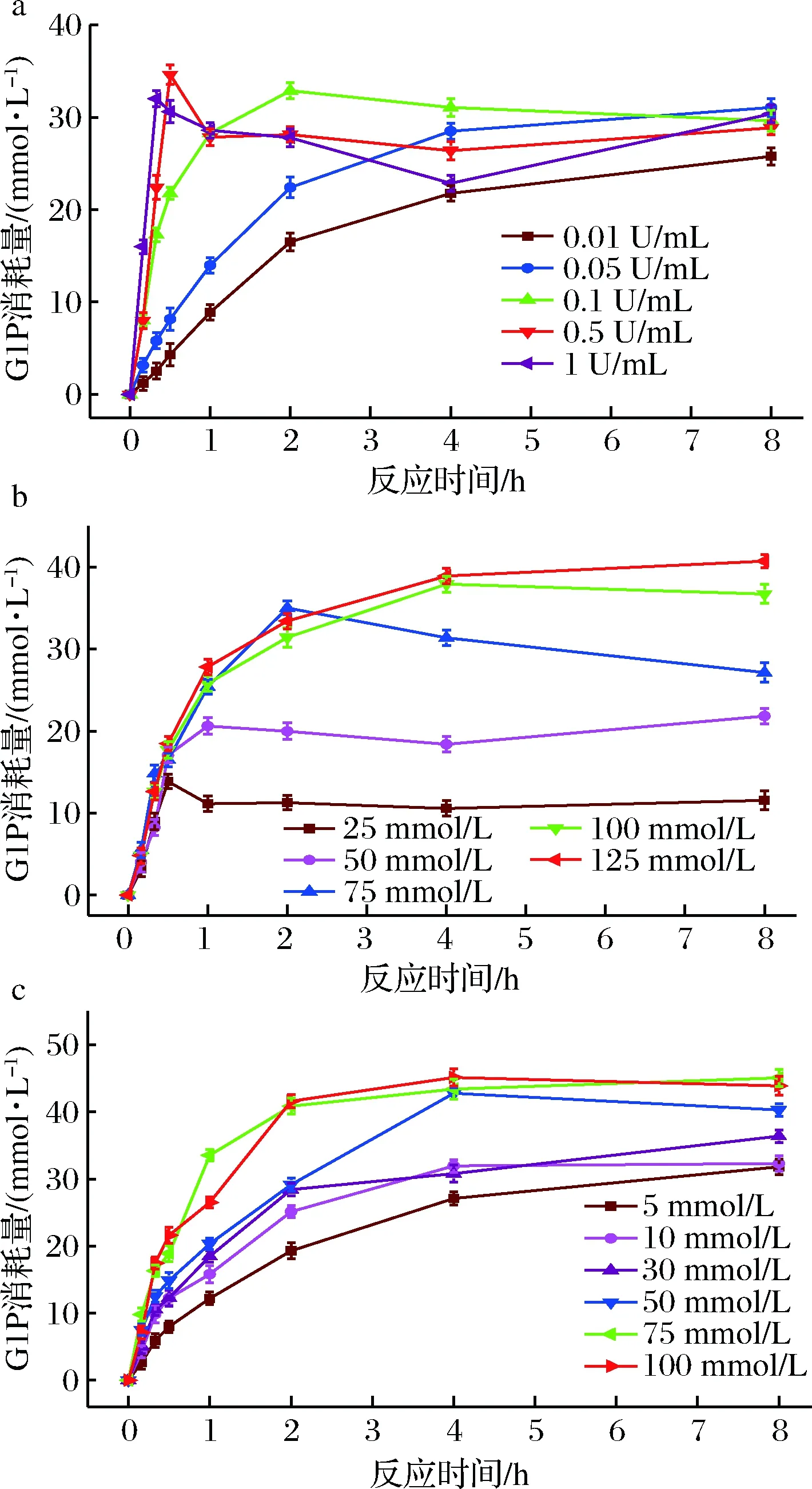
a-酶的添加量优化;b-GIP添加量优化;c-葡萄糖添加量优化图6 酶的添加量、G1P添加量和葡萄糖添加量对β-1,3-葡寡糖合成的影响Fig.6 The effect of enzyme、G1P and glucose dosage on the synthesis of β-1,3-glucooligosaccharides
在上述的最适昆布二糖酶添加量的条件下优化G1P的添加量对催化合成β-1,3-葡寡糖的影响,结果如图6-b所示。当催化反应1 h时,G1P添加量为25 mmol/L和50 mmol/L,反应已趋于平衡,此时G1P的消耗量已不再增加;当G1P添加量为75 mmol/L时,反应2 h时G1P的消耗量达到最大;当G1P的浓度达到100 mmol/L时,反应4 h G1P的消耗量达到最大;接着增大G1P的浓度到125 mmol/L时,反应4 h ,G1P的消耗量与100 mmol/L反应4 h相比并没有大幅的增加,且之后反应都趋于平衡,综合考虑反应G1P的消耗量可知反应的最适G1P的添加量为100 mmol/L。
在上述最适的酶的添加量和最适的G1P添加量的基础上优化葡萄糖的添加量对β-1,3-葡寡糖合成的影响,结果如图6-c所示。当葡萄糖添加量为5、10和30 mmol/L时,反应4 h,G1P的消耗量都相对较低且4 h之后G1P的消耗量趋于平缓;当葡萄糖的添加量为50 mmol/L时,反应4 h,G1P的消耗量达到最大,且和75、100 mmol/L葡萄糖添加量反应4 h相比,G1P的消耗量相差很小。通过葡萄糖添加量优化的结果可知,当G1P的添加量远远大于葡萄糖的添加量时并没有实现G1P的消耗量的大量增加。结合2.1中产物聚合度随时间变化情况和上述的体系的优化结果,昆布二糖磷酸化酶催化葡萄糖和G1P生成β-1,3-葡寡糖最适的反应条件为0.1 U/mL的酶量、100 mmol/L的G1P、50 mmol/L的葡萄糖、pH 7.2、37 ℃反应4 h,此时G1P的消耗量可达到42.7 mmol/L。
2.4 双酶耦合催化法合成β-1,3-葡寡糖反应体系的优化
耦合催化反应的温度和缓冲液的pH既影响蔗糖磷酸化酶磷酸解蔗糖生成G1P,又影响昆布二糖磷酸化酶催化葡萄糖和G1P生成β-1,3-葡寡糖,因此选择合适的反应温度和反应pH是合成β-1,3-葡寡糖的关键。通过2.3中对昆布二糖催化葡萄糖和G1P生成β-1,3-葡寡糖反应体系的优化,得知在0.1 U/L的昆布二糖磷酸化酶添加条件下,最适的葡萄糖添加量为50 mmol/L,因此在进行耦合催化的pH和温度优化时依旧考虑选择昆布二糖磷酸化酶添加量为0.1 U/L及葡萄糖添加量为50mmol/L,再结合李恬[22]等对蔗糖磷酸化酶催化蔗糖产G1P的最适条件的研究,选择100 mmol/L的蔗糖、50 mmol/L葡萄糖、0.1 U/mL昆布二糖磷酸化酶和0.2 U/mL 蔗糖磷酸化酶为基本反应条件,反应4 h来优化耦合催化反应的温度和pH,结果如图7所示。

a-pH优化;b-温度优化图7 pH和温度对耦合催化反应转化率的影响Fig.7 The influence of different pH and temperature on coupling catalysis
由图7-a可知,随着pH值的增大,转化率呈现先增加后减小的趋势,且在pH 6.5~7.0之间保持较高的转化率。当pH小于6.5时,耦合催化的化率呈直线增加的趋势;当pH为6.5时,耦合反应转化率达到最高;继续增大pH时,耦合催化的转化率明显下降。因为过高的pH影响蔗糖磷酸化酶和昆布二糖磷酸化酶的酶活,从而影响耦合反应的转化率。
本文由此可以确定耦合反应的最适pH为6.5,在此pH条件下葡萄糖的转化率为35.8%。温度对耦合催化反应同样具有较大的影响,不同的温度条件下耦合催化反应的转化率也不同,选择温度梯度为25、33、37、40、43、45、50、60 ℃进行优化,结果如图7-b所示。
在35~45 ℃温度范围内,耦合催化反应的转化率保持在较高的水平,当温度低于37 ℃时,随着温度的升高,耦合催化反应的转化率呈线性增加;当温度为40 ℃时,耦合催化反应的转化率达到最大(39.4%);当温度大于45 ℃时,耦合催化反应的转化率迅速下降,这是由于高温条件破坏了酶的结构,使得酶失活。由此可知耦合催化反应的最适温度为40 ℃。结合2.2中耦合催化产物聚合度随时间的变化情况及耦合催化反应体系的优化,生成β-1,3-葡寡糖最适的条件为100 mmol/L的磷酸缓冲液(pH 6.5)、100 mmol/L的蔗糖、50 mmol/L的葡萄糖、5 mmol/L的MgCl2、0.1 U/mL昆布二糖磷酸化酶、0.2 U/mL蔗糖磷酸化酶、40 ℃条件下反应4 h,此时葡萄糖的转化率可达39.4%。
3 结论
综上所述,E.gracilis中含有昆布二糖磷酸化酶且其细胞破碎液作为昆布二糖磷酸化酶的粗酶液可催化G1P和葡萄糖生成寡糖。在以上基础上,可通过蔗糖磷酸化酶催化蔗糖生成G1P来供昆布二糖磷酸化酶催化反应,生成寡糖。在本实验的条件下,我们发现耦合催化反应0.5 h时合成寡糖聚合度在4~6之间;反应4 h时,有7~11糖生成;4 h之后反应趋于平衡,并无更高聚合度的寡糖生成,聚合度稳定在4~11之间。对所生成的寡糖进行ESI-MS/MS和1H-NMR分析,可证明产物为β-1,3-葡寡糖,且经过对耦合催化条件的优化,得出在100 mmol/L的磷酸缓冲液(pH 6.5)、100 mmol/L的蔗糖、50 mmol/L的葡萄糖、5 mmol/L的MgCl2、0.1 U/mL昆布二糖磷酸化酶、0.2 U/mL蔗糖磷酸化酶、40 ℃条件下反应4 h,葡萄糖的转化率可达39.4%。以往的酶法合成需要昂贵的UDPG作为前体物质,而传统的化学法合成寡糖时,不仅需要加有保护基团的昂贵前体物质,并且由于需要多步迭代合成反应,造成目的寡糖的得率极低。本文的方法摒弃了两者的缺陷,仅需要价格低廉的葡萄糖和蔗糖为底物即可以实现β-1,3-葡萄糖的廉价合成,因而具有极大的产业化和市场化潜力。
[1] 陆光兴.热凝胶葡寡糖的高效定向水解制备及其生物活性研究[D].无锡:江南大学,2015.
[2] 张洪涛.微生物β-1,3-葡聚糖的强化合成及最小功能单元挖掘[D].无锡:江南大学,2011.
[3] SHINYA T, MNARD R, KOZONE I, et al.Novel β‐1,3-, 1,6-oligoglucan elicitor fromAlternariaalternata102 for defense responses in tobacco [J].Febs Journal, 2006, 273(11): 2 421-2 431.
[4] KAWASHIMA S, HIROSE K, IWATA A, et al.β-glucan curdlan induces IL-10-producing CD4+ T cells and inhibits allergic airway inflammation [J].Journal of Immunology, 2012, 189(12): 5 713-5 721.
[5] ZHU Feng-mei, DU Bin, XU Bao-jun.A critical review on production and industrial applications of beta-glucans [J].Food Hydrocolloids, 2016(52):275-288.
[6] 侯庆华,宋文东.昆布寡糖对2型糖尿病大鼠睾丸的保护作用[J].中药新药与临床药理,2011,22(2):160-164.
[7] HIDA T H, ISHIBASHI K, MIURA N N, et al.Cytokine induction by a linear 1,3-glucan, curdlan-oligo, in mouse leukocytesinvitro[J].Inflammation Research, 2009, 58(1): 9-14.
[8] DESCROIX K, VV, LAURENT I, et al.New oligo-β-(1,3)-glucan derivatives as immunostimulating agents [J].Bioorganic & Medicinal Chemistry, 2010, 18(1): 348-357.
[9] MARECHAL L R.Beta-1,3-oligoglucan: orthophosphate glucosyltransferases from Euglena gracilis.II.Comparative studies between laminaribiose- and beta-1,3-oligoglucan phosphorylase [J].Biochim Biophys Acta, 1967, 146(2): 431-442.
[10] KITAOKA M, SASAKI T, TANIGUCHI H.Purification and properties of laminaribiose phosphorylase (EC 2.4.1.31) fromEuglenagracilisZ [J].Archives of Biochemistry and Biophysics, 1993, 304(2):508-514.
[11] 侯顾伟,马江锋,隋姗姗,等.蔗糖磷酸化酶制备及应用的研究进展[J].中国酿造,2010(6):17-20.
[12] VANDAMME E J, VAN L J, LAPORTE D.Dynamics and regulation of sucrose phosphorylase formation inLeuconostocmesenteroidesfermentations [J].Biotechnology and Bioengineering, 1987, 29(1): 8-15.
[13] SILVERSTEIN R, VOET J, REED D, et al.Purification and mechanism of action of sucrose phosphorylase [J].The Journal of Biological Chemistry, 1967, 242(6):1 338-1 346.
[14] RUSSELL R R, MUKASA H, SHIMAMURA A, et al.StreptococcusmutansgtfA gene specifies sucrose phosphorylase [J].Infection and Immunity, 1988, 56(10):2 763-2 765.
[15] KULLIN B, ABRATT V R, REID S J.A functional analysis of theBifidobacteriumlongumcscA andscrP genes in sucrose utilization [J].Applied Microbiology and Biotechnology, 2006,72(5): 975-981.
[16] VAN DEN BROEK L A M, VAN BOXTEL E L, KIEVIT R P, et al.Physico-chemical and transglucosylation properties of recombinant sucrose phosphorylase fromBifidobacteriumadolescentisDSM20083[J].Applied Microbiology And Biotechnology, 2004, 65(2):219-227.
[17] KITAOKA M, SASAKI T, TANIGUCHI H.Conversion of sucrose into laminaribiose using sucrose phosphorylase, xylose isomerase and laminaribiose phosphorylase[J].Journal of the Japanese Society of Starch Science, 1993,40(3):311-314.
[18] YAMAMOTO Y, KAWASHIMA D, HASHIZUME A, et al.Purification and characterization of 1,3-β-D-glucan phosphorylase fromOchromonasdanica[J].Bioscience Biotechnology & Biochemistry, 2013,77(9):1 949-1 954.
[19] SAHEKI S, TAKEDA A, SHIMAZU T.Assay of inorganic phosphate in the mild pH range, suitable for measurement of glycogen phosphorylase activity[J].Analytical Biochemistry, 1985,148(2): 277-281.
[20] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976,72(1-2):248-254.
[21] KITAOKA M, SASAKI T, TANIGUCHI H.Synthesis of laminarioligosaccharides using crude extract of euglena-gracilis z-cells[J].Agricultural and Biological Chemistry, 1991,55(5):1 431-1 432.
[22] 李恬.蔗糖为底物双酶法合成直链糊精的研究[D].无锡:江南大学, 2013.
[23] NIHIRA T, SAITO Y, KITAOKA M, et al.Characterization of a laminaribiose phosphorylase fromAcholeplasmalaidlawiiPG-8A and production of 1,3-β-d-glucosyl disaccharides[J].Carbohydrate Research, 2012(361):49-54.
[24] 饶名祯, 顾晨荣, 李云霞, 等.MALDI-TOF MS技术在食品微生物领域的应用研究[J].上海师范大学学报(自然科学版), 2015, 44(6): 681-686.
[25] PALMA A S, LIU Yan, ZHANG Hong-tao, et al.Unravelling glucan recognition systems by glycome microarrays using the designer approach and mass spectrometry[J].Molecular & Cellular Proteomics, 2015, 14(4): 974-988.
[26] ARIFKHODZHAEV A O.Galactans and galactan-containing polysaccharides of higher plants[J].Chemistry of Natural Compounds, 2000, 36(3): 229-244.
[27] 李潇.褐藻酸寡糖的分离分析及其抗氧化活性的研究[D].西安:西北大学, 2011.
