SCD1抑制剂抗肿瘤作用的研究进展*
2018-06-14戴爽颜元良龚志成
戴爽,颜元良,龚志成
(1.中南大学湘雅药学院,湖南 长沙 410013;2.中南大学湘雅医院 药学部,湖南 长沙 410008)
硬脂酰辅酶A去饱和酶1(stearoyl-coenzyme A desaturase 1,SCD1)又称△-9-脂肪酸去饱和酶,是催化饱和脂肪酸(saturated fatty acid,SFA)向单不饱和脂肪酸(monounsaturated fatty acid,MUFA)转化的关键酶。SCD1锚定于内质网膜上,拥有4个跨膜结构域,与烟酰型辅酶NAD(P)、细胞色素还原酶以及细胞色素b5紧密结合,催化△9位和△10位间双键的形成。SCD1的终产物—油酸(C18:1n-9)和棕榈油酸(C16:1n-7)是三酰甘油、胆固醇酯、蜡酯、膜磷脂等多种结构脂质优先利用的底物。因此,SCD1介导的SFA/MUFA平衡对促进生物膜形成,支持肿瘤细胞快速分裂以及调节功能性脂筏结构,介导增殖和生存信号传导具有重要意义。SCD1与肿瘤发生、发展密切相关,SCD1已经成为一个新型的抗肿瘤治疗靶点。药物抑制或基因敲除手段干扰SCD1的表达可以显著抑制肿瘤细胞的增长、诱导凋亡。本文重点讨论SCD1抑制剂在肿瘤治疗以及抗肿瘤药理学机制上的研究。
1 SCD1与肿瘤
SCD1最初被发现与肥胖、脂肪肝、血脂异常及胰岛素抵抗等代谢综合征相关,随着脂质组学和基因组学的发展,SCD1及其产物MUFA在肿瘤中的重要作用才逐渐被了解。一些肿瘤流行病学研究显示,肿瘤患者血清和组织中MUFA/SFA含量可用来评估患者癌症风险,SFA与MUFA之间的转化还与肿瘤预后密切相关。CHAVARRO等[1]通过对476例前列腺患者的血清脂肪酸成分检测发现,血清中MUFA(16:1n-7)的含量与高级别前列腺癌的发病率呈正相关。类似地,乳腺癌患者血清中高水平的反式-单不饱和脂肪酸会增加乳腺患病的危险性[2]。一项前瞻性研究[3]还显示,乳腺肿瘤及转移患者其卵磷脂中硬脂酸的低水平与乳腺癌不良预后密切相关。肿瘤组织中SFA与MUFA含量的不平衡提示,SCD1作为关键调节因子在肿瘤脂质组成和发生、发展中可能发挥着积极作用。
研究显示[4],SCD1在肺腺癌肿瘤组织中的表达量要高于癌旁正常细胞,体内外干扰SCD1表达能够抑制肿瘤的增殖、侵袭转移并诱导细胞凋亡,在肾癌、甲状腺癌及结肠癌细胞中也有类似的发现,SCD1高表达与肺腺癌的不良预后相关,可作为肺腺癌的一个生物标志物。在雄激素受体阳性(androgen receptor positive,AR+)的前列腺癌细胞中,SCD1通过介导AR活化促进LNCaP细胞增殖[5],SCD1的表达及其产物MUFA的含量还与前列腺癌恶性转化密切相关[6]。在肝癌细胞系中,抗肿瘤药物氟尿嘧啶和阿霉素通过调控PI3K/JNK1/2途径能够时间依赖性地诱导SCD1表达上调,而抑制SCD1的表达能够抑制肿瘤细胞的增殖,增加细胞对化疗药物诱导凋亡的敏感性[7]。SCD1在肿瘤组织和细胞中特异性过度表达使其可以作为一个潜在的肿瘤治疗的药靶,抑制SCD1可能为肿瘤药物设计提供一个新的方向。
2 SCD1抑制剂的抗肿瘤作用
SCD1在人类疾病中扮演着重要的角色,吸引着众多公司和研究人员参与到SCD1抑制剂的研发工作中。自2005年Xenon公司研制出首个SCD抑制剂后,Merck、Abbott、CV Therapeutics等公司也相继开发出新的SCD抑制剂[8-9]。目前SCD1抑制剂都还处于临床前 研 究,CAY-10566、A939572、CVT-11127、MF-438、T-3764518等是已报道在肿瘤中具有抗肿瘤活性的抑制剂(见附表)。
2.1 CAY-10566
CAY-10566是由Abbott公司开发的哒嗪杂环类SCD抑制剂,实验证明CAY-10566能有效阻断饱和长链脂肪酸辅酶A向单不饱和长链脂肪酸辅酶A转化。在肝癌HepG2细胞中,CAY-10566能剂量依赖性抑制细胞增殖,作用于mSCD1和hSCD1,IC50分别为7.9 nmol(C17:1/C17:0)/6.8 nmol(C16:1/C16:0)和26 nmol[10]。随后的研究表明,CAY-10566不仅能抑制HepG2细胞生长、促进凋亡,还能剂量依赖性和时间依赖性地诱导肝癌细胞HepG2发生自噬[11]。在HCT116结肠癌体外实验中,CAY-10566可抑制油酸的合成,诱导多聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymerase,PARP)降解,抑制细胞生长并促进细胞凋亡。CAY-10566对肿瘤生长的抑制在小鼠体内实验中也得到证实。这项研究同时还提示食源性的补充不饱和脂肪酸可能是限制SCD1抑制剂发挥抗肿瘤效应的原因之一[12]。此外,研究显示CAY-10566具有良好的选择性,与癌旁正常组织比较,对体外培养的乳腺癌组织具有更好的抑瘤作用,饱和脂肪酸的积累仅出现在肿瘤组织中[13]。CAY-10566还能够抑制尼古丁诱导的口腔上皮癌变细胞及一系列头颈部鳞癌细胞的增殖、侵袭和克隆形成[14]。在卵巢癌中,肿瘤干细胞中脂肪酸的不饱和程度对于维持肿瘤干细胞特性具有重要的意义,CAY-10566降低细胞中不饱和脂肪酸含量,阻断核转录因子Kappa B(nuclear factor kappa B,NF-κB)信号通路,抑制肿瘤干细胞的体外成球和体内成瘤能力[15]。
2.2 A939572
A939572是Abbott公司利用骨架迁越方法设计的另一类哌啶芳基脲衍生物,可以功能性抑制HepG2细胞中SCD1酶活性,在体内外都具有良好的理化特性[16]。在低血清培养条件下A939572处理肿瘤细胞出现明显的生长抑制,并且该生长抑制能被SCD1的产物油酸所逆转,而在不饱和脂肪酸充足的高血清培养条件下肿瘤细胞生长则不会受到A939572的影响。有结果表明,肿瘤细胞的生存依赖于不饱和脂肪酸,在没有外源不饱和脂肪酸补充的情况下,利用A939572阻断内源性不饱和脂肪酸合成,能有效抑制肿瘤细胞生长[17]。在荷瘤小鼠动物模型中,A939572也呈现抑瘤效应。在许多肿瘤细胞系和动物模型中,A939572均具有浓度依赖性的抑制细胞增长的活性,包括人咽鳞癌、肾透明细胞癌、甲状腺癌、肝癌[18-20]。用A939572处理这些肿瘤细胞,均可触发内质网应激(endoplasmic reticulum stress,ER stress)反应,导致细胞生长受抑和细胞凋亡。而在肝癌Huh7细胞中,A939572处理还会影响细胞成球能力,抑制细胞侵袭和转移,降低细胞耐药性。线粒体是细胞的“动力工厂”,线粒体功能障碍通常被认为与细胞凋亡密切相关。有研究表明A939572会造成结肠癌细胞线粒体功能发生障碍,导致胞内氧化应激(reactive oxygen species,ROS)水平升高、线粒体跨膜电位改变以及细胞色素C(P450)膜转位进而引起细胞凋亡。L-环丝氨酸能够通过抑制神经酰胺合成逆转这种促凋亡效应,表明神经酰胺合成信号在A939572介导细胞凋亡的抑癌功能中也发挥着一定的作用[21]。除了单药使用的抗肿瘤作用,A939572与不同肿瘤化疗药物联合应用在体内外实验中都表现出独特的治疗优势。在肾癌裸鼠移植瘤模型中,A939572与雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂temsirilimus单独使用的抑制效应为20%~30%,而两者联合使用对肿瘤生长的抑制效应可达60%,显示出体外的协同抗癌效果[18]。A939572还可以增加肝癌化疗抵抗细胞对sorafenib的药物敏感性,可作为sorafenib的化疗增敏剂提高药物疗效[20]。另外,SCHLAEPFER等[22]发现孕激素通过刺激SCD表达促进乳腺癌细胞增殖,介导乳腺癌对多西紫杉醇耐药,A939572与多西紫杉醇联用可作为孕激素敏感型乳腺癌的联合化疗方案。
2.3 CVT-11127
CVT-11127是CV Therapeutics公司通过高通量筛选得到的1个新的SCD抑制剂,其不仅具有稳定的代谢性质,还能选择性抑制△5-和△6-去饱和酶[23]。有研究表明[24],CVT-11127可以刺激AMPK活化,磷酸化ACC而抑制葡萄糖介导的脂质合成,进而抑制细胞增殖。在MINVILLE WALZ的研究中[25],CVT-11127与另一种SCD1抑制剂MF-438均能高效的抑制单不饱和脂肪酸的从头合成。在人骨肉瘤U2OS细胞中,CVT-11127相对于MF-438具有更好的抗肿瘤效应,这种效应被认为与未折叠蛋白反应中CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)的激活相关。CVT-11127还可以阻断肺癌细胞周期进程,使细胞发生G1/S期阻滞,抑制肺癌细胞的脂质合成和增殖[26]。SCD1调节饱和脂肪酸与不饱和脂肪酸的平衡,为功能性脂筏提供特殊的脂类分子。CVT-11127能改变脂筏结构,影响细胞膜的流动性,干预表皮细胞生长因子(epidermal growth factor,EGF)受体的磷酸化而导致EGFR下游AKT和ERK信号失活。CVT-11127与EGFR信号抑制剂(gefitinib、LY29004,U0126和rapamycin)对肺癌细胞协同的生长抑制作用同时也证实CVT-11127可以作为提高肺癌化疗疗效的一种干预策略[27]。
2.4 MF-438
MF-438是一种口服有效,并具有良好药代动力学特性和代谢稳定性的噻二唑哒嗪类衍生物[28]。内质网相关的蛋白降解(ER-associated protein degradation,ERAD)负责发现和清除错误折叠蛋白,ERAD平衡对维持内质网功能稳态,保护细胞存活具有重要作用。在甲状腺癌体内外中,MF-438能协同ERAD抑制剂增加细胞应激压力,抑制细胞生长并诱导细胞凋亡。肿瘤干细胞(CSC)对肿瘤形成、存活、转移和复发起重要作用,是造成肿瘤化疗耐药的最根本原因。NOTO等[29]研究发现SCD1在肺癌干细胞样细胞中高表达,免疫荧光结果显示,MF-438处理的干细胞样细胞呈现早期凋亡标志M30和干性标志乙醛脱氢酶A1(aldehyde dehydrogenase 1,ALDH1A1)标记的双阳性信号,表明MF-438能选择性地诱导干细胞样细胞发生凋亡。在裸鼠移植瘤模型中也观察到,MF-438选择性诱导ALDH1A1阳性细胞发生凋亡,抑制体内成瘤能力。肺腺癌干细胞在顺铂处理后干性特征增强,对顺铂化疗具有高度耐药性。而MF-438联合顺铂治疗能够降低肺腺癌细胞的干性,抑制肿瘤三维球体的形成,下降干性标志物的表达,提高肺腺癌干细胞对顺铂化疗的敏感性。MF-438逆转肺癌干细胞顺铂耐药,其机制与激活内质网应激和增加自噬有关[30]。
2.5 T-3764518
T-3764518是一种可口服的小分子SCD1抑制剂,具有抗肿瘤效果好,毒副作用小和良好的药代动力学性质等优点。脂质组学分析结果显示,T-3764518呈剂量依赖性降低结肠癌HCT116细胞移植瘤组织中不饱和脂肪酸与饱和脂肪酸的比率。体内药效实验还证实T-3764518能够抑制789-O细胞裸鼠移植瘤的生长而不会引发严重药物毒性[31]。体内外实验表明,T-3764518能选择性抑制SCD1活性,抑制硬脂酰辅酶A向油酰辅酶A的转化,从而改变细胞膜的脂质组成。T-3764518能够延迟肿瘤生长,激活内质网应激反应,并诱导细胞凋亡,体内外都显示出良好的抑瘤作用[32]。抑制SCD1活性会导致其底物SFA累积而引起细胞凋亡,研究却发现[33],抑制SCD1可负反馈激活AMPK,阻断下游脂肪酸合成通路,避免SFA的过度蓄积,从而拮抗T-3764518对HCT116细胞的生长抑制。该研究认为,AMPK通路诱导产生的自噬在T-3764518的肿瘤治疗中对肿瘤细胞起着保护性作用,能够促进肿瘤细胞的存活,抑制细胞自噬这一细胞存活通路能增强T-3764518的肿瘤抑制效应。
2.6 其他SCD抑制剂
除了上述几种抑制剂具有抗肿瘤作用外,其他几种SCD抑制剂也表现出良好的肿瘤治疗前景,包括 Plurisin#1、BZ36 和 Abbott#7n。研究表明[34-35],Plurisin#1能够选择性消除未分化的诱导多能干细胞(induced pluripotent stem cells,iPS cells),降低iPS细胞治疗的致瘤性。在诱导iPS心肌再生的治疗过程中,Plurisin#1能够诱导Nanog阳性(维持细胞干性的核转录因子)iPS细胞的凋亡,降低心肌梗死的概率,同时不影响心肌分化。抑制剂BZ36可以阻碍脂肪酸从头合成,阻断肿瘤关键致癌通路,抑制雄激素敏感/耐药的前列腺癌细胞的增殖,同时抑制前列腺癌移植瘤裸鼠的瘤体增长[36-37]。Abbott研发的另一种SCD1抑制剂Abbott #7n在结肠癌HCT116细胞体内外模型也显示抑瘤作用[38-39]。该研究均强调SCD1与肿瘤的发生和发展密切相关,并充分证明SCD1抑制剂作为抗肿瘤药物的可能性。
3 SCD1抑制剂抗肿瘤机制
研究表明,SCD1可通过调控肿瘤脂代谢和AMPK/ACC、PI3K/Akt、Wnt等致癌信号通路促进肿瘤的发生、发展(见附图)。在肿瘤细胞中持续活化的SCD1,一方面为癌细胞提供源源不断的MUFA底物,促进脂质的生物合成,另一方面参与肿瘤细胞增殖和存活通路信号转导,加速细胞增殖、增加细胞侵袭和生存能力。脂肪酸从头合成的终产物为SFA,非脂肪组织中SFA的蓄积会导致细胞脂毒性,诱导细胞发生凋亡。实际上,在SCD1过表达的肿瘤细胞中,存在着SFA向MUFA的不断转化,从而避免SFA的过量累积引起的脂毒性。siRNA手段敲除SCD1可使肿瘤细胞对外源性饱和脂肪酸诱导的凋亡效应更加敏感。在前列腺癌中SCD1抑制剂BZ36可阻断SFA向MUFA的转化,造成肿瘤细胞存活率下降[37]。使用CVT-11127处理肺癌细胞时也有类似的作用[27]。该研究表明SCD1对维持肿瘤细胞在代谢压力下的存活有重要作用,而抑制SCD1活性将破坏MUFA/SFA间的平衡,导致细胞程序性死亡。
除此之外,SCD1还可以通过AMPK/ACC途径对整个脂肪酸从头合成过程进行调节。AMPK是细胞和机体能量代谢的主要调节器,AMPK的激活使得ACC磷酸化而降低其活性。使用CVT-11127抑制SCD1表达能够激活AMPK,活化的AMPK使ACC磷酸化而失活,阻断脂肪酸的合成,并抑制肿瘤细胞增殖[24]。然而,ONO的研究[33]发现T-3764518激活AMPK,阻断SFA的合成和累积反过来抵抗SCD1抑制诱导的脂毒性。并且AMPK还能激活肿瘤细胞自噬存活通路。用AMPK抑制剂直接阻断SCD1抑制对AMPK的负反馈信号或者用自噬抑制剂抑制AMPK诱导的自噬存活,都能增强肿瘤细胞对SCD1抑制剂的敏感性。研究表明[33],抑制SCD1诱导肿瘤细胞凋亡需要依赖AMPK的失活。
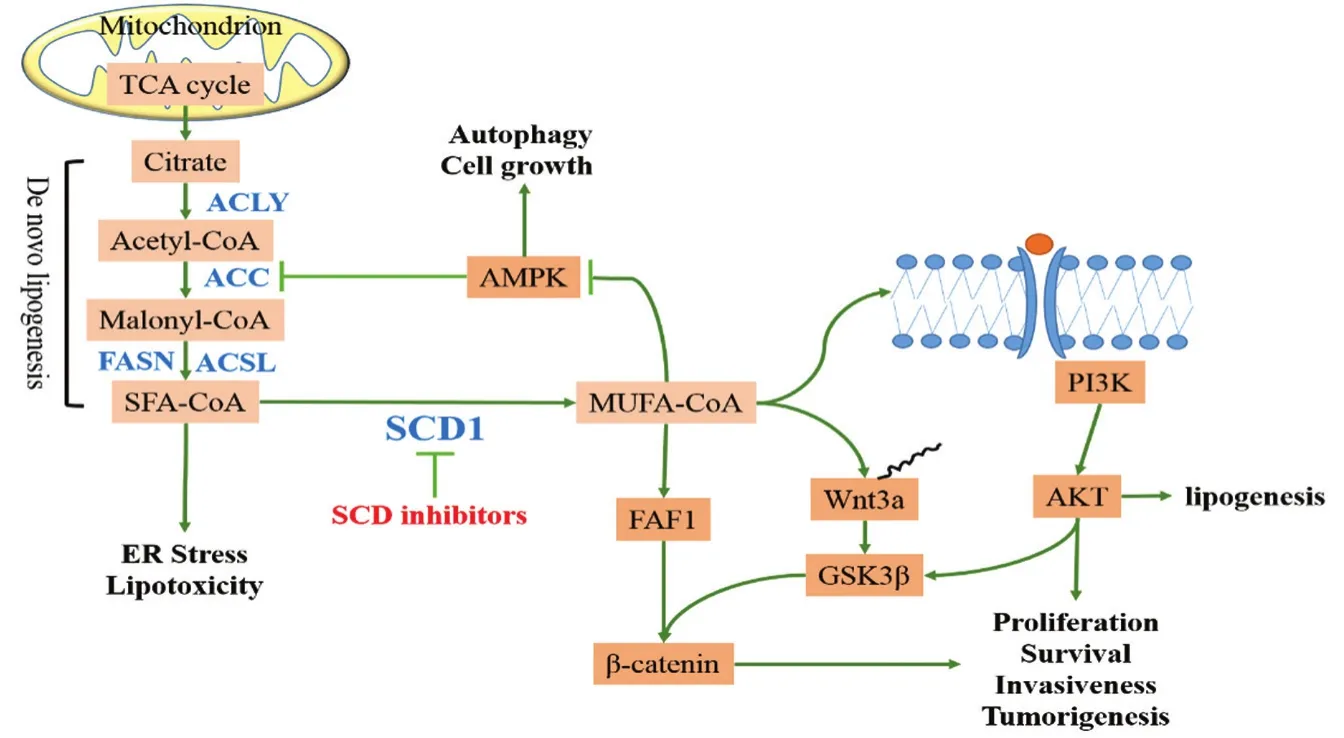
附图 SCD1调控肿瘤脂代谢和致癌信号转导
PI3K/Akt信号通路是细胞增殖和存活通路,同时也是肿瘤细胞糖脂代谢重要的调控信号。研究表明,SCD1的活性与PI3K/Akt信号转导有密切的联系。癌细胞中高表达的SCD1通过调节MUFA含量,改善细胞膜的流动性。有研究者认为[27],这种脂质膜有利于EGFR的磷酸化和脱离,进而激活下游信号级联反应。抑制SCD活性阻碍EGFR配体介导的磷酸化,阻断下游靶点AKT、ERK、mTOR的活化,从而降低EGF诱导的细胞增殖。除此之外,抑制SCD1还通过抑制AKT下游分子糖原合成酶激酶3β(GSK3β)的磷酸化,阻止β-catenin向核内转移而发挥抑癌作用[40]。
早期研究[41]发现,Wnt3a蛋白的分泌和转运依赖于特殊位点上棕榈油酸的修饰。Wnt信号活化会引起GSK3β磷酸化降低,导致β-catenin向核内聚集而促进肿瘤的发生和转移。用CAY-10566和A939572阻断单不饱和脂肪酸的合成,阻断Wnt蛋白的旁分泌及自分泌,从而抑制Wnt下游信号激活[42]。不饱和脂肪酸还能够直接抑制β-catenin的降解,促进肿瘤生长。Fas相关因子(FAF1)能与β-catenin 结合而促进β-catenin的降解,不饱和脂肪酸通过与该蛋白的UAS结构域结合,阻碍β-catenin的泛素化降解。A939572处理细胞可以检测到β-catenin表达减少,肿瘤生长受抑[43]。本研究表明,抑制SCD1可能通过抑制Wnt/β-catenin通路发挥抗肿瘤作用。
综上所述,SCD1是调节肿瘤细胞脂质构成的关键枢纽,同时也在肿瘤细胞生长、存活、恶性转化信号转导通路中发挥重要作用。以SCD1为靶点的抑制剂可抑制肿瘤细胞增殖、诱导细胞凋亡并逆转肿瘤细胞化疗耐药,在临床前实验中显示一定的抗肿瘤活性。因此,靶向SCD1的干预治疗有望成为肿瘤药物治疗的一个新选择。迄今为止,SCD1抑制剂在肿瘤治疗中的研究仍然停留在临床前实验,主要是由于其在治疗过程造成的体重下降以及对皮肤、眼睛的毒副作用。因此,如何克服治疗过程的毒副作用将成为下一代SCD1抑制剂研发的关键点。同时,全面深入了解SCD1的肿瘤生物学功能及调控机制将为SCD1抑制剂作为抗肿瘤药物提供证据,并推动SCD1抑制剂的有效研发。
[1]CHAVARRO J E,KENFIELD S A,STAMPFER M J,et al.Blood levels of saturated and monounsaturated fatty acids as markers of de novo lipogenesis and risk of prostate cancer[J].American Journal of Epidemiology,2013,178(8): 1246-1255.
[2]CHAJÈS V,THIÉBAUT A C,ROTIVAL M,et al.Association between serum trans-monounsaturated fatty acids and breast cancer risk in the E3N-EPIC Study[J].American Journal of Epidemiology,2008,167(11): 1312-1320.
[3]BOUGNOUX P,CHAJES V,LANSON M,et al.Prognostic significance of tumor phosphatidylcholine stearic acid level in breast carcinoma[J].Breast Cancer Research & Treatment,1992,20(3): 185-194.
[4]HUANG J,FAN X X,HE J,et al.SCD1 is associated with tumor promotion,late stage and poor survival in lung adenocarcinoma[J].Oncotarget,2016,7(26): 39970-39979.
[5]KIM S J,CHOI H,PARK S S,et al.Stearoyl CoA desaturase(SCD) facilitates proliferation of prostate cancer cells through enhancement of androgen receptor transactivation[J].Molecules &Cells,2011,31(4): 371-377.
[6]PECK B,SCHUG Z T,ZHANG Q,et al.Inhibition of fatty acid desaturation is detrimental to cancer cell survival in metabolically compromised environments[J].Cancer & Metabolism,2016,4(1):6.
[7]BANSAL S,BERK M,ALKHOURI N,et al.Stearoyl-CoA desaturase plays an important role in proliferation and chemoresistance in human hepatocellular carcinoma[J].Journal of Surgical Research,2014,186(1): 29-38.
[8]LIU G.Stearoyl-CoA desaturase inhibitors: update on patented compounds[J].Expert Opinion on Therapeutic Patents,2009,19(9): 1169-1191.
[9]POWELL D A.An overview of patented small molecule stearoyl coenzyme-A desaturase inhibitors (2009-2013)[J].Expert Opinion on Therapeutic Patents,2014,24(2): 155-175.
[10]LIU G,LYNCH J K,FREEMAN J,et al.Discovery of potent,selective,orally bioavailable stearoyl-CoA desaturase 1 inhibitors[J].Journal of Medicinal Chemistry,2007,50(13): 3086-3100.
[11]HUANG G M,JIANG Q H,CAI C,et al.SCD1 negatively regulates autophagy-induced cell death in human hepatocellular carcinoma through inactivation of the AMPK signaling pathway[J].Cancer Letters,2015,358(2): 180-190.
[12]MASON P,LIANG B,LI L,et al.SCD1 inhibition causes cancer cell death by depleting mono-unsaturated fatty acids[J].PLoS One,2012,7(3): e33823.
[13]MOHAMMADZADEH F,MOSAYEBI G,MONTAZERI V,et al.Fatty acid composition of tissue cultured breast carcinoma and the effect of stearoyl-CoA desaturase 1 inhibition[J].Journal of Breast Cancer,2014,17(2): 136-142.
[14]NANJAPPA V,RENUSE S,SATHE G J,et al.Chronic exposure to chewing tobacco selects for overexpression of stearoyl-CoA desaturase in normal oral keratinocytes[J].Cancer Biology &Therapy,2015,16(11): 1593-1603.
[15]LI J,CONDELLO S,THOMES-PEPIN J,et al.Lipid desaturation is a metabolic marker and therapeutic target of ovarian cancer stem cells[J].Cell Stem Cell,2017,20(3): 303-314.
[16]XIN Z,ZHAO H,SERBY M D,et al.Discovery of piperidine-aryl urea-based stearoyl-CoA desaturase 1 inhibitors[J].Bioorganic &Medicinal Chemistry Letters,2008,18(15): 4298-4302.
[17]ROONGTA U V,PABALAN J G,WANG X,et al.Cancer cell dependence on unsaturated fatty acids implicates stearoyl-CoA desaturase as a target for cancer therapy[J].Molecular Cancer Research,2011,9(11): 1551-1561.
[18]VON ROEMELING C A,MARLOW L A,WEI J J,et al.Stearoyl-CoA desaturase 1 is a novel molecular therapeutic target for clear cell renal cell carcinoma[J].Clinical Cancer Research An Official Journal of the American Association for Cancer Research,2013,19(9): 2368-2380.
[19]VON ROEMELING C A,MARLOW L A,PINKERTON A B,et al.Aberrant lipid metabolism in anaplastic thyroid carcinoma reveals stearoyl CoA desaturase 1 as a novel therapeutic target[J].J Clin Endocrinol Metab,2015,100(5): 697-709.
[20]MA M K F,LAU Y E T,LEUNG D H W,et al.Stearoyl-CoA desaturase regulates sorafenib resistance via modulation of ER stress-induced differentiation[J].Journal of Hepatology,2017,67(5): 979-990.
[21]CHEN L,REN J,YANG L,et al.Stearoyl-CoA desaturase-1 mediated cell apoptosis in colorectal cancer by promoting ceramide synthesis[J].Scientif i c Reports,2016,6: 19665.
[22]SCHLAEPFER I R,HITZ C A,GIJÓN M A,et al.Progestin modulates the lipid prof i le and sensitivity of breast cancer cells to docetaxel[J].Molecular & Cellular Endocrinology,2012,363(1/2): 111-121.
[23]KOLTUN D O,PARKHILL E Q,VASILEVICH N I,et al.Novel,potent,selective,and metabolically stable stearoyl-CoA desaturase(SCD) inhibitors[J].Bioorganic & Medicinal Chemistry Letters,2009,19(7): 2048-2052.
[24]SCAGLIA N,CHISHOLM J W,IGAL R A.Inhibition of stearoyl CoA desaturase-1 inactivates acetyl-CoA carboxylase and impairs proliferation in cancer cells: role of AMPK[J].PLoS One,2009,4(8): e6812.
[25]MINVILLEWALZ M,PIERRE A S,PICHON L,et al.Inhibition of stearoyl-CoA desaturase 1 expression induces CHOP-dependent cell death in human cancer cells[J].PLoS One,2010,5(12): e14363.
[26]HESS D,CHISHOLM J W,IGAL R A.Inhibition of stearoyl CoA desaturase activity blocks cell cycle progression and induces programmed cell death in lung cancer cells[J].PLoS One,2010,5(6): e11394.
[27]NASHED M,CHISHOLM J W,IGAL R A.Stearoyl-CoA desaturase activity modulates the activation of epidermal growth factor receptor in human lung cancer cells[J].Experimental Biology & Medicine,2012,237(9): 1007-1017.
[28]LÉGER S,BLACK W C,DESCHENES D,et al.Synthesis and biological activity of a potent and orally bioavailable SCD inhibitor (MF-438)[J].Bioorganic & Medicinal Chemistry Letters,2010,20(2): 499-502.
[29]NOTO A,RAFFA S,VITIS C D,et al.Stearoyl-CoA desaturase-1 is a key factor for lung cancer-initiating cells[J].Cell Death &Disease,2013,4(12): e947.
[30]PISANU M E,NOTO A,DE V C,et al.Blockade of Stearoyl-CoA-desaturase 1 activity reverts resistance to cisplatin in lung cancer stem cells[J].Cancer Letters,2017,406: 93-104.
[31]IMAMURA K,TOMITA N,KAWAKITA Y,et al.Discovery of novel and potent stearoyl coenzyme A desaturase 1 (SCD1)inhibitors as anticancer agents[J].Bioorganic & Medicinal Chemistry,2017,25(14): 3768-3779.
[32]NISHIZAWA S,SUMI H,SATOH Y,et al.In vitro and in vivo antitumor activities of T-3764518,a novel and orally available small molecule stearoyl-CoA desaturase 1 inhibitor[J].European Journal of Pharmacology,2017,807: 21-31.
[33]ONO A,SANO O,KAZETANI K,et al.Feedback activation of AMPK-mediated autophagy acceleration is a key resistance mechanism against SCD1 inhibitor-induced cell growth inhibition[J].PLoS One,2017,12(7): e0181243.
[34]BEN-DAVID U,GAN Q F,GOLAN-LEV T,et al.Selective elimination of human pluripotent stem cells by an oleate synthesis inhibitor discovered in a high-throughput screen[J].Cell Stem Cell,2013,12(2): 167-179.
[35]ZHANG L,PAN Y,QIN G,et al.Inhibition of stearoyl-coA desaturase selectively eliminates tumorigenic nanog-positive cells:Improving the safety of iPS cell transplantation to myocardium[J].Cell Cycle,2014,13(5): 762-771.
[36]FU J M,SUN S,KODOMURU V,et al.Nicotinamide derivatives and their use as therapeutic agents[P]: EP,EP2266566.2010,12.29.
[37]FRITZ V,BENFODDA Z,RODIER G,et al.Abrogation of de novo lipogenesis by stearoyl-CoA desaturase 1 inhibition interferes with oncogenic signaling and blocks prostate cancer progression in mice[J].Molecular Cancer Therapeutics,2010,9(6): 1740-1754.
[38]ZHAO H,SERBY M D,SMITH H T,et al.Discovery of 1-(4-phenoxypiperidin-1-yl) -2-arylaminoethanone stearoyl-CoA desaturase 1 inhibitors[J].Bioorganic & Medicinal Chemistry Letters,2007,17(12): 3388-3391.
[39]MASON P,LIANG B,LI L,et al.SCD1 inhibition causes cancer cell death by depleting mono-unsaturated fatty acids[J].PLoS One,2012,7(3): e33823.
[40]MAUVOISIN D,CHARFI C,LOUNIS A M,et al.Decreasing stearoyl-CoA desaturase-1 expression inhibits β-catenin signaling in breast cancer cells[J].Cancer Science,2013,104(1): 36-42.
[41]TAKADA R,SATOMI Y,KURATA T,et al.Monounsaturated fatty acid modif i cation of Wnt protein: its role in Wnt secretion[J].Developmental Cell,2006,11(6): 791-801.
[42]RIOS-ESTEVES J,RESH M.Stearoyl CoA desaturase is required to produce active,lipid-modified Wnt proteins[J].Cell Reports,2013,4(6): 1072-1081.
[43]KIM H,RODRIGUEZNAVAS C,KOLLIPARA R K,et al.Unsaturated fatty acids stimulate tumor growth through stabilization of β-catenin[J].Cell Reports,2015,13(3): 495-503.
