宫颈癌细胞系中HPV感染与GRP78、JNK及CHOP表达的相关性分析*
2018-06-14刘卿郭兵秦娟
刘卿,郭兵,秦娟
(1.贵州医科大学 病理生理学教研室,贵州 贵阳 550004;2.贵州省贵阳市妇幼保健院,贵州 贵阳 550003)
宫颈癌是最常见的妇科恶性肿瘤,发病率在女性恶性肿瘤中位居第2位[1]。高危型人乳头瘤病毒(human papilloma virus,HPV)感染已被证实是导致宫颈病变和宫颈癌的首要因素[2]。高危型HPV目前有15种,如HPV16、18、31、33和35等,主要引起宫颈癌等恶性肿瘤[2]。葡萄糖调节蛋白78(glucose regulated protein 78,GRP78),亦称免疫球蛋白重链结合蛋白(Bip),系内质网上的一种应激蛋白,其参与蛋白质的修饰、折叠及转运[3]。近期研究发现,GRP78与肿瘤的发生发展密切相关,其在神经胶母细胞瘤、肺癌、食管癌、肝癌及胰腺癌等多种恶性肿瘤中都显现高表达[4-6]。GRP78和增强子结合蛋白同源蛋白(enhancerbinding protein homologous protein,CHOP)是ERS的2个经典标志物[7]。C-Jun氨基末端激酶(C-Jun NH2-terminal kinase,JNK)是一类丝裂原活化蛋白激酶蛋白(mitogen-activated protein kinase,MAPK),JNK信号通路可被细胞因子、应激等多种因素激活,其参与细胞的增殖与分化、形态维持、骨架构建、细胞凋亡及恶变[8]。近来有研究表明,内质网应激蛋白参与了肿瘤和炎症疾病的发生与发展,其他内质网应激蛋白CHOP、JNK也有表达增高[9-12]。
本实验选取HPV阳性的2个细胞系Hela(HPV18型)和Siha(HPV16型)以及HPV阴性的细胞系C33A,探讨不同HPV感染状态与内质网应激蛋白GRP78、JNK及CHOP表达之间的关系,为进一步分析HPV 感染诱导宫颈癌的内在分子机制提供一定的实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞来源 人宫颈癌细胞株3种:HPV18(+)Hela、HPV16(+)Siha及HPV(-)C33a(购自中国科学院典型培养物保藏委员会细胞库)。
1.1.2 主要试剂 DMEM培养基、胰酶、胎牛血清(美国Gibco公司),一抗:JNK(兔抗人源)、GRP78(兔抗人);CHOP(兔抗人)、内参一抗 F-actin(兔来源)(英国Abcam公司),二抗:羊抗兔IgG(美国Sigma公司),逆转录试剂盒(日本TaKaRa公司),ELIVSIONTM试剂盒(福州迈新生物技术开发有限公司)、Trizol(美国Invitrogen公司)。
1.2 主要方法
1.2.1 细胞复苏、培养、传代及冷冻 Siha细胞系为HPV16型(HPV16+)宫颈腺癌细胞系,Hela细胞系为HPV18型(HPV18+)宫颈鳞癌细胞系,C33a为HPV阴性(HPV-)的宫颈鳞癌细胞系。细胞复苏遵守快融的原则,先将水浴锅调至37℃,从液氮罐里拿出冻存管迅速放入37℃水浴箱中,使其迅速融化,用吸管吸出细胞悬液,注入离心管并加入4 ml的完全培养液,以1 000 r/min离心5 min,弃上清液,加入适量的培养液吹打,使其形成悬浮液。Siha细胞、Hela细胞、C33a细胞培养条件均一致:将细培养于含10%优质胎牛血清和1%青霉素-链霉素双抗的DMEM培养基中,24~48 h换液1次,于37℃、5%二氧化碳CO2饱和湿度培养箱中培养。细胞融合度达至90%左右时,在超净工作台上操作,弃除旧培养基,用PBS洗3次,25 cm培养瓶加入胰酶消化液约0.5~1.0 ml,置37℃培养箱约1.5 min,轻轻振动瓶底使细胞全部脱落,加入完全培养基3 ml,轻轻吹打成细胞悬液,收集至离心管中离心弃上清液,再加入完全培养液吹打成细胞悬液,按照1︰2的比例传代至培养瓶内,置37℃培养箱。细胞冻存时遵守慢冻的原则,选择对数期生长的细胞,最好是已经传代培养4、5代后的细胞。离心,去上清液留细胞沉淀,加入冻存液(10%的DMSO+90%胎牛血清)后吹打混匀,以每管1 ml分装到细胞冷冻保存管中。
1.2.2 细胞免疫组织化学法 取3个宫颈癌细胞系的细胞爬片各1张,1×PBS洗3次,2~3 min;4%多聚甲醛固定15 min(1滴),空气干燥5 min;然后浸泡于0.5% Triton X-100中使细胞膜破裂,1×PBS洗3次,各2~3 min;3% 过氧化氢H2O21滴浸润玻片20 min,1×PBS洗3次,2~3 min;滴入BSA(封闭血清)1滴,36℃温箱孵育20 min,滴加一抗(JNK抗体、GRP78抗体、CHOP抗体,稀释倍数1︰100)50 μl/孔板,置于湿盒内,4℃过夜。1×PBS洗3次,各5 min。二抗工作液孵育(湿盒)37℃ 30 min。PBS清洗标本3次,各5 min。C液(湿盒)37℃ 30 min。PBS清洗标本3次,各5 min。操作完成后使用DAB显色液显色,用蒸馏水冲洗玻片以终止反应,然后使用苏木苏复染以使细胞核着色,蒸馏水冲洗以及PBS冲洗玻片返蓝,最后用中性树脂封片,然后置于显微镜下观察,拍照记录实验结果。以PBS代替JNK抗体、GRP78抗体、CHOP抗体作为对照,细胞核及细胞质呈黄色为阳性表达。显微镜下进行观察拍照,使用IPP6.0软件进行计数。阳性细胞百分比=阳性细胞数/细胞总数×100%,阳性细胞百分比评分判定标准:1分:阳性染色细胞数≤25%;2分:阳性染色细胞数占25%~49%;3分:阳性细胞数≥50%。染色强度评分:0分-无染色,1分-淡黄色,2分-黄色,3分-棕黄色。随机选取5个视野的平均得分作为切片的最终评分,最终组织判断评分=阳性细胞百分比评分×染色强度评分。根据最终组织判断评分分为4个等级:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),7~9分为强阳性(+++)。
1.2.3 Western blot 从6孔版中收集细胞,加入细胞裂解液裂解将提取的蛋白质用BCA蛋白定量试剂盒定量后分装保存(-80℃);12%的SDS-PAGE电泳(5μg上样量)蛋白样品分离后转移至PVDF膜;封闭,杂交[用blocking buffer将目的抗体稀释至适当的浓度,一抗(稀释浓度1︰500,内参一抗的稀释浓度为1︰1 000),TBST漂洗(3次×5 min)];用封闭液将二抗稀释成一定浓度(1︰1 000),TBS-T漂洗(4次×5 min);ECL显色,曝光液按A液︰B液1︰1混匀后均匀覆盖在整片膜上,反应2 min放入曝光仪曝光检测。以β-actin蛋白为内对照,用ImageJ软件分析GRP78、JNK及CHOP蛋白条带与β-actin蛋白条带像素灰度。
1.2.4 RNA的提取 将1 ml Trizol加到6孔板中裂解细胞,放置5 min,加入0.2 ml氯仿,混匀后室温静置3 min。10 000 r/min离心10 min。取上清,加入等体积的异丙醇,静置10 min。10 000 r/min离心10 min。弃上清,加入1 ml 75%乙醇/管。7 500 r/min离心5 min。弃上清,用适量DEPC水溶解沉淀。使用紫外分光光度计(Nano Drop1000)测定RNA的浓度和纯度。
1.2.5 RT-PCR ①按照TaKaRa公司逆转录试剂盒说明书配制总体积20 μl的逆转录反应体系(2×RT buffer 10 μl,6N 随机引物(100 pmol/ul)1 μl,RT-mix 1 μl,模板(RNA)5 μl,DEPC 水 3 μl);②逆转录反应条件的设置:25℃ 10 min,42℃ 50 min,85℃5 min;各组RNA逆转录为cDNA;③根据PCR反应系统的组成和要求,设计20 μl的反应体系(2×PCR premix Taq)10 μl,Primers F(10 μmol/ul)1 μl,Primers R(10 μmol/ul)1 μl,模板 *(c DNA)2 μl,DEPC水6 μl(引物序列见表1);④PCR反应条件:94℃ 3 min,94℃ 30 s,58℃ 30 s,72℃ 40 s(循环 28次),72℃ 5 min在PCR扩增仪上进行扩增。将15 μl PCR产物置于1.2%琼脂糖凝胶(内含0.5 μg/ml溴化乙啶Ethidium Bromide,EB)电泳分离后于凝胶成像仪中进行图像处理,观察各组目的基因的表达情况并将各电泳条带做灰度分析定量分析实验结果。

表1 引物序列及扩增片段长度
1.3 统计学方法
数据分析采用SPSS 20.0 统计软件,计量资料以均数±标准差(±s)表示,多组间两两比较时先进行单因素方差齐性检验,方差齐性时采用Tukey HSD法;方差不齐时采用非参数检验中的两独立样本秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 GRP78、JNK及CHOP蛋白的免疫组织化学检测结果
免疫组织化学染色结果可见:Siha细胞呈多角形,GRP78在细胞浆和细胞核染色均出现棕黄色颗粒(见图1A),免疫组织化学评分为(8.400 0±1.341 6)分;Hela细胞形态与Siha类似,细胞胞浆染色主要为黄色,较Siha细胞稍弱(见图1B),免疫组织化学评分为(5.200 0±1.095 5)分;C33a细胞较小,外形呈圆形且细胞核较大,GRP78在C33a细胞中的染色主要为淡黄色,胞核染色主要为淡黄色(见图1C,1D),免疫组织化学评分为(2.200 0±0.836 7)分。
免疫组织化学染色结果可见:Siha细胞也呈现多角形,JNK在细胞浆和细胞核内染色,均出现棕黄色颗粒(见图2A),免疫组织化学评分为(7.800 0±1.643 2)分;Hela细胞形态与Siha类似,胞浆染色较深,胞核的染色较Siha细胞稍弱(见图2B),免疫组织化学评分为(4.800 0±1.095 5)分;C33A细胞较小,外形呈圆形且细胞核较大,JNK在C33A细胞中细胞浆和胞核染色均较弱(见图2C),免疫组织化学评分为(1.800 0±0.836 7)分。免疫组织化学染色结果可见:Hela细胞呈现多角形,CHOP在细胞浆和细胞核内染色,均出现棕黄色颗粒,免疫组织化学评分为(7.200 0±1.643 2)分;Hela细胞形态与Siha类似,CHOP在Hela细胞系中的染色与Siha细胞的染色结果类似,胞浆染色较深,但胞核的染色较Siha细胞稍弱,免疫组织化学评分为(4.200 0±1.095 5)分;C33A细胞较小,外形呈圆形且细胞核较大,CHOP在C33A细胞中的染色极弱,细胞浆染色较弱(见图3),免疫组织化学评分为(1.400 0±0.509 9)分。
GRP78、JNK及CHOP在3种细胞的免疫组织化学评分方差齐性(F=38.973、29.348和24.269,均P=0.000),Tukey HSD检验结果表明GRP78蛋白表达在HPV16(+)Siha中高于 HPV18(+)Hela、HPV(-)C33a,在HPV(-)C33a细胞中GRP78表达极低;同时内质网应激相关蛋白JNK和CHOP蛋白在宫颈癌细胞HPV16(+)的Siha表达也高于HPV18(+)Hela、HPV(-)C33a,见表2~4。
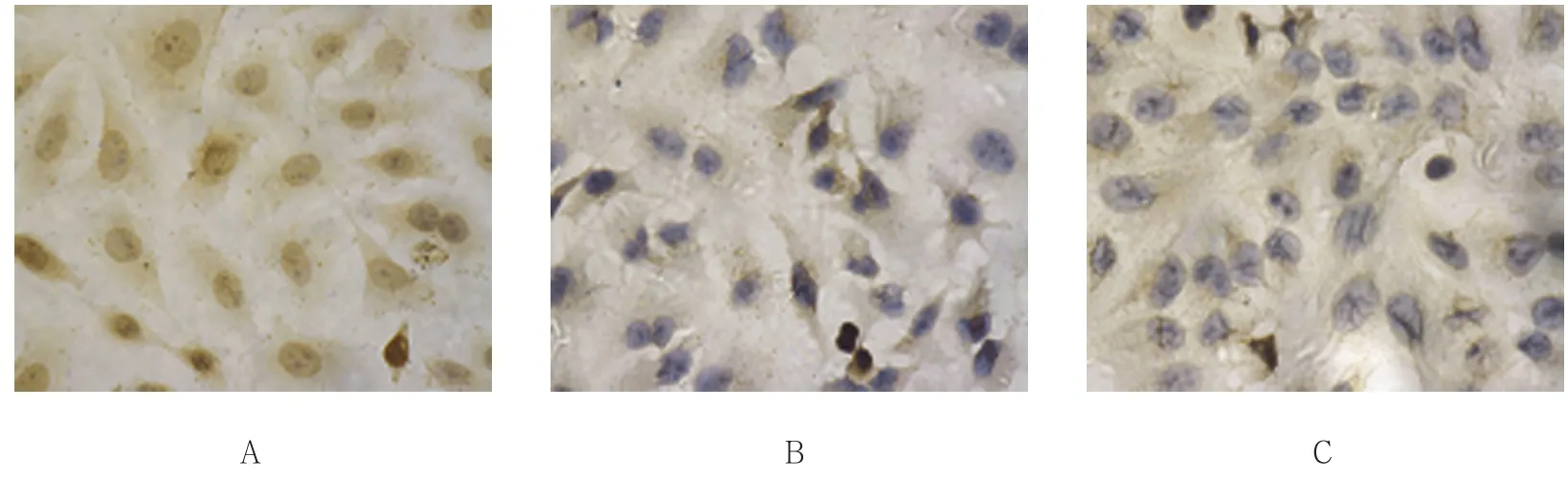
图1 GRP78在3种细胞株中的表达 (×400)

图2 JNK在3种细胞株中的表达 (×400)
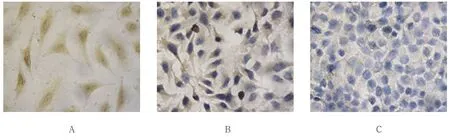
图3 CHOP在3种细胞株中的表达 (×400)
2.2 宫颈癌细胞中GRP78、JNK及CHOP蛋白的Western bolt检测结果
从图4和表5可知,GRP78蛋白在HPV16(+)Siha、HPV18(+)Hela表达强于HPV(-)C33a(P<0.05),JNK和CHOP在HPV(+)的2个宫颈癌细胞系HeLa和Siha中表达强于HPV(-)的宫颈癌细胞C33A(P<0.05)。从图4灰度分析直方图中可以更直观地看出以上结果(灰度分析的数值为每个条带的灰度值与相应的β-actin灰度的比值)。

表2 GRP78在3种细胞株中表达水平的多重比较
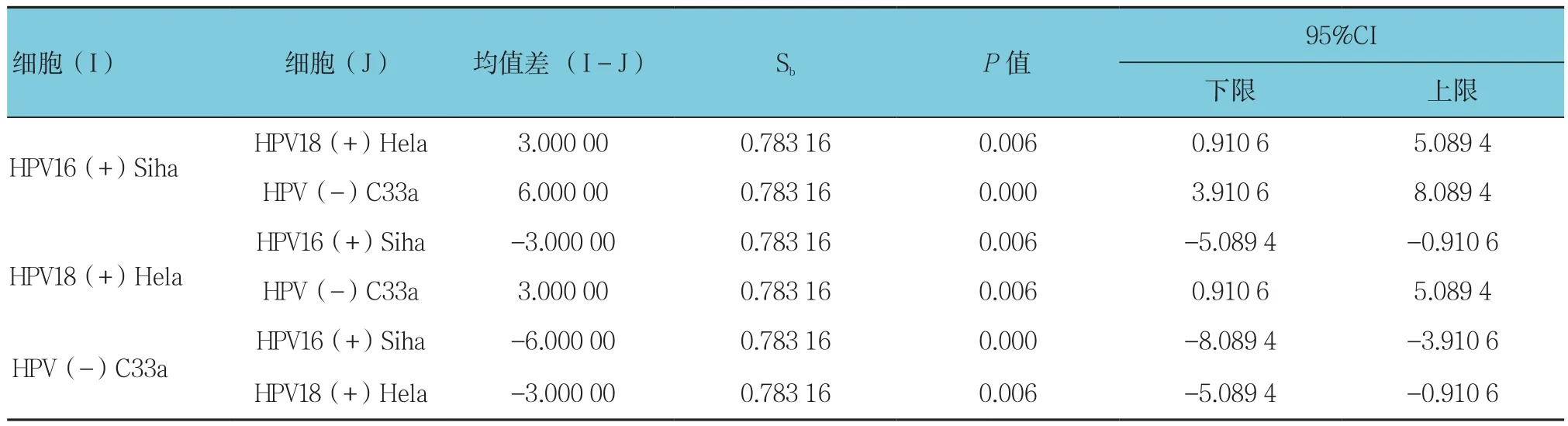
表3 JNK在3种细胞株中表达水平的多重比较

表4 CHOP在3种细胞株中表达水平的多重比较

图4 Western blot及灰度分析结果
表5 Western blot检测结果 (±s)

表5 Western blot检测结果 (±s)
组别 CHOP GRP78 JNK HPV(-)C33a 73.45±3.27 94.84±1.31 53.35±2.56 HPV16(+)Siha 134.93±7.85 140.63±10.65 127.82±7.20 HPV18(+)Hela 88.74±2.42 116.86±4.11 77.46±4.75
2.3 不同HPV亚型宫颈癌细胞中JNK、GRP78及CHOP mRNA表达结果
从图5和表6可知,GRP78 mRNA在HPV16(+)Siha、HPV18(+)Hela表达高于HPV(-)C33a(P<0.05),JNK 和 CHOP mRNA 表达在 HPV16(+)Siha、HPV18(+)Hela也高于 HPV(-)C33a(P<0.05)。
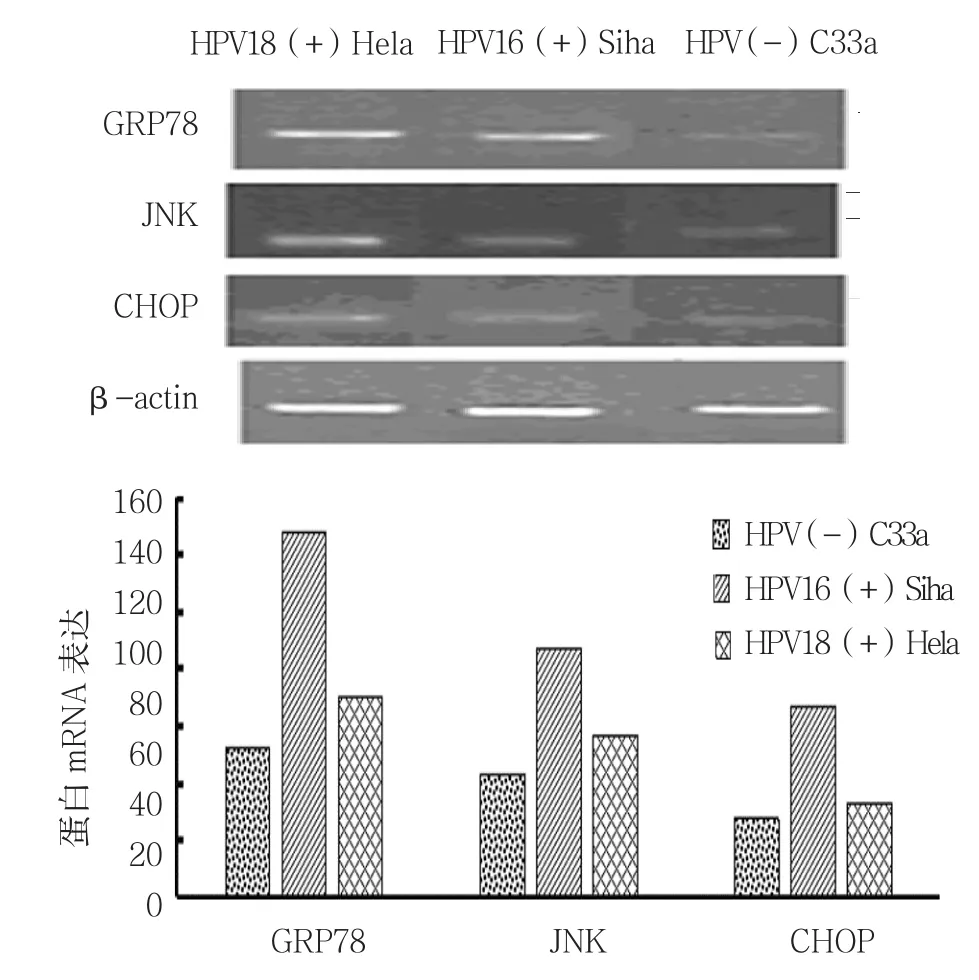
图5 RT-PCR及灰度分析结果
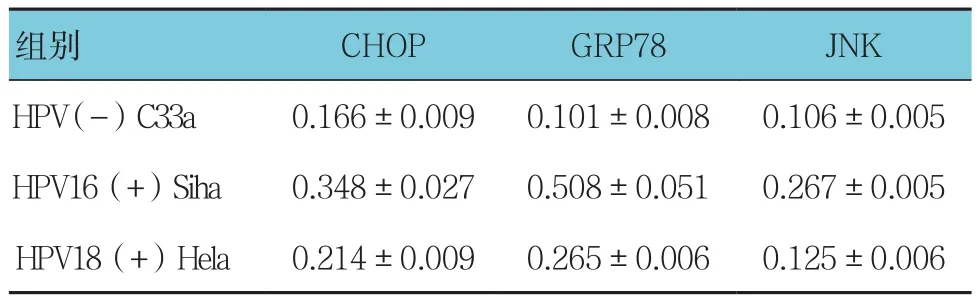
表6 RT-PCR检测结果
3 讨论
宫颈癌每年新发病50万,其中40万在发展中国家(80%)[13]。高危型人乳头瘤病毒(HPV)感染已被证实是导致宫颈病变和宫颈癌的首要因素[13]。HPV病毒根据病毒致病力大小分为:低危型和高危型两大类。高危型HPV目前有15种,如HPV16、18、31、33和35等,主要引起宫颈癌等恶性肿瘤。宫颈癌也是一种炎症疾病,炎症反应是由感染、组织损伤以及组织内环境的异常变化所激发的一种适应性应答反应。慢性感染可造成机体发生反复的、继发性损伤、修复反应及组织内环境的紊乱,调控肿瘤的发生和发展。
内质网是真核细胞中一种重要的细胞器,外界的许多不良刺激会导致细胞内质网稳态失衡,会出现蛋白质未折叠或者错误折叠,它们聚集在内质网上,会损伤内质网的正常生理功能,该现象即内质网应激(ERS)。近来有研究表明,内质网应激与肿瘤发生、发展密切相关,这主要与内质网应激介导的细胞凋亡有关[14]。
葡萄糖调节蛋白78亦称免疫球蛋白重链结合蛋白(Bip),系内质网上的一种应激蛋白,在内质网应激下GRP78表达增高,通过表达的提高以维持内质网稳定从而保护细胞,其参与蛋白质的修饰、折叠和转运。在内质网中,GRP78可促进蛋白质的正确折叠,维持内质网正常功能。当ERS早期,内质网分子伴侣蛋白GRP78表达上调促进错误折叠或者未折叠蛋白的正确折叠、恢复内质网Ca2+转运,有助于增强细胞对损伤的抵抗力,促进细胞存活。但是,当持续过强的ERS时,GRP78与内质网跨膜蛋白双链RNA依赖的蛋白激酶样内质网激酶解离,启动PERK/elF2α(真核转录起始因子2α)通路,活性转录因子4(ATF4)表达增强,ATF4与增强子结合蛋白同源蛋白(CHOP)基因启动子结合后,CHOP表达增高导致细胞色素C释放增加,启动Caspase凋亡级联反应,最终导致细胞凋亡。此外,GRP78也与1型跨膜蛋白激酶(RE1)脱离,IRE1发生自身磷酸化和二聚化而被激活,引起凋亡信号因子C-Jun氨基末端激酶(JNK)的活化,最终引起细胞凋亡。
近期研究发现,GRP78与肿瘤的发生发展密切相关,其在神经胶母细胞瘤、肺癌、食管癌、肝癌及胰腺癌等多种恶性肿瘤中都显现高表达。CHOP系内质网相关促凋亡蛋白和内质网特异性转录因子,其在哺乳动物细胞中广泛表达。正常情况下,CHOP少量表达于真核细胞的细胞浆中,当ERS时CHOP大量聚集并表达于细胞核中,通过启动Caspase凋亡级联反应,最终导致细胞凋亡。有研究表明,CHOP在人脑胶质瘤中高表达,正常脑组织中低表达[16]。C-Jun氨基末端激酶(JNK)系凋亡信号因子,它是一类丝裂原活化蛋白激酶蛋白,JNK信号通路可被应激等多种因素激活,它参与细胞的增殖与分化、细胞凋亡及恶变。大量实验表明,JNK信号通路在细胞分化、细胞凋亡、应激反应以及多种人类疾病发生与发展中起至关重要的作用,JNK信号通路功能失调可造成慢性炎症、肿瘤等多种疾病。有研究报道,JNK在肿瘤组织中的活性明显高于正常组织,表明JNK可能参与肿瘤的形成。综上可知,GRP78、CHOP及JNK的表达与肿瘤的发生与发展有紧密的相关性。
本研究从细胞学领域通过免疫组织化学方法、Western blot检测内质网应激相关蛋白GRP78、JNK及CHOP的表达情况,RT-PCR检测GRP78、JNK及CHOP mRNA表达,以及差异是否有统计学意义。得出实验结果:GRP78蛋白在高危型HPV16(+)、HPV18(+)感染的宫颈细胞中的蛋白含量高于HPV(-)感染的宫颈细胞,同时内质网应激相关蛋白JNK、CHOP在高危型 HPV16(+)Siha、HPV18(+)Hela中也有较高表达,进一步证实内质网应激相关蛋白GRP78、CHOP及JNK与不同HPV亚型相关,由此可推理出内质网应激蛋白可能参与宫颈癌的发生与发展。
本文通过细胞实验测定不同HPV亚型感染的宫颈癌细胞中GRP78、CHOP及JNK蛋白的表达,以及差异是否有统计学意义,提供GRP78、CHOP及JNK与HPV感染相关性的实验室依据,结果提示内质网应激可能参与宫颈癌的发生与发展,而且与高危型HPV感染相关,并可能广泛参与宫颈癌的病理过程。
[1]BRIANTI P,DE FLAMMINEIS E,MERCURI S R.Review of HPV-related diseases and cancers[J].New Microbiol,2017,40(2):80-85.
[2]FRAENKEL P G.Anemia of inf l ammation: A review[J].Med Clin North Am,2017,101(2): 285-296.
[3]PRASAD M,PAWLAK K J,BURAK W E,et al.Mitochondrial metabolic regulation by GRP78[J].Sci Adv,2017,3(2): e1602038.
[4]LIZARDO M M,MORROW J J,MILLER T E,et al.Upregulation of glucose-regulated protein 78 in metastatic cancer cells is necessary for lung metastasis progression[J].Neoplasia,2016,18(11): 699-710.
[5]TSAI S F,TAO M,HO L,et al.Isochaihulactone-induced DDIT3 causes ER stress-PERK independent apoptosis in glioblastoma multiforme cells[J].Oncotarget,2017,8(3): 4051-4061.
[6]YANG H,FAN S,AN Y,et al.Bisdemethoxycurcumin exerts pro-apoptotic effects in human pancreatic adenocarcinoma cells through mitochondrial dysfunction and a GRP78-dependent pathway[J].Oncotarget,2016,7(50): 83641-83656.
[7]JIAN L,LU Y,LU S,et al.Chemical chaperone 4-phenylbutyric acid reduces cardiac ischemia/reperfusion injury by alleviating endoplasmic reticulum stress and oxidative stress[J].Med Sci Monit,2016(22): 5218-5227.
[8]KIM H I,HONG S H,KU J M,et al.Tonggyu-tang,a traditional Korean medicine,suppresses pro-inflammatory cytokine production through inhibition of MAPK and NF-kappaB activation in human mast cells and keratinocytes[J].BMC Complement Altern Med,2017,17(1): 186.
[9]WANG G,ZHANG T,SUN W,et al.Arsenic sulfide induces apoptosis and autophagy through the activation of ROS/JNK and suppression of Akt/mTOR signaling pathways in osteosarcoma[J].Free Radic Biol Med,2017(106): 24-37.
[10]HSIEH M J,CHEN J C,YANG W E,et al.Dehydroandrographolide inhibits oral cancer cell migration and invasion through NF-kappa B-,AP-1-,and SP-1-modulated matrix metalloproteinase-2 inhibition[J].Biochem Pharmacol,2017(130):10-20.
[11]ZHU Y,JIANG Y,SHI L,et al.7-O-Geranylquercetin induces apoptosis in gastric cancer cells via ROS-MAPK mediated mitochondrial signaling pathway activation[J].Biomed Pharmacother,2017(87): 527-538.
[12]MAXWELL T,CHUN S Y,LEE K S,et al.The anti-metastatic effects of the phytoestrogen arctigenin on human breast cancer cell lines regardless of the status of ER expression[J].Int J Oncol,2017,50(2): 727-735.
[13]WANG F,TANG Q,LV G,et al.Comparison of computed tomography and magnetic resonance imaging in cervical cancer brachytherapy: A systematic review[J].Brachytherapy,2017,16(2): 353-365.
[14]MAENG H J,SONG J H,KIM G T,et al.Celecoxib-mediated activation of endoplasmic reticulum stress induces de novo ceramide biosynthesis and apoptosis in hepatoma HepG2 cells mobilization[J].BMB Rep,2017,50(3): 144-149.
[15]ONO K,ISE M,IKEBE D,et al.Successful treatment with biweekly CHOP for bone marrow relapse of blastic plasmacytoid dendritic cell neoplasm[J].Rinsho Ketsueki,2017,58(2): 150-154.
[16]TUNGKUM W,JUMNONGPRAKHON P,TOCHARUS C,et al.Melatonin suppresses methamphetamine-triggered endoplasmic reticulum stress in C6 cells glioma cell lines[J].J Toxicol Sci,2017,42(1): 63-71.
