基于高覆盖(磷酸化)蛋白质组对人胚胎干细胞干性维持调控网络的解析
2018-06-13赵文娟臧佳音刘俊华陈跃磊丁小燕杨冬贺福初
赵文娟,臧佳音,刘俊华,陈跃磊,丁小燕,杨冬,贺福初
1.军事科学院 军事医学研究院 生命组学研究所,国家蛋白质科学中心·北京,北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206;2.中国科学院 上海生命科学研究院 生物化学与细胞生物学研究所干细胞库,上海 200031
胚胎干细胞(embryonicstemcells,ESC)作为一种多能干细胞,可以分化成多种谱系细胞[1]。通过转录组学、表观遗传学和功能研究,对ESC多能性和自我更新的分子机制已得到相对充分的认识[1-3],其中信号转导和转录调控发挥着重要作用。已知信号转导和转录调控与蛋白水平和翻译后修饰水平直接相关,因此利用蛋白质组学(尤其是翻译后修饰组学)数据进一步探索其机制具有重要的理论意义和潜在的应用价值。
蛋白质磷酸化修饰负责调控蛋白质功能、亚细胞定位和相互作用以及蛋白质稳定性,通过调控信号转导[4]、基因表达[5]以及蛋白激酶驱动的信号网络[6],影响细胞周期[7]、细胞增殖、分化、凋亡等重要生物学过程。ESC(磷酸化)蛋白质组的鉴定,对于全面认识ESC多能性和自我更新相关的核心调控网络至关重要。然而,以前的研究由于技术水平的限制,并没有得到较全的ESC(磷酸化)蛋白质组[8-11]。随着磷酸化肽段富集技术及质谱技术的快速发展,蛋白质磷酸化修饰的质谱鉴定已向高精度、高灵敏度、快速扫描的方向不断进步。在本研究中,基于目前最高水平的磷酸化肽段富集和高精度质谱鉴定技术,我们得到目前较大的H9细胞(磷酸化)蛋白质组数据集,并对多能性维持相关的调控网络进行了解析。
1 材料与方法
1.1 材料
H9细胞由中国科学院上海生命科学研究院生物化学与细胞生物学研究所干细胞库提供。尿素购自Millipore公司;乳酸、碘乙酰胺、乙腈、三氟醋酸购自Sigma公司;二氧化钛购自GLScienc⁃es公司;胰蛋白酶购自Promega公司;蛋白酶和磷酸酶抑制剂Cocktail购自ThermoScientific公司;mTeSR1购自Stem Cell公司;基底膜基质胶(Matrigel)BD、30kD超滤管购自Millipore公司;细胞诱导因子活化素(activin)A及WNT3A购自R&D公司;RNA提取试剂盒购自QIAGEN公司;反转录PCR试剂盒购自ThermoScientific公司;SYBRGreenQ-PCR试剂购自Toyobo公司。
CO2细胞培养箱、离心机、高分辨率质谱仪(Orbitrap Fusion LumosTribrid)(ThermoFisher Scientific公司);高效液相色谱仪(AgelaTechnolo⁃gies公司);真空干燥机(Eppendorf公司)。
1.2 细胞培养及其分化潜能检测
1.2.1 细胞培养 首先将H9ESC复苏到无饲养层的培养板上,即培养在去除基质生长因子Matrigel包被的6孔培养板上,采用mTeSR1培养基,于37℃、5%CO2细胞培养箱中培养5d,之后传代,继续培养4d,待生长至80%汇合度时收集细胞。
1.2.2 细胞分化潜能检测 传代之后的细胞采用基础培养基[DMEM/F12加入15%KnockOut血清替代物(KnockOutserumreplacement,KSR),添加1%非必需氨基酸(nonessentialamino acids,NEAA)、1mmol/LGlutaMAX和55mmol/L β-巯基乙醇]进行培养,随后加入诱导因子100ng/mL活化素(activin)A和 50ng/mLWNT3A,培养至96h,每天更换培养基;期间每隔24h收集一次细胞。
1.3 免疫荧光检测
将细胞种于24孔板的小玻片上,确保细胞贴附及延展,待细胞生长2~3d后,用1×PBS清洗细胞,4%多聚甲醛溶液室温孵育固定细胞;用1×PBS清洗细胞,PBS-T室温孵育5min;PBS-B室温孵育1h封闭细胞,随后进行一抗、二抗孵育;用Hoechst染色液进行细胞核染色处理,室温孵育15min,用1×PBS清洗;滴加抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,尽量避免气泡,使细胞接触封片液,封片;用共聚焦荧光显微镜观察。
1.4 实时定量PCR
RNA提取及反转录过程按照试剂使用说明操作。实时定量PCR程序为预变性95℃ 15 min;变性95℃ 15s,退火58℃ 20s(40次循环);72℃ 30s(40次循环)。每个样本和基因均设置3个重复。
1.5 细胞收集
用DMEM/F12培养基清洗细胞,加入1mg/mL解离试剂,37℃放置7min;去除解离试剂,加入含蛋白酶和磷酸酶抑制剂的冰冷PBS吹打收集细胞,4℃、2000r/min离心5min,去除上清,保留沉淀。
1.6 蛋白提取及还原烷基化
细胞沉淀中加入含1×蛋白酶、磷酸酶抑制剂的8mol/L尿素进行细胞裂解,冰上放置30min,随后冰上超声波破碎,4℃、16000r/min离心5 min,弃沉淀和表层油脂,取上清液,用Brandford法测定蛋白浓度。取1.5mg蛋白加入DTT(终浓度为 10mmol/L),56℃水浴 30min,降至室温加入1mol/L碘乙酰胺(现配现用),避光30min,再次加入1mol/LDTT,避光静置15min,16000r/min离心10min,留取上清备用。
1.7 FASP酶解及肽段抽提
将蛋白上清液转移到2个30kD超滤管进行蛋白装填,14000r/min离心15min;加入8mol/L尿素,涡旋振荡,14000r/min离心15min,弃废液;加入50mmol/L碳酸氢铵,涡旋振荡5~10 s,14000r/min离心 15min,弃废液,除去残留尿素;更换新的套管,加入50mmol/L碳酸氢铵、1 μg/μL胰酶(质量比为1/50),振荡混匀,37℃消化12h;补充添加1 μg/μL的胰酶,振荡混匀,37℃消化 4~6h,14000r/min离心 10min,收集肽段溶液;取1/10肽段溶液于新的离心管中用于全蛋白sRP-HPLC鉴定,剩余液体用0.1%甲酸酸化处理,之后所有肽段冷冻抽干,-80℃保存。
1.8 TiO2富集磷酸化肽段
冻干的肽段溶解在含1mol/L乳酸的70%乙腈、5%三氟醋酸溶液中,然后在旋转仪上让肽段在TiO2上完成吸附,依次用30%乙腈、0.5%三氟醋酸溶液,80%乙腈、0.5%三氟醋酸溶液洗涤3次,最后用15%氨水,0%、2%、5%、8%、10%、40%乙腈分别进行梯度洗脱各1次,合并为3个馏分并酸化,除盐冻干,进行质谱鉴定[12]。
1.9 sRP-HPLC全蛋白酶切肽段分馏
用pH10的水(HPLC级)溶解肽段样本,按洗脱缓冲液梯度从低到高依次洗脱,即6%、9%、12%、15%、18%、21%、25%、30%、35%乙腈,洗脱之后将6%与25%、9%与30%、12%与35%的洗脱液合并成6个馏分,之后所有肽段冷冻抽干进行质谱鉴定。
1.10 质谱鉴定及搜库质控
1.10.1 质谱鉴定 将抽干的磷酸化肽段用10%甲酸重溶(全肽段用0.1%甲酸重溶),14000r/min离心10min,取上清进行质谱检测。色谱分析柱填料为1.9μmC18粉末,C18反相柱内径150 μm,长 15cm(Michrom Bioresources)。液相为EASY-nano-LC1200 与 OrbitrapFusionLumosTri⁃brid(ThermoFisherScientific)。流动相A为0.1%甲酸溶于水,流动相B为80%乙腈加0.1%甲酸,600nL/min流速,梯度 75min(0~16min,3%~10%B;16~51min,10% ~22%B;51~66min,22% ~30%B;66~67min,30%~95%B;67~75 min,95%B)。采用 OrbitrapFusionLumos质谱仪分析,在正离子模式下运行,离子传输管温度为320°C,正离子喷雾电压为2.0kV。一级和二级采集质量范围分别是300~1400m/z,分辨率为120000,循环时间3s。在正常化的碰撞能量下进行HCD碎裂为35%。MS2自动增益控制(AGC)目标设置为 5e3,最大注射时间(MIT)为35ms,动态排除设置为18s。
1.10.2 搜库和质控 用MaxQuant软件(1.6.1.0版本)[13]对串联质谱谱图进行检索和质控。数据库为Swiss-Prot-Human(2017年11月更新),主要参数设置如下:一级质谱容差为20ppm,二级质谱容差为0.5Da,固定修饰为半胱氨酸烷基化(carbamidomethyl,C),可变修饰为 N 端乙酰化(acetylproteinN-term)、蛋氨酸(methionine)氧化(oxidation)及丝氨酸、苏氨酸和酪氨酸的磷酸化修饰[phospho(STY)],允许的最大漏切数设置为2,肽段最小长度为7。采用正反混合库搜库策略,其中肽段假阳性率标准为FDR<0.01;采用无标定量法对蛋白进行定量分析。参照国际通用标准[14],将磷酸化位点 locationprobability≥0.75 定义为高可信度修饰位点(即class1磷酸化位点)。
1.11 生物信息学分析
1.11.1 功能富集分析 下载每个基因的GO(GeneOntology)的 BiologicalProcess注释信息。利用基于超几何分布模型的富集缺失分析方法,计算所关心的基因类别参与的生物学过程的富集/缺失P值,并基于Benjamini-Hochberg方法进行多重假设检验的校正。将富集缺失P值取对数,根据富集或缺失确定正负,富集为正,缺失为负。对得到的结果根据大小划分等级,之后采用R语言中的“pheatmap”程序包进行热图绘制。
1.11.2 激酶及转录因子调控网络分析 采用iGPS2.0[15]进行激酶预测分析;所得差异蛋白用信号网络分析(IngenuityPathwayAnalysis,IPA)软件进行转录因子与靶基因调控关系分析;运用Cytoscape绘制激酶与底物相互作用网络图。
2 结果
2.1 H9细胞状态及其分化潜能鉴定
为了确定本实验所采用的细胞处于干性状态,且具有良好的分化潜能,我们首先利用免疫荧光和实时定量PCR实验对多能性和中内胚层分化的标志分子状态和分化潜能进行了检测。结果发现,本研究所用的H9细胞中,多能性标志分子OCT4显著高表达,而中内胚层分化的标志分子EOMES、内胚层分化标志分子SOX17处于不表达状态。活化素A与WNT3A共同诱导24h后,多能性标志分子OCT4表达下降(图1A),中内胚层标志分子EOMES表达,这说明分化24h形成中内胚层;继续诱导分化至96h,OCT4及EOMES的表达量继续降低,此时内胚层标志分子SOX17高表达(图1A)。在转录水平通过实时定量PCR证实,随着诱导分化的进行,OCT4在96h表达显著降低(P<0.0001)(图1B);中内胚层的标志分子EOMES在分化24h表达量升高200倍(P<0.01),96h该基因表达量持续升高(图1C);对于内胚层的标志分子SOX17在分化24h有少量表达,96h时表达升高约80倍(图1D)。综上所述,本研究所用的H9细胞处于未分化的多能性状态,且具备分化潜能。
2.2 H9细胞(磷酸化)蛋白质组鉴定结果
为了获得高覆盖的(磷酸化)蛋白质组,我们采用FASP酶切及TAFT(一种新的磷酸化肽段富集策略)[12]对H9细胞进行了3个重复的(磷酸化)蛋白质组鉴定(图2)。
用Spearman对3次蛋白质组重复实验结果进行相关性分析,结果显示相关系数R2>0.9,P<2.2e-308(图3A),说明3次生物学重复之间的相关性较好。对鉴定到的所有肽段的质量容差进行评估,结果显示肽段信号值波动范围符合正态分布,质量误差范围为(-5,5)之间(图3B)。不同重复的蛋白Venn图分析显示,3次重复中均鉴定到的蛋白是6986种,其中磷酸化蛋白907种(图3C、D)。

图1 H9细胞多能性及分化的标志分子检测
磷酸化蛋白质组3次重复实验Spearman相关系数R2>0.8,P<2.2e-308(图 4A)。对肽段的质量容差评估显示肽段信号值波动范围符合正态分布,质量误差范围为(-5,5)之间(图4B)。Venn图分析发现3次重复中均鉴定到的蛋白2628种,磷酸化蛋白2539种(图4C、D)。3次重复实验的磷酸化肽段富集效率均在95%以上(图4E)。不同残基上发生磷酸化修饰的百分比表明,丝氨酸(S)残基上发生磷酸化修饰所占比例最大,为85.7%(图4F),其次是苏氨酸,由于酪氨酸的磷酸化修饰需要特殊的鉴定方式,因此在酪氨酸残基的磷酸化修饰位点所占比例最少,仅为1.1%。
通过对磷酸化蛋白质组和非磷酸化蛋白质组的综合分析,在hESC中共鉴定和定量8674种特异的蛋白质,包括3898种特异的磷酸化蛋白质和13676种特异的磷酸化肽段以及14584个磷酸化位点,其中11870个高可信度(class1,即lo⁃cationprobability≥0.75)磷酸化位点,该实验在每个单个样品中鉴定了超过7900种特定的蛋白质(图5A)。为了进一步评估hESC的(磷酸化)蛋白质组鉴定的覆盖范围,与Swiss-Prot数据库(2017年11月更新)和Singec等[16]发表的现有结果进行了全面比较。与数据库中已知的磷酸化蛋白和磷酸化位点相比,本研究新鉴定了511种磷酸化蛋白(图5B)和6272个磷酸化位点(图5C),这些均未包括在Swiss-Prot数据库中。在数据库中下载Singec研究的原始数据,并采用本研究使用的软件和参数进行重新搜库和质控。与Singec等发表的H9(磷酸化)蛋白质组数据集相比,我们鉴定了更多的(磷酸化)蛋白质。本研究鉴定到的(磷酸化)蛋白,磷酸肽段以及class1磷酸化位点的数量比Singec等发表的数据多1.3~3.3倍。其中仅在我们的研究中鉴定到的蛋白质数目为2743种(包括2247个磷酸化蛋白)(图5D、E),11 314磷酸化肽段和10025个Ⅰ型磷酸化位点(图5F、G)。因此,本研究获得高度覆盖的H9hESC(磷酸化)蛋白质组数据集,为干细胞干性维持机制研究提供了有价值的数据资源。

图2 H9细胞(磷酸化)蛋白质组学流程图
2.3 H9细胞中干性标志分子的鉴定情况
从蛋白质组学的角度检测未分化H9细胞中多能性标志分子的表达情况,结果如表1。多能性分子 OCT4(POU5F1)、SOX2、NANOG、DPPA4、UTF1等在蛋白水平均有表达,但各胚层分化的标志分子并未检测到,如中内胚层的EOMES[17]、T[18],中胚层的标志分子GATA4[19]、HAND1[20],内胚层的标志分子SOX17[21]、FOXA2[22]以及外胚层的标志分子PAX6[23]等。从蛋白鉴定结果来看,本研究所用的H9细胞确实处于未分化状态。同时发现这些标志胚胎干细胞多能性的分子如DPPA4、SOX2及UTF1均发生了磷酸化修饰。DPPA4能够在pT215和pS221发生磷酸化修饰,UTF1能够在pS18、pS42和pS54发生磷酸化修饰。此外,在多能性分子中共鉴定到84个class1磷酸化修饰位点,其中38个未收录在Swiss-Prot数据库中。已有报道在hESC中表观遗传调节因子DNMT3A和DNMT3B表达丰度较高且能够发生磷酸化[9,16],与3种多能性核心转录因子OCT4、SOX2和NANOG之间存在密切的相互作用[24]。总之,本研究预测到发生磷酸化修饰的多能性因子的潜在调控激酶,对H9中自我更新和多能性维持的转录因子及其靶基因之间的调控关系有了新的认识。

图3 H9细胞全蛋白质组数据质控

图4 H9细胞磷酸化蛋白质组数据质控
2.4 H9细胞中Ⅰ型磷酸化位点基序及激酶预测
利用本研究中鉴定到的高覆盖的(磷酸化)蛋白质组数据集,使用MotifX对H9细胞中主要的线性激酶基序(Motif)及激酶(Kinase)进行了预测。以Swiss-Prot数据库为背景,H9中鉴定到的11870个class1磷酸化位点中的9983个能够富集到50个线性激酶基序,包括41个pS(occur⁃ance=85,P<10-6)序列基序和 9 个 pT(occurance=14,P<10-6)序列基序(图6A,表2)。此外,还鉴定到14个未报道的线性激酶基序,如KXXXXXSP、SXXS、RXSP等(图6B)。用iGPS2.0进一步分析这些线性激酶基序中受调控的激酶,结果发现41个pS序列基序和6个pT序列基序能够被人激酶组中的251种激酶所调控,其中激酶在胚胎干细胞蛋白质组表达147个,包括属于CDK、MAPK和STKR 激酶家族的 CDKs、Erks、BMPR2和 TGFbR1等(图6A)。由脯氨酸/精氨酸或脯氨酸/赖氨酸(碱性氨基酸)介导的基序与包括CDKs、GSKs、MAPK等的CMGC组相对应;相反,由天冬氨酸或谷氨酸(酸性氨基酸)介导的基序对应于AUR和CK2激酶家族(图6A)。
2.5 H9细胞中自我更新和多能性维持的核心调控网络

图5 H9细胞(磷酸化)蛋白质组鉴定结果(A)与数据库(B、C)和已发表研究结果(D~G)的对比
为了进一步探究ESC自我更新和多能性维持的核心调控网络,重点关注了已知与自我更新和多能性相关的13个调节因子,通过对激酶-底物关系和转录因子-靶基因调控网络的分析,重构了这些调节因子的核心调控网络。在该调控网络中,TRIM28是具有最高连接度(40条边)的蛋白,表明它具有多种功能。已有研究发现TRIM28作为Myc/Zfx的共调节因子,需要在未分化的ESC中维持基因的转录抑制状态[25]。分析发现9种潜在的激酶可能参与调控hESC中TRIM28的磷酸化 ,包 括 STK25、PLK1、PKN1、PKM、MAPK7、CSNK1E、CCT2、ATRIP和ABL1。已有研究报道在hESC中表观遗传调节因子DNMT3A和DNMT3B表达丰度较高且能够发生磷酸化[9,16],与3种多能性核心转录因子OCT4、SOX2和NANOG之间存在密切的相互作用[24](图7)。总之,通过进一步预测到了发生磷酸化修饰的多能性因子的潜在调控激酶,对H9中自我更新和多能性维持的转录因子及其靶基因之间的调控关系有了新的认识。
2.6 H9细胞中磷酸化修饰水平与蛋白质丰度之间具有相同或不同趋势的蛋白质功能特征比较分析
已知磷酸化修饰水平与其相应蛋白质丰度之间的定量值具有相同或不同的趋势,推断这些趋势不一致的蛋白质在hESC自我更新和多能性维持中具有不同的功能特征。首先对肽段的磷酸化修饰水平和其相应的蛋白质丰度之间的相关性进行分析,发现两者的定量值(磷酸化肽段Intensity值和相应蛋白质的iBAQ值)存在显著但微弱的相关性(spearman相关系数=0.27,P=7.28e-178,图8A),这说明磷酸化修饰水平确实与相应蛋白总体丰度水平存在较强的不一致性,深入分析二者的不一致性及其功能特征具有重要意义。根据磷酸化肽段Intensity值的百分位数(pR_Pho)和对应的蛋白质总量(pR_Pro)的iBAQ值百分位数的分布范围,将“磷酸化肽段-蛋白质对”分成3类。第1类被定义为Pho>Pro:pR_PhopR_Pro>40%;第 2 类被定义为 Pho<Pro:pR_PropR_Pho>40%;第 3类被定义为 Pho≈Pro:|pR_PhopR_Pro|<=40%(图8A)。对这3类“磷酸化肽段-蛋白质对”进行交叠分析,这些蛋白可以划分为7类(图8B)。对5个主要类别的蛋白质进一步进行功能分析。已有研究表明大多数生物学过程大致可分为“物质流”范畴和“信息流”范畴[26],“物质流”范畴的蛋白质在物质转换和运输中起作用,“信息流”范畴的蛋白质在信息调控和转导中发挥作用。在hESC中,发现蛋白丰度低但磷酸化修饰水平高的蛋白质(Pho>Pro)在生物学功能上显著倾向于参与蛋白质翻译后修饰和代谢过程调控等“信息流”生物学过程(图8C),在通路方面则显著富集突触小泡周期,轴突导向和Hip⁃po信号通路(图8D)。而高丰度但低磷酸化修饰水平的蛋白质(Pho<Pro)则倾向于参与翻译或运输等生物学过程(“物质流”范畴)(图8C),在通路方面则主要富集了脂肪酸降解、蛋白酶体和RNA转运等通路(图 8D)。“Pho≈Pro”类蛋白质则更倾向于参与“信息流”范畴的生物学过程,包括蛋白质翻译后修饰、免疫反应和细胞通讯,以及信号转导、Rap1/钙信号通路和内吞作用通路(图8C、D)。

表1 H9细胞干性标志分子的鉴定

表1 H9细胞干性标志分子的鉴定(续)
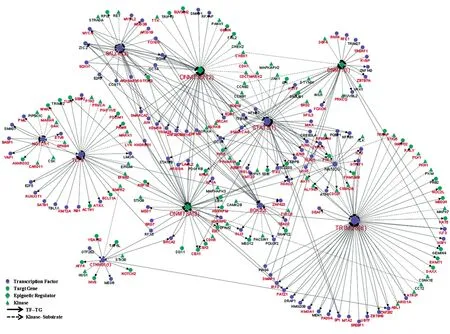
图7 hESC已知多能性因子激酶与底物及转录因子与靶基因的调控网络分析
表2列出了3种类别中涉及到的多能性相关蛋白质的功能和信号通路,这些结果表明,蛋白丰度和特定磷酸化水平显著不同的蛋白质具有不同的生物学功能类型。值得注意的是,与干性维护相关的已知监管机构分布在3个不同类别中。例如,胚胎干细胞多能性转录调控网络SALL4/OCT4成员SALL3[20]和人胚胎干细胞多能性基本调节因子 FOXO1属于“Pho>Pro”类别,表明这2种转录因子在特定残基上发生更高的磷酸化修饰以满足其调节功能。LIN28A[25-26]和TRIM28[27]作为ESC中控制自我更新的调节因子,属于“Pho<Pro”类别。LIN28A是一种翻译增强子,可将特定的mRNA驱动到核糖体上并提高蛋白质合成的效率,这是“物质流范畴”的过程。TRIM28(也被称为KAP-1)是一种转录中介因子,作为各种转录因子,特别是含有KRAB的锌指蛋白和核小体重塑复合物的支架。由于TRIM28的多功能性,它倾向于高表达。另一方面,由于它只是一个脚手架,因此并不需要很高的磷酸化修饰水平。转录因子SOX2是多能性核心调控网络[5,28-29]的成员,CTNNB1是经典Wnt信号通路的关键下游成分[30],属于“Pho≈Pro”类。这些因子的蛋白质丰度和磷酸化水平往往相对较高。这种现象表明其蛋白量和磷酸化水平的对其发挥功能具有同等的重要性。不同干性分子在这3类中均有分布,这表明胚胎干细胞在维持自我更新和多能性过程中对于不同的蛋白丰度及其修饰水平具有不同的需求。
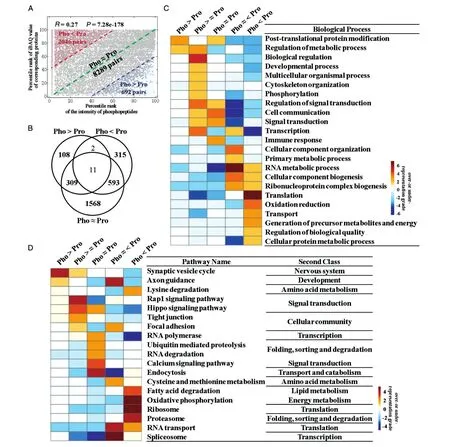
图8 H9细胞中相同或不同磷酸化修饰水平与相应蛋白丰度之间的功能特征及信号通路比较分析
3 讨论
我们采用最新的磷酸肽富集和高精度质谱鉴定技术,得到了目前覆盖度较高的H9细胞(磷酸化)蛋白质组学数据。同已有的胚胎干细胞蛋白质组和磷酸化蛋白质组数据相比,本研究鉴定到更多磷酸化蛋白及高可信磷酸化位点,为胚胎干细胞的(磷酸化)蛋白质组学研究提供了资源。基于此数据集的深入分析,得到了hESC中富集的磷酸化修饰基序及相应的激酶,发现了与hESC自我更新和多能性相关调控因子的新的磷酸化修饰位点及其相应激酶,结合其对靶基因的调控信息,构建了ESC干性维持相关的核心调控网络。同时还发现磷酸化修饰水平和蛋白总量水平不一致提示其不同的功能特征。本研究发现的重要蛋白质新的磷酸化修饰的具体功能还有待深入探究。本研究提供的数据资源和分析思路为深入解析胚胎干细胞多能性和自我更新的机制具有重要意义,结合其他组学数据再进行深入的整合分析,有望更加全面地认识胚胎干细胞多能性维持的分子机制,为更好地利用胚胎干细胞进行生物医学基础和应用研究打下基础。

表2 举例3种分类列别中多能性转录因子的基本信息
