微生物法生产香料化合物的研究
2018-06-13张媛媛李涛
张媛媛,李涛
(青岛科技大学 化工学院,山东 青岛 266000)
从化学的角度来看,香料分子由许多独特的结构和官能团组成,这些化学特性赋予它们各种不同的气味;除了食品和饮料,香料工业还囊括香水、清洁产品、肥皂、洗涤剂和口腔保健产品等。
自然界中,气味通常是动物种间或种内交流的一种形式,动物通过气味来吸引共生伙伴,震慑捕食者。有些气味分子是机体代谢物,可用作天然杀虫剂、信息素或天然产物的前体。除了供人类消费,一些合成的香料化合物还可作为高能燃料、溶剂以及药物前体。
从发展历史来说,植物提取是香料化合物最初的、主要的来源,人们深入分析植物残渣鉴别出单一组分,推动了人工合成法的发展;此后生物技术的发展则为香料生产开辟了又一可行的合成途径,并在香料高效、灵活、低能耗的生产要求下应运而生。理论上,每一种天然香味分子都对应一种生物合成方法,通过确定合适的生物合成路径和宿主,控制其代谢通量,优化基因背景并调控基因的表达,我们就能够实现目标化合物的高效生产。本文对利用各种微生物、底物及生化途径生产典型香料化合物的研究进展进行了综述。
1 乙偶姻
乙偶姻是具有黄油风味的天然物质,它是细菌发酵生产2,3-丁二醇的中间体。此前已有乙偶姻生物法生产的相关报道,如通过山梨糖菌、生膜菌作用于2,3-丁二醇获得或者通过青霉菌等真菌作用于甘蔗汁获得[1],但这些方法均不适合工业化生产。研究发现,乙偶姻的生物合成始于两分子丙酮酸缩聚生成乙酰乳酸,该过程由乙酰乳酸合成酶催化;之后乙酰乳酸脱羧酶催化乙酰乳酸脱羧生成乙偶姻。自然界中有许多微生物能够合成乙偶姻,研究较多的主要包括克雷伯氏菌属(Klebsiella)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)以及气单胞菌属(Aeromonas)等[2]。如:在相应的两种酶存在的情况下,大肠杆菌能作用于葡萄糖生成乙偶姻。使用这一方法能够得到滴定度高达870 mg/L 的乙偶姻,见表1[3]。
乙偶姻生物合成也可使用天然酵母。首先丙酮酸脱羧酶将丙酮酸活化进而形成乙醛-噻胺二磷酸酯复合物,之后该复合物再与另一分子乙醛缩合生成乙偶姻。为了优化乙偶姻的代谢通量,需将基因组中编码乙醛脱氢酶和乙醇脱氢酶的基因敲除;另外,为避免乙偶姻还原为2,3-丁二醇,编码2,3-丁二醇脱氢酶的基因也要敲除掉。这一方法使得乙偶姻的生产达到7.3 g/L,相应产量为0.07 g/g ,生产率为0.11 g/L/h ,见表1[4]。
相似的是使用枯草芽孢杆菌来生产乙偶姻,赵祥颖等[5]选育获得了一株高产枯草芽孢杆菌,称可有效转化葡萄糖生成乙偶姻,且不产生副产物丁二酮和2,3-丁二醇。在自然条件下枯草芽孢杆菌通过前述乙酰乳酸/乙偶姻代谢途径产出2,3-丁二醇;在移除2,3-丁二醇脱氢酶、提供NADH氧化酶的情况下能使乙偶姻产量提高35.3%而达到56.7 g/L,见表1[6]。
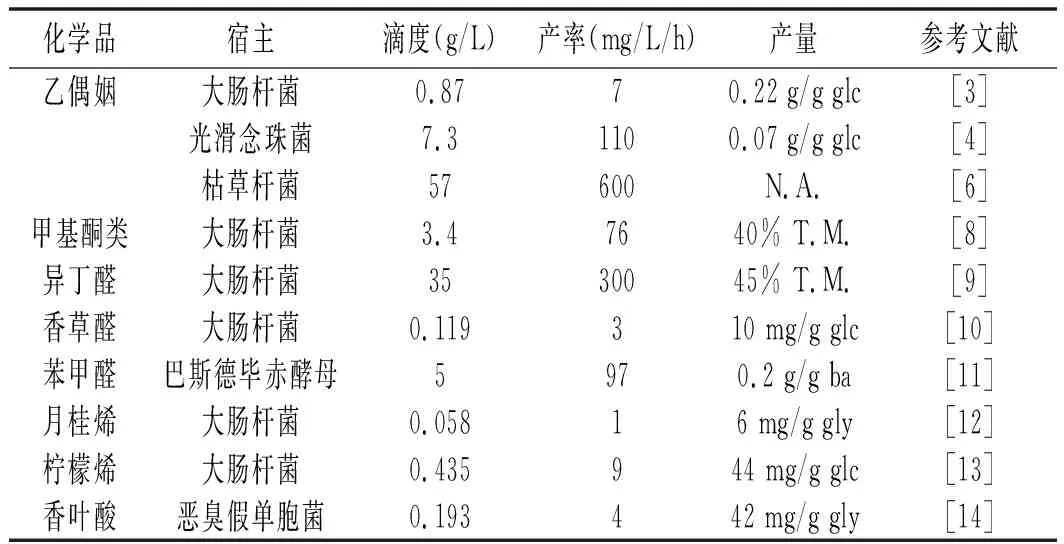
表1 微生物生产各种风味和香料化合物的滴度、产率和产量Table 1 Titer, productivity and yield for microbial productionof various flavors and flavoring compounds
注:T.M.为理论最大值;N.A.为无;glc为葡萄糖;ba为苯甲醛;gly为甘油。
2 甲基酮类
甲基酮具有精油和奶制品的香味,脂肪酸的β-氧化可产生不同长度碳链的甲基酮类化合物。大肠杆菌自有的β-氧化途径始于脂肪酸转化为酰基辅酶A,该过程由酰基辅酶A合成酶Fad D催化;之后,在酰基辅酶A脱氢酶Fad E的催化下,酰基辅酶A被氧化生成反-2-烯酰辅酶A;Fad B随后β-羟基化、氧化该物质,生成β-酮酰辅酶A;再经Fad A催化硫解断键,得到一分子乙酰辅酶A和一分子脂肪族酰基辅酶A。
生产中为了提高β-酮酰辅酶A的通量,需调控使大肠杆菌DH1中编码异源酰基辅酶A氧化酶的基因和自有的编码Fad B的基因,使其过表达,并从基因组中敲除编码Fad A的基因;另外,Fad M也被过量表达,最终使甲基酮产量提高了700倍[7]。优化脂肪酸基因的表达能大幅提高甲基酮的产量,使其在发酵45 h后达到3.4 g/L,见表1[8]。
3 醛类和醇类
异丁醛是带有支链的醛,具有葡萄酒和啤酒发酵过程中的麦芽香味,以前用于异丁醇生产的大肠杆菌代谢途径可被截断来生产异丁醛,在异丁醇制备途径中,2-酮异戊酸(产自L-缬氨酸生物合成过程)首先脱羧形成异丁醛,然后异丁醛被还原生成异丁醇。使用大肠杆菌JCL260菌株生产异丁醛需缺失大量天然异丁醛还原酶基因以使其产量达到1.5 g/L/OD600[9];原位产物移除结合相关基因缺失使得异丁醛产量最终达35 g/L(理论产量的45%),见表1。
醛还原酶基因的缺失还有助于香草醛和苯甲醛的生物合成。
大肠杆菌中存在高通量的内源性莽草酸合成途径,苏云金芽孢杆菌则能通过莽草酸途径将细胞代谢物转化为终产物;香草醛则随后由O-甲基转移酶(智人)和羧酸还原酶(car,诺卡氏菌)催化而来。通过整合这些代谢途径,敲除大肠杆菌中醛还原酶编码基因能够使香草醛产量达到119 mg/L(底物为葡萄糖,1.2%,W/V ),见表1[10]。
类似地,在大肠杆菌培养液中提供重组羧酸还原酶可以将苯甲酸盐转化为苯甲醛。甲基营养巴斯德毕赤酵母亦能实现由苄醇生成苯甲醛的生物氧化过程。在一个3 L的培养体系中,反应系统能够将70.7 g 苄醇转化成14.4 g 苯甲醛,生产率为97 mg/L/h ,见表1[11]。而且相比于苯甲酸盐途径,苄醇代谢途径效价更高并可作用于经济底物(如甲醇和甘油)。
4 萜类
萜类化合物在自然界中十分丰富,以异戊二烯为结构单元,广泛应用于制药和化妆品行业。从植物中提取萜缺乏经济性,大规模的微生物生产途径才能满足萜类化合物巨大的市场需求。
月桂烯是一种单萜,常用作香叶醇、薄荷醇这类复杂化合物的骨架。通过甲羟戊酸的异源表达途径、在tGPPS2(特异性香叶基二磷酸合酶)和月桂烯合成酶存在的条件下,大肠杆菌DH1也能够生产月桂烯。通过优化基因的表达水平、碳源、反应介质以及十二烷双分子层体系,72 h后月桂烯产量达到58 mg/L,见表1[12]。
柠檬烯具有独特的柑橘香味,是一种重要的日用品,可以被添加到许多清洁产品、化妆品和香水中。大肠杆菌中的真核甲羟戊酸类异戊二烯途径能够将乙酰辅酶A转化为活化的异戊二烯单元——异戊烯基焦磷酸酯和二甲基烯丙基焦磷酸酯,它们可以相互结合、环化形成柠檬烯及其衍生物。设计和优化该体系能够使柠檬烯的滴定度达435 mg/L(1%的葡萄糖底物浓度)[13]。
线性单萜也可由甲羟戊酸途径合成。 恶臭假单胞菌是具有高度溶剂耐受性的宿主生物且已被用作由甘油生产香叶酸的宿主。香叶酸具有甜味,木头或树叶气味,并伴有淡淡的柑橘香。在香叶醇合成酶存在的情况下,恶臭假单胞菌能通过甲羟戊酸途径生产香叶醇,而香叶醇可自发被氧化成香叶酸。通过优化甲羟戊酸代谢途径、调整反应体系为馈料式生物反应器,经过2天的反应,由4.6 g/L甘油可产出193 mg/L的香叶酸,见表1[14]。
5 结论
目前,认识和发展微生物生化合成途径已取得了一定进展,谷氨酸、香草醛和乙醇仅是利用微生物生产法得以大量生产的几个实例。由于香料化合物结构的复杂性和潜在的宿主毒性,其生产效价仍有待提高;另外,利用微生物生产香料化合物的成本较高,所以我们要设法提高微生物对此类物质的耐受性,达到足够高的反应效价;例如,当目标产物是长碳链、化学结构更复杂的化合物分子时,如何提高产量对我们而言则又是一个挑战。
微生物法制备香料化合物具有反应条件温和、产物可降解、香味纯正持久等众多优点,更符合绿色化学的时代潮流;随着生物技术日新月异的发展和相关合成、分离提取技术的进一步完善,微生物生产法将成为更具发展前景的香料合成途径。
参考文献:
[1]张小舟,曾崇余,任晓乾.乙偶姻合成研究现状及展望[J].江苏化工,2001,29(2):29-31.
[2]陈元元,吴岩,刘晓光.乙偶姻生物合成代谢调控及其应用[J].生物学杂志,2014(5):76-80,84.
[3]Nielsen D R,Yoon S H,Yuan C J,et al.Metabolic engineering of acetoin and meso-2,3-butanediol biosynthesis inE.coli[J].Biotechnol J,2010(5):274-284.
[4]Li S,Xu N,Liu L,et al.Engineering of carboligase activity reaction inCandidaglabratafor acetoin production[J].Metab Eng,2014,22:32-39.
[5]韩丽,赵祥颖,刘建军.3-羟基丁酮的研究现状[J].食品与发酵工业,2006,32(10):116-118.
[6]Zhang X,Zhang R,Bao T,et al.The rebalanced pathway significantly enhances acetoin production by disruption of acetoin reductase gene and moderate-expression of a new water-forming NADH oxidase inBacillussubtilis[J].Metab Eng,2014,23:34-41.
[7]Goh E B,Baidoo E E,Keasling J D,et al.Engineering of bacterial methyl ketone synthesis for biofuels[J].Appl Environ Microbiol,2012,78:70-80.
[8]Goh E B,Baidoo E E,Burd H,et al.Substantial improvements in methyl ketone production inE.coliand insights on the pathway from in vitro studies[J].Metab Eng,2014,26:67-76.
[9]Rodriguez G M,Atsumi S.Isobutyraldehyde production fromEscherichiacoliby removing aldehyde reductase activity[J].Microb Cell Fact,2012,11:90.
[10]Kunjapur A M,Tarasova Y,Prather K L.Synthesis and accumulation of aromatic aldehydes in an engineered strain ofEscherichiacoli[J].J Am Chem Soc,2014,136:11644-11654.
[11]Craig T,Daugulis A J.Polymer characterization and optimization of conditions for the enhanced bioproduction of benzaldehyde byPichiapastorisin a two-phase partitioning bioreactor[J].Biotechnol Bioeng,2013,110:1098-1105.
[12]Kim E M,Eom J H,Um Y,et al.Microbial synthesis of myrcene by metabolically engineeredEscherichiacoli[J].J Agric Food Chem,2015,63:4606-4612.
[13]Alonso-Gutierrez J,Chan R,Batth T S,et al.Metabolic engineering ofEscherichiacolifor limonene and perillyl alcohol production[J].Metab Eng,2013,19:33-41.
[14]Mi J,Becher D,Lubuta P,et al.De novo production of the monoterpenoid geranic acid by metabolically engineeredPseudomonasputida[J].Microb Cell Fact,2014,13:170.
