系统性红斑狼疮患者B细胞中microRNA-155的表达及干预后效应
2018-06-13陈阿琼黄茜茜叶璐璐薛向阳林巧爱朱小春李声东
陈阿琼 黄茜茜 叶璐璐 薛向阳 林巧爱 朱小春 李声东
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统的慢性自身免疫性疾病,针对细胞核抗原产生自身反应性抗体是其主要标志[1]。SLE患者的B细胞受损且不能区分自身抗原和非自身抗原,导致产生针对自身抗原的抗体并触发过度炎症反应[2]。microRNAs(miRNAs)是一类小的(21~25个核苷酸)、非编码RNA,其通过与靶向mRNA序列的碱基配对调节转录后基因的表达[3]。有时miRNA可仅以2倍差异表达来调控靶基因从而减少蛋白质表达[4]。因此,相当难以识别在发生某些疾病时产生特定miRNA的生理功能。近年来已经提出miRNAs作为SLE中免疫过程的重要调节剂[5-6]。miR-155为典型的多效miRNA,能广泛调控免疫功能,包括T和B细胞活化,炎症反应和免疫记忆[7],其通过靶向少数基因如 SHIP1[8]、SCOS1[9]和 S1PR1[10]等增强免疫应答,促进免疫系统的过度活化。在类风湿关节炎、SLE等自身免疫性疾病中均可见其发挥致病作用[11]。在狼疮小鼠模型中,miR-155的缺失减少了自身抗体的产生,可通过调节B细胞增殖来减轻狼疮样疾病[12]。为进一步探究miR-155在SLE患者B细胞中的作用,笔者检测SLE患者和健康人B细胞中miR-155的表达水平,并利用miRNA抑制剂干预后进一步检测IgG水平,现将结果报道如下。
1 对象和方法
1.1 对象 选取2011年2至12月和2014年6至12月温州医科大学第一附属医院门诊及住院的SLE患者共66例,均符合1997年美国风湿病学会修定的SLE诊断标准,男 9 例,女 57 例,年龄 28~52(39.75±10)岁。选取同院体检中心同期健康体检者10例作为健康对照组,男 2 例,女 8 例,年龄 26~50(38±12)岁,年龄与性别与SLE患者匹配。
1.2 主要试剂与仪器 Tri-Reagent BD试剂购自美国Invirtogen,miRNA检测试剂盒购于德国Qiagen公司,CD19 MicroBeads(human)购于德国 Miltenyi公司,人IgG ELISA检测试剂盒购于瑞典Mabtech公司,人淋巴细胞分离液购于天津灏洋生物公司,DEPC水购自宝生物工程(大连)有限公司,ABI 7500型定量PCR仪为美国应用生物系统公司产品,其他试剂均为分析纯。
1.3 方法
1.3.1 标本收集 采集新鲜外周静脉血5ml,EDTA抗凝,3 000r/min离心10min,用移液枪吸出上层血浆至1.5ml EP管中,细胞沉淀用于外周血单个核细胞(PBMC)的分离。
1.3.2 PBMC的分离 细胞沉淀采用0.9%氯化钠注射液1:2重悬;取6ml细胞悬液小心缓慢地用吸管加于6ml淋巴细胞分离液的液面之上,400g,离心20min;离心管中分层后,收集第二层的乳白色淋巴细胞放入含0.9%氯化钠溶液4~5ml的试管中,充分混匀。再次离心,400g,离心20min。沉淀经0.9%氯化钠溶液反复洗2次即可得到所需的PBMCs。
1.3.3 外周血B细胞的分离 磁珠分离B细胞采用阴性选择的原理,即被标记的非B淋巴细胞保留在分离柱的磁场内,而未被标记的B淋巴细胞通过了分离柱。流式细胞仪分析磁珠分选的B细胞的得率及纯度。分离的PBMCs细胞计数后,300g,离心10min,彻底吸出上清液;预冷B细胞分离缓冲液,按每107个细胞需40μl的比例加入重悬细胞;根据每107个细胞需10μl的比例加入B细胞抗体鸡尾酒试剂,混匀;放入冰箱(2~8℃)孵育5min;每107个细胞加入30μl B细胞分离缓冲液;每107个细胞加入20μlB细胞分离磁珠试剂,混匀;放入冰箱(2~8℃)孵育10min;将分离柱置于分离器适当的磁场内,缓慢将孵育的细胞悬液加到分离柱中,同时收集流出的未被标记的细胞液;加入500μl缓冲液洗柱,共3次;将分离柱移出分离柱的磁场内,立即加入适当的缓冲液,将标记的细胞推出至收集管中,即可得到分离出的B细胞。
1.3.4 流式细胞仪分析B细胞纯度 重悬细胞并计数。再将细胞悬液分为4管(106个细胞数/管),设置实验组和对照组,加入直接标记的一抗抗体,即抗人CD19-PE(1mg/1ml)5μl,终容量 100μl,具体为:实验组:B细胞+抗人CD19-PE;对照组1:B细胞;对照组2:PBMCs+抗人CD19-PE;对照组3:PBMCs。轻轻混匀后,避光,室温孵育30min;孵育完成后,加入缓冲液PBS,300g离心5min,弃去上清液,重复1次;重悬细胞后,上机检测。
1.3.5 B细胞RNA的抽提 B淋巴细胞(105个细胞数/份)加入TRIzol试剂1ml,充分混匀后室温静置5min;加氯仿 200μl,混匀后冰上静置 5min,4℃,12 000r/min离心15min,可见分层;取上层水相移至新的无酶EP管中,加入等体积异丙醇,充分混匀后,置于-20℃冰箱中过夜;4℃,12 000r/min离心15min,吸出上清液,留白色沉淀;加入1ml75%乙醇,4℃,8 000r/min离心15min后弃上清液;再次离心1min后,吸尽乙醇留白色沉淀;打开EP管盖,冰上晾干至乙醇完全挥发,再加入DEPC处理水20μl溶解RNA,测浓度后-80℃保存。
1.3.6 实时荧光定量PCR(qRT-PCR)检测miR-155的表达 取提取的RNA以miR-155茎环逆转录引物进行逆转录,20μl逆转录反应体系含:miScript Reverse Transcriptase Mix 2μl,10×miScript Nucleics Mix 2μl,5×miScript HiSpec Buffer 4μl,RNase-Free Water variable,Total RNA template 10pg-1μg,混匀,微离心置于冰上;37℃逆转录60min,95℃酶失活5min;-20℃保存逆转录产物cDNA或立即用于real-time PCR。real-time PCR:所用试剂置于冰上,取出制备好的cDNA,每个样本作2个复孔;避光操作,调制20μl反应体系:2×QuantiTect SYBR Green PCR Master Mix 10μl,10× miScript Universal Primer 2μl,10×miScript Primer Assay 2μl,RNase-Free Water variable,Template cDNA ≤2μl。反应起始条件 95℃预变性5min,循环反应条件(40个循环)94℃变性 15s,55℃退火30s,70℃延伸 30s,用 real-time PCR仪附带的软件导出原始数据,获得每个孔中荧光信号到达设定阈值时的循环数,即Ct值。
1.3.7 细胞miRNA干预实验 为评价miR-155对B细胞功能的影响,我们通过miRNA抑制剂下调miR-155的表达,采用ELISA检测细胞上清液IgG水平变化。由于常规的转染方案难以将基因导入B细胞,本研究采用电转染方式对B细胞内的miRNA进行干预。分离外周血单个核细胞,细胞计数,6孔板培养,106个/孔细胞数;清洗电转杯,75%乙醇浸泡1h后,无水乙醇浸泡0.5h后,紫外照射至乙醇完全挥发,放于-20℃过夜;6孔板内分别加入106个细胞及10μl mimics/mimics-NC/miRNA inhibitor/miRNA inhibitor-NC/Control(电转但不加 miRNA)/Blank(不电转也不加 miRNA),混匀,将溶液转移到电转杯中,按250V、10ms设置电转仪参数;将电转杯置于恒温培养箱10min,使miRNA充分进入;将细胞悬液接种于预热的培养基中培养;培养48h后,收集细胞上清液和细胞,待检测。
1.3.8 IgG抗体检测 收集的细胞上清液,12 000r/min,4℃,10min离心备用;从已平衡至室温的密封袋中取出试验所需板条;空白孔加标准品和标本通用稀释液,其余孔中加标本或不同浓度标准品(100μl/孔),用封板胶纸封住反应孔,36℃孵箱孵育90min;提前20min准备酶标抗体工作液;洗板5次;空白孔加酶标抗体稀释液,其余孔加入酶标抗体工作液(100μl/孔),用新封板胶纸封住反应孔,36℃孵箱孵育30min;洗板5次;打开酶标仪电源,预热仪器,设置好检测程序;加入显色底物(TMB)100μl/孔,避光 36℃孵箱,避光孵育 15min;加入终止液100μl/孔,混匀后即刻测量OD450值(3min内)。
1.4 统计学处理 应用SPSS 18.0统计软件,剔除CT值>35或溶解曲线不合格的数据,计量资料以表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 外周血B细胞分离及纯度鉴定 见图1。
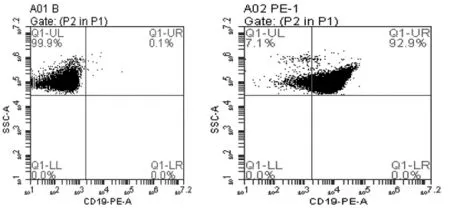
图1 B细胞纯度流式鉴定
由图1可见,A01所示为没有加CD19-PE抗体的B细胞对照管,目的是收集细胞以便划分实验管的细胞区域。A02是加有CD19-PE抗体的B细胞实验管,在对照第一管划分的基础上,PE通道的细胞有约92%,即分离的B细胞纯度能达到约92%。
2.2 SLE患者和健康对照组B细胞miR-155表达水平比较 见图2。
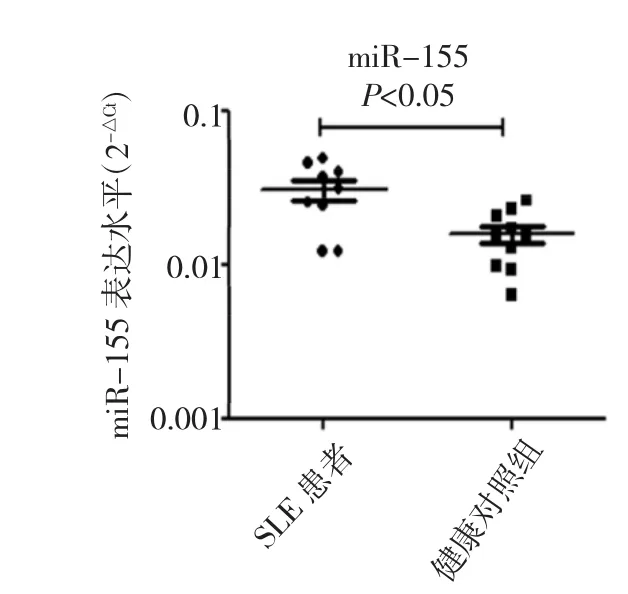
图2 SLE患者和健康对照组B细胞miR-155表达水平比较
由图2可见,与健康对照组比较,miR-155在SLE患者B细胞中表达水平明显上调(t=3.192,P<0.05)。
2.3 miRNA干预对B细胞分泌IgG的影响 见图3。
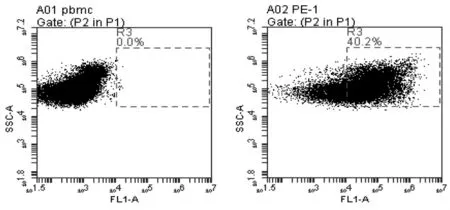
图3 B细胞miRNA电转染干预效率流式细胞仪评价
由图3可见,荧光标记的miR-155转染效率后流式细胞仪检测携带荧光的细胞数量,B细胞转染效率约40%。
2.4 SLE患者外周血B细胞miR-155干预48h后IgG水平 见图4。
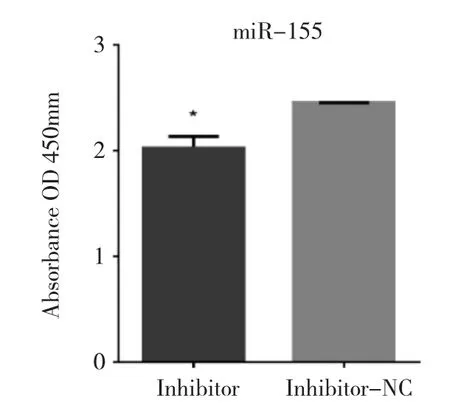
图4 SLE患者外周血B细胞miR-155干预48h后IgG水平
由图4可见,SLE患者B细胞上调表达的miR-155,通过miRNA抑制剂干预48h后,分泌的IgG水平明显降低(P<0.05)。
3 讨论
B细胞通过多重途径在SLE发病机制中起到关键作用,其中最主要途径是B细胞产生病理性自身抗体,并通过形成免疫复合物、激活补体和直接细胞毒性引起组织损伤,基于耗竭B细胞的药物,如利妥昔单抗等,在常规临床实践中用于治疗顽固性SLE[13]。有研究发现,miR-155在活化的B细胞中表达且可能发挥着重要作用[14],Vigorito等[15]发现miR-155缺乏的B细胞出现滤泡外和生发中心反应减少。本研究采用qRT-PCR,发现miR-155在SLE患者B细胞中表达上调。此外,采用miRNA抑制剂降低B细胞中miR-155的表达后,检测到细胞上清液IgG水平明显减少,提示miR-155可调控B细胞产生IgG,进一步证实miR-155是SLE患者B细胞功能相关的miRNA。miR-155在B细胞中如何发挥作用需要进一步研究。Vigorito等[15]通过miR-155-缺陷B细胞中基因表达的全基因组分析,发现总共185个蛋白编码基因受到显着影响,特别是PU.1(Ets家族转录调节子)被鉴定为B细胞中miR-155的功能靶区,野生型原代B细胞中的强制表达PU.1可导致表达IgG1细胞比例降低。多项研究数据表明miR-155-SHIP1轴也可能在调节B细胞活化和存活中起重要作用[8,16]。近期又有研究证实miR-155直接抑制Jumonji家族成员JARID2,从而减少B细胞凋亡[17]。
B细胞的过度活化被认为是SLE重要发病机制,miR-155在B细胞中的调控或许与SLE疾病发生、发展有关。2015年Liu等[18]报道在EBV等特定病毒或细菌感染后,SLE患者B细胞中的miR-155可以在TLR9诱导下靶向作用于CD1d的3′-UTR区域,从而损害B细胞的抗原呈递功能。同年Lou等[19]报道,miR-155与B细胞抗体反应有关。这些报道均证实了miR-155与SLE患者B细胞的功能息息相关。本实验也提示miR-155的过度表达可能通过促进SLE患者B细胞产生IgG,促进自身抗原抗体复合物的形成,从而诱导免疫炎症反应对机体产生损伤。当然,miR-155如何在SLE中调控B细胞发挥致病作用仍需进一步深入研究。
综上所述,miR-155从多方面影响B细胞的功能,本研究也证实miR-155在SLE患者B细胞中表达上调,且抑制miR-155可降低B细胞产生IgG,这也为改善SLE治疗提供可行的新策略。
4 参考文献
[1]Price JV,Haddon DJ,Kemmer D,et al.Protein microarray analysis reveals BAFF-binding autoantibodies in systemic lupus erythematosus[J].The Journal of clinical investigation,2013,123(12):5135-5145.
[2]Nashi E,Wang Y,Diamond B.The role of B cells in lupus pathogenesis[J].The internationaljournalof biochemistry&cellbiology,2010,42(4):543-550.
[3]Zhang B,Farwell MA.microRNAs:a new emerging class of players for disease diagnostics and gene therapy[J].Journal of cellular and molecular medicine,2008,12(1):3-21.
[4]Ebert MS,Sharp PA.Roles for microRNAs in conferring robustness to biologicalprocesses[J].Cell,2012,149(3):515-524.
[5]Amarilyo G,La Cava A.miRNA in systemic lupus erythematosus[J].Clinicalimmunology(Orlando,Fla.),2012,144(1):26-31.
[6]Shen N,Liang D,Tang Y,et al.MicroRNAs-novel regulators of systemic lupus erythematosus pathogenesis[J].Nature reviews,Rheumatology,2012,8(12):701-709.
[7]Vigorito E,Kohlhaas S,Lu D,et al.miR-155:an ancient regulator of the immune system[J].Immunological reviews,2013,253(1):146-157.
[8]O'Connell RM,Chaudhuri AA,Rao DS,et al.Inositol phosphatase SHIP1 is a primary target of miR-155[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(17):7113-7118.
[9]Rasmussen TK,Andersen T,Bak RO,et al.Overexpression of microRNA-155 increases IL-21 mediated STAT3 signaling and IL-21 production in systemic lupus erythematosus[J].Arthritis research&therapy,2015,17:154.
[10]Xin Q,Li J,Dang J,et al.miR-155 Deficiency Ameliorates Autoimmune Inflammation of Systemic Lupus Erythematosus by Targeting S1pr1 in Faslpr/lpr Mice[J].Journal of immunology,2015,194(11):5437-5445.
[11]Leng RX,Pan HF,Qin WZ,et al.Role of microRNA-155 in autoimmunity[J].Cytokine&growth factor reviews,2011,22(3):141-147.
[12]Thai TH,Patterson HC,Pham DH,et al.Deletion of microRNA-155 reduces autoantibody responses and alleviates lupus-like disease in the Fas(lpr)mouse[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(50):20194-20199.
[13]孙惠力,尹培达.利妥昔单抗治疗系统性红斑狼疮研究进展[J].中华风湿病学杂志,2006,10(6):369-371.
[14]Costinean S,Zanesi N,Pekarsky Y,et al.Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in E(mu)-miR155 transgenic mice[J].Proceedings of the National A-cademy of Sciences of the United States of America,2006,103(18):7024-7029.
[15]Vigorito E,Perks KL,Abreu-Goodger C,et al.microRNA-155 regulates the generation of immunoglobulin class-switched plasma cells[J].Immunity,2007,27(6):847-859.
[16]Pedersen IM,Otero D,Kao E,et al.Onco-miR-155 targets SHIP1 to promote TNFalpha-dependent growth of B cell lymphomas[J].EMBO molecular medicine,2009,1(5):288-295.
[17]Crepeau RL,Zhang P,Usherwood EJ.MicroRNA miR-155 Is Necessary for Efficient Gammaherpesvirus Reactivation from Latency,but Not for Establishment of Latency[J].Journal of virology,2016,90(17):7811-7821.
[18]Liu F,Fan H,Ren D,et al.TLR9-induced miR-155 and Ets-1 decrease expression of CD1d on B cells in SLE[J].European journalofimmunology,2015,45(7):1934-1945.
[19]Lou Z,Casali P,Xu Z.Regulation of B Cell Differentiation by Intracellular Membrane-Associated Proteinsand microRNAs:Role in the Antibody Response[J].Frontiers in immunology,2015,6:537.
