乙酰唑胺对IL-1β诱导的大鼠关节软骨细胞凋亡的影响及机制研究
2018-06-11陈伟娜李春梅朱仲珍
陈伟娜,李春梅,朱仲珍,蔡 莉,李 荣
类风湿性关节炎(rheumatoid arthritis, RA)是一种自身免疫性疾病,主要以慢性滑膜炎症、软骨和骨质破坏为特征。RA关节软骨细胞功能异常,丧失了合成、修复软骨基质的能力而导致软骨损伤,软骨损伤与RA严重程度和预后密切相关,保护软骨功能可以有效降低RA致残率[1]。迄今为止,水通道蛋白(aquaporins, AQPs)已在哺乳动物中鉴定和克隆出13种AQPs (AQP0~12)亚型,顾名思义,都是与水通透性相关的膜蛋白。研究[2-4]表明AQP1在RA疾病进展中发挥重要作用:AQP1在RA患者滑膜和关节软骨组织中均表达升高,AQP1能调节软骨细胞体积和基质合成,与RA软骨损伤、关节积液、滑膜炎症和关节肿胀等密切相关,调控AQP1的表达和功能可能是RA的潜在治疗靶点。该研究使用炎症因子白介素(intertleukin,IL)-1β诱导大鼠关节软骨细胞致其损伤作为软骨细胞凋亡的体外模型,观察AQP1抑制剂乙酰唑胺(acetazolamide, AZ)对IL-1β诱导的软骨细胞凋亡的影响,并从影响凋亡相关基因表达和NF-κB通路探讨其可能机制,为防治RA尤其是保护RA关节软骨提供新的思路。
1 材料与方法
1.1实验动物Sprague-Dawley大鼠(安徽医科大学实验动物中心),清洁级,雄性,2~3周龄,100~120 g。
1.2药物与试剂AZ、Ⅱ型胶原酶(美国Sigma公司);IL-1β(美国PeproTech公司);Rhodamine-123(北京索莱宝科技公司);Annexin V-FITC/PI凋亡检测试剂盒(上海贝博生物公司);MTT、Hoechst 33258 染色液(上海碧云天生物技术研究所);所有抗体购自美国Cell Signaling公司。
1.3软骨细胞的分离培养与鉴定参考文献[5]方法,分离大鼠膝关节表面软骨,37 ℃下胰酶和0.2% Ⅱ型胶原酶分别消化30 min和3 h;200目滤网过滤,1 500 r/min离心10 min,PBS清洗,收集细胞;加入含10%胎牛血清的DMEM吹打均匀后移入培养瓶,培养48 h,换液,除去未贴壁细胞,当原代培养的细胞连成片时进行消化传代。本实验中所用细胞为传1~3代的关节软骨细胞,采用光镜下观察细胞形态、Ⅱ型胶原免疫细胞化学染色和蛋白多糖甲苯胺蓝染色等进行软骨细胞的鉴定。
1.4MTT法检测细胞增殖收集大鼠关节软骨细胞,制成单细胞悬液,接种于96孔板(密度5×108/L),分为6组:正常组,IL-1β诱导组(终浓度10 mg/L,浓度参考文献[6]),AZ体外给药组(终浓度分别为12.5、25、50、100 μmol/L)。每孔100 μl,37 ℃、5% CO2培养48 h贴壁,弃去培养液。正常组不做处理,仅加入DMEM培养液培养44 h,IL-1β诱导组加入含IL-1β的DMEM培养液培养44 h,各给药组加入含IL-1β和不同浓度AZ的DMEM培养液培养44 h,每孔细胞均加入 10 μl MTT(5 g/L)继续孵育4 h后,再加入150 μl DMSO溶解细胞内结晶,室温振荡溶解,用酶标仪在570 nm测定吸光度值(即A570值)。
1.5Hoechst33258染色观察细胞凋亡将关节软骨细胞以2×108/L的细胞密度接种于6孔板(孔内预置无菌爬片),分为正常组、IL-1β诱导组和3组AZ给药组(12.5、25、50 μmol/L),每孔2 ml细胞悬液,培养48 h后弃去培养液,IL-1β组加入含IL-1β的培养基培养24 h,各给药组加入含10 mg/L IL-1β和不同浓度AZ的培养液培养24 h,PBS洗涤,4%多聚甲醛固定,0.1% TritonX通透,滴加Hoechst 33258染液(10 mg/L)避光染色30 min,荧光显微镜下观察拍照。
1.6AnnexinV-FITC/PI双染法检测细胞凋亡率各组细胞经相应处理后,吸取上清液至离心管,贴壁细胞用胰酶消化后将细胞转入对应离心管,离心,收集细胞,PBS洗涤,加入400 μl Annexin V结合液悬浮细胞,加入5 μl Annexin V-FITC染色液,4 ℃避光孵育15 min,再加入10 μl PI染色液4 ℃孵育5 min,流式细胞仪检测,采用WinMDI软件进行分析。
1.7Rhodamine-123染色观察细胞凋亡按前述方法进行细胞爬片和药物处理,PBS洗涤,加入含Rhodamine-123(终浓度10 μmol/L)的DMEM培养液,37 ℃孵育30 min,PBS洗涤,4%多聚甲醛固定15 min,PBS洗涤,封片,荧光显微镜下观察拍照。选取5个不同的视野,用ImageJ图片分析软件对各视野平均荧光强度进行分析统计。
1.8Westernblot检测相关蛋白① 各组细胞经相应处理后,加入400 μl含磷酸酶抑制剂及PMSF的裂解液,在冰上振动裂解约20~30 min;② 裂解结束后,利用刮棒将细胞刮至一侧,将细胞碎片移至1.5 ml离心管中,先涡旋10次再12 000 r/min离心取上清液于新的EP管中;③ 取适量上清液加入蛋白上样缓冲液(4 ∶1),摇匀,100 ℃煮沸10 min,冷却待用;④ SDS-PAGE电泳分离样品,转膜(PVDF膜),配置5%脱脂牛奶封闭3 h,加入一抗孵育过夜(4 ℃),二抗孵育1 h;⑤ 使用ECL发光试剂盒在显影仪中显影,采用ImageJ图片分析软件对蛋白条带灰度值进行分析处理。

2 结果
2.1软骨细胞的鉴定主要通过观察细胞形态变化、蛋白多糖及Ⅱ型胶原的表达,进行关节软骨细胞的鉴定。如图1A所示,传1代的细胞形态以梭形为主,细胞质丰富,细胞周围可见具有折光性的细胞外基质(extracellular matrix,ECM)。Ⅱ型胶原免疫细胞化学染色鉴定显示:软骨细胞胞质被染成棕色,密集生长处染色较深,表明Ⅱ型胶原存在表达(图1B)。甲苯胺蓝染色结果显示:细胞质被染成浅蓝色,胞核被染成深蓝色,有时可见双核,表明存在蛋白多糖的表达(图1C)。上述实验结果表明培养的细胞与关节软骨细胞特征一致。

图1 大鼠关节软骨细胞的培养和鉴定 ×200
2.2AZ对IL-1β诱导的软骨细胞增殖的影响MTT法检测AZ体外对IL-1β诱导的关节软骨细胞增殖的影响。如图2所示,IL-1β诱导组软骨细胞的增殖反应明显低于正常组(F=14.03,P<0.01),与IL-1β诱导组相比,AZ(12.5、25、50、100 μmol/L)体外给药能不同程度地提高IL-1β诱导的软骨细胞增殖反应,其中25、50和100 μmol/L差异有统计学意义,考虑到50 μmol/L AZ的作用优于100 μmol/L,且AZ在12.5~50 μmol /L表现出剂量依赖性(r=0.731,P<0.01),因此选择12.5、25和50 μmol/L 3个AZ浓度进行下一步研究。
2.3Hoechst33258染色观察AZ抑制IL-1β诱导的软骨细胞凋亡Hoechst 33258作为一种特异性DNA染料,通过其染色荧光强度能反应细胞凋亡情况。如图3所示,正常组软骨细胞的细胞核多数呈现均匀的蓝色荧光;IL-1β诱导组软骨细胞可见较多的染色质固缩、聚集和核碎裂,呈现出典型凋亡形态学改变,表明IL-1β诱导组软骨细胞存在异常凋亡过程;AZ体外给药组仅有少量的软骨细胞出现凋亡形态学改变,提示AZ对IL-1β诱导的软骨细胞具有抗凋亡作用。
2.4AnnexinV-FITC/PI双染检测AZ抑制IL-1β诱导的软骨细胞凋亡如图4所示,在双变量散点图上,FITC-/PI+(左上象限)表示死细胞,FITC+/PI+(右上象限)表示中晚期凋亡细胞,FITC-/PI-(左下象限)表示活细胞,FITC+/PI-(右下象限)表示早期凋亡细胞,右上和右下象限的细胞占全部细胞的比例代表细胞凋亡率(%),定量分析结果表明,与正常组(9.20±0.94)%相比,IL-1β诱导组关节软骨细胞的凋亡率(33.18±3.06)%明显增高(F=34.19,P<0.01),AZ(12.5、25、50 μmol/L)能剂量依赖性地降低IL-1β诱导的软骨细胞凋亡率(r=-0.855,P<0.01),其中AZ(25、50 μmol/L)的差异有统计学意义。
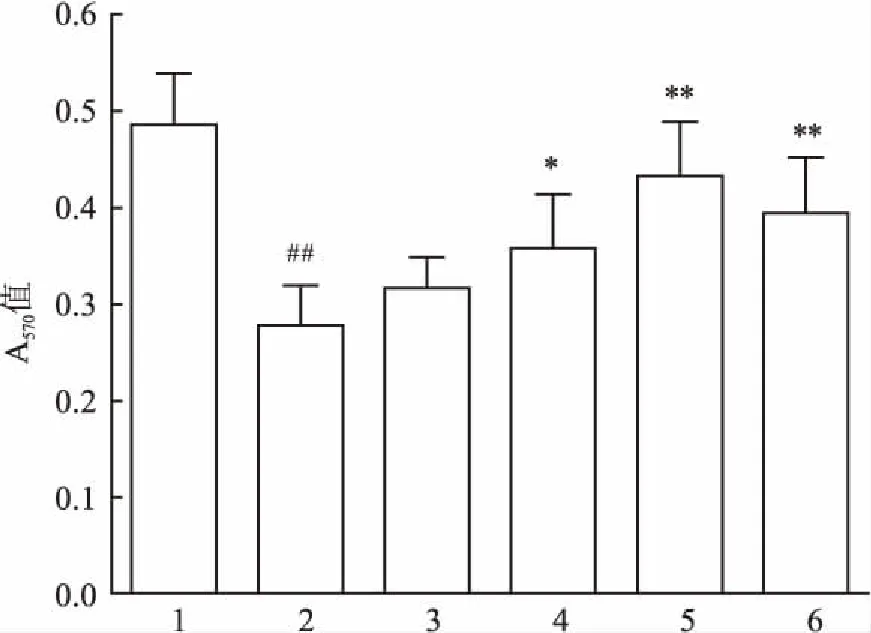
图2 AZ对IL-1β诱导的关节软骨细胞增殖的影响
1:正常组;2:IL-1β诱导组;3:AZ 12.5 μmol/L;4:AZ 25 μmol/L;5:AZ 50 μmol/L;6:AZ 100 μmol/L;与正常组比较:##P<0.01;与IL-1β诱导组比较:*P<0.05,**P<0.01
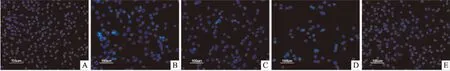
图3 Hoechst 33258 染色观察AZ抑制IL-1β诱导的关节软骨细胞凋亡 ×100
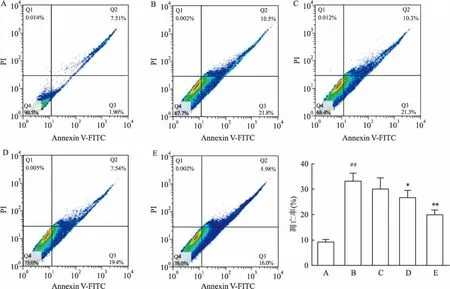
图4 Annexin-V FITC/PI 双染检测AZ抑制IL-1β诱导的关节软骨细胞凋亡
A:正常组;B:IL-1β诱导组;C:AZ 12.5 μmol/L;D:AZ 25 μmol/L;E:AZ 50 μmol/L;与正常组比较:##P<0.01;与IL-1β诱导组比较:*P<0.05,**P<0.01
2.5Rhodamine-123染色检测AZ抑制IL-1β诱导的软骨细胞凋亡线粒体能够在细胞凋亡过程中起枢纽作用,其膜电位的下降是凋亡级联反应中最早期事件。Rhodamine-123作为亲脂性阳离子荧光染料在结合到线粒体基质后,其荧光的变化说明线粒体内膜电负性的相应改变。如图5所示,正常组软骨细胞线粒体染色分布均匀,荧光强度强;IL-1β诱导组软骨细胞线粒体对Rhodamine-123的摄取能力降低,荧光强度弱;半定量分析结果表明,与IL-1β诱导组相比,不同剂量AZ处理组软骨细胞的荧光强度有不同程度的提高(F=37.41,P<0.01),其中AZ(25、50 μmol/L)差异有统计学意义。
2.6AZ对IL-1β诱导的软骨细胞中AQP1和凋亡相关基因蛋白表达的影响Western blot法检测AQP1、Bax、Bcl-2和Caspase3蛋白表达并进行统计学分析(图6)。IL-1β组软骨细胞中AQP1蛋白表达增高,AZ体外给药可以抑制AQP1蛋白表达(F=11.99,P<0.01);同时,与正常组比较,IL-1β组的Bcl-2蛋白表达显著下降(F=30.10,P<0.01),而Bax和Caspase3 蛋白表达明显升高(F=50.13、167.88,P<0.01),与IL-1β组比较,AZ体外能够提高Bcl-2蛋白表达,并且降低Bax和Caspase3蛋白表达,这可能与AZ抑制IL-1β诱导的软骨细胞凋亡的作用密切相关。
2.7AZ对IL-1β诱导的软骨细胞中NF-κB信号通路的影响Western blot法检测NF-κB信号通路相关蛋白表达并进行统计学分析(图7)。与正常组比较,IL-1β组IκB蛋白表达下降(F=172.03,P<0.01),而p-IκBα和p-NF-κB p65蛋白表达增加(F=56.19、61.84,P<0.01),与IL-1β组比较,AZ体外可以有效抑制IκBα的降解和磷酸化,并显著减少p-NF-κB p65蛋白表达,而各组细胞中NF-κB p65的蛋白表达水平无明显改变(F=0.49,P>0.01),表明AZ体外给药降低IL-1β诱导的关节软骨细胞凋亡可能通过抑制NF-κB信号通路的活化实现。
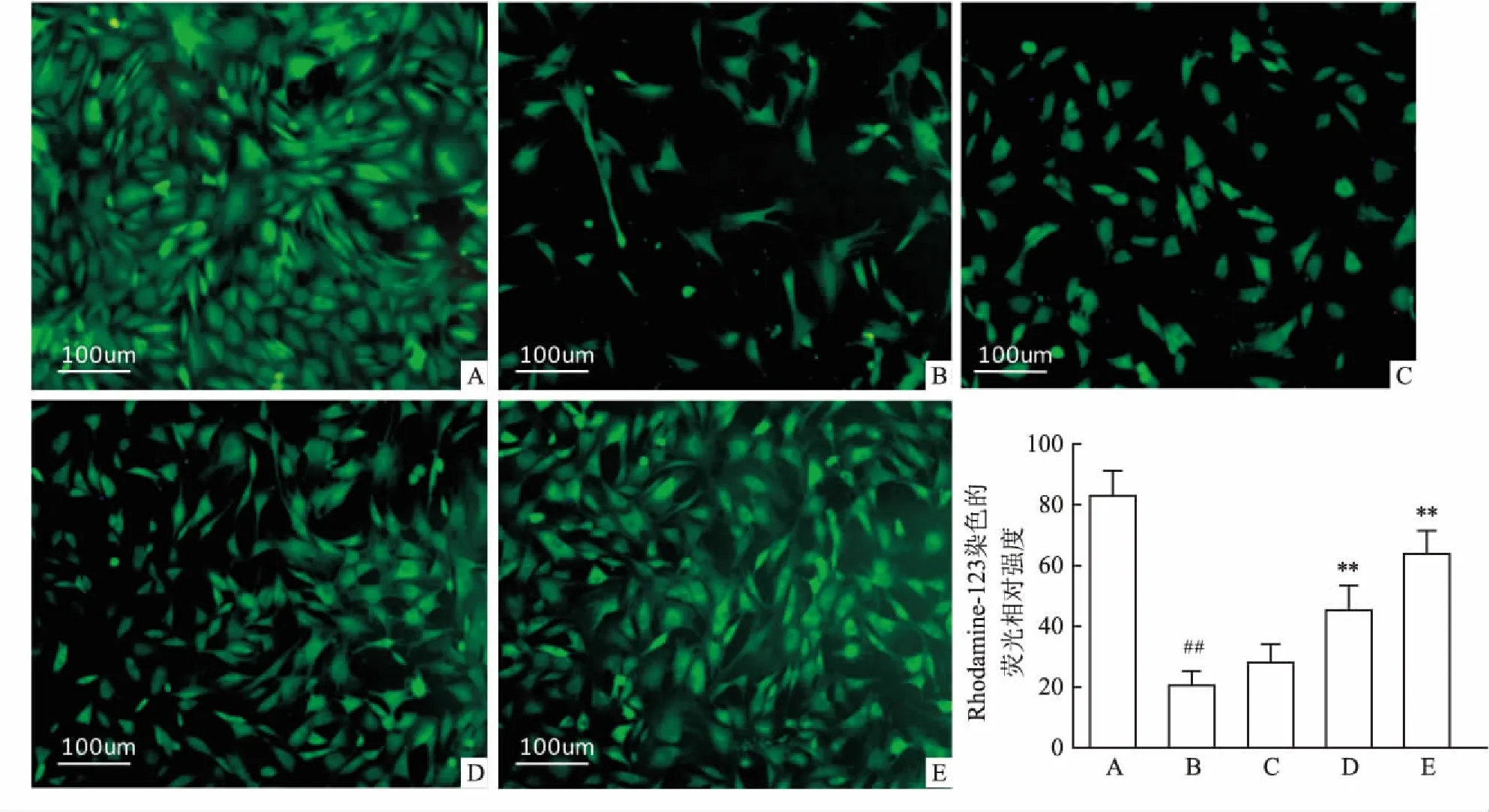
图5 Rhodamine-123染色检测AZ抑制IL-1β诱导的关节软骨细胞凋亡 ×100

图6 AZ对IL-1β诱导的软骨细胞中AQP1和凋亡相关基因蛋白表达的影响
A:各组细胞中AQP1、Bcl-2、Bax和Caspase3蛋白表达的典型条带图;B:蛋白表达的半定量分析统计图;1:正常组;2:IL-1β诱导组;3:AZ 12.5 μmol/L;4:AZ 25 μmol/L;5:AZ 50 μmol/L;与正常组比较:##P<0.01;与IL-1β诱导组比较:*P<0.05,**P<0.01
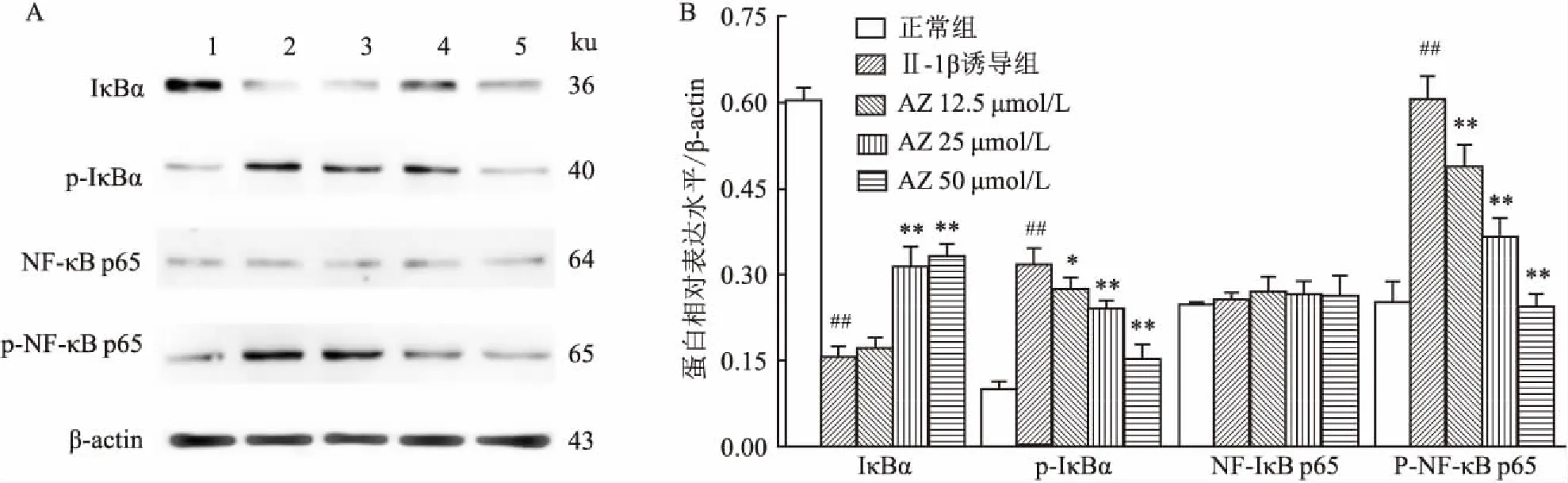
图7 AZ对IL-1β诱导的软骨细胞中NF-κB信号通路的影响
A:各组细胞中IκBα、p-IκBα、NF-κB p65和p-NF-κB p65蛋白表达典型条带图;B:蛋白表达的半定量分析统计图;1:正常组;2:IL-1β诱导组;3:AZ 12.5 μmol/L;4:AZ 25 μmol/L;5:AZ 50 μmol/L;与正常组比较:##P<0.01;与IL-1β诱导组比较:*P<0.05,**P<0.01
3 讨论
软骨细胞作为关节软骨中的唯一细胞类型,维持软骨组织乃至关节的内环境稳定。RA患者关节软骨细胞存在过度凋亡,引发关节软骨ECM迅速而广泛的损失,抑制软骨细胞凋亡有望成为RA治疗的新方法[7-9]。在RA患者滑液和血清中IL-1β是最重要的促炎细胞因子,其通过参与抑制Ⅱ型胶原、蛋白多糖的合成以及诱导软骨细胞的凋亡、刺激基质金属蛋白酶的产生从而导致软骨ECM降解诱发关节软骨损伤。现今,IL-1β诱导建立关节软骨细胞的凋亡模型已被广泛应用[6,10]。所以本研究以IL-1β诱导分离培养的大鼠关节软骨细胞使其凋亡,观察AZ体外对IL-1β诱导的关节软骨细胞凋亡的影响,并探讨其可能机制。
大量研究表明,碳酸苷酶抑制剂AZ可以显著降低AQP1介导的水通透性[11],并能够直接抑制AQP1的表达进而发挥抑制肿瘤转移和血管生成的能力[12],故AZ可以作为合适的AQP1抑制剂,与既往报道一致;本研究显示AZ体外给药能够有效抑制IL-1β诱导组软骨细胞中AQP1蛋白表达。参考既往文献中AZ的体外给药剂量,本研究采用MTT法观察了AZ(12.5、25、50、100 μmol/L)对IL-1β诱导的软骨细胞增殖的影响,结果显示AZ在12.5~50 μmol/L浓度范围内能剂量依赖性地提高IL-1β诱导的软骨细胞增殖反应。Hoechst 33258染色结果表明,IL-1β组软骨细胞呈现出典型的凋亡形态学改变如染色质固缩和核碎裂,而AZ组多数细胞呈现均匀蓝色荧光,凋亡细胞数相对减少。Annexin-V FITC/PI双染法结果表明,与正常组相比,IL-1β诱导组的细胞凋亡率显著增高,AZ体外给药可以剂量依赖性地降低IL-1β诱导的软骨细胞凋亡率。Rhodamine-123染色结果表明,IL-1β诱导组软骨细胞的荧光强度弱,不同剂量AZ处理组软骨细胞的荧光强度有不同程度的提高。上述结果提示IL-1β诱导的关节软骨细胞存在明显的细胞凋亡过程,AZ体外能够有效抑制其过度凋亡。
细胞凋亡是一种为维持内环境稳定的细胞自主性死亡,多种癌基因和抑癌基因都参与了对凋亡的调控。Bcl-2基因家族中的Bcl-2和Bax是细胞凋亡的重要调节因子,Bax介导线粒体细胞色素C的释放促进细胞凋亡,而Bcl-2与促凋亡蛋白形成异源二聚物抑制细胞凋亡[13]。作为级联反应中的关键蛋白酶,Caspase3调控各条凋亡通路,是凋亡的最终执行者,抑制Caspase3活性或功能可减少细胞凋亡[14]。文献[7,15]报道指出RA软骨组织中Bcl-2蛋白表达降低,Caspase3蛋白表达升高,与RA关节软骨细胞的异常凋亡过程密切相关。在本研究中,IL-1β诱导组中Bcl-2(抗凋亡基因)蛋白表达显著下调,而Bax和Caspase3(促凋亡基因)蛋白表达明显升高,AZ体外可以上调Bcl-2表达、下调Bax和Caspase3表达,表明AZ能够通过调控凋亡相关基因的表达进而发挥其抗凋亡作用。
NF-κB信号通路异常活化在RA的发生和发展过程中发挥重要作用,参与RA滑膜炎症和关节软骨损伤[16]。在静息状态时,胞质中的NF-κB p65与IκB结合形成无活性的二聚体;在应激状态时,IκB磷酸化并迅速降解,NF-κB p65与IκB分离,活化的NF-κB p65进入细胞核,导致众多促炎介质的产生。与既往文献[10]报道一致,IL-1β诱导组软骨细胞存在NF-κB信号通路的过度活化,表现为IκB蛋白表达下降,而p-IκBα和p-NF-κB p65蛋白表达增加。余涵 等[17]报道AZ体内给药可以抑制慢性癫痫大鼠海马组织中NF-κB信号通路的活化,与之相似,在本研究中,AZ体外给药可以提高IκB蛋白的表达水平,降低p-IκBα和p-NF-κB p65的蛋白表达水平,提示AZ可以抑制IL-1β诱导的关节软骨细胞NF-κB信号通路活化,可能与其抗凋亡作用密切相关。
