傣药“摆埋丁别”生药学鉴别研究
2018-06-01杨妮娜徐安顺赵应红王元忠
杨妮娜 徐安顺 赵应红 王元忠
(1.西双版纳傣族自治州傣医医院,云南 景洪 666100;2.中国医学科学院药用植物研究所云南分所,云南 景洪 666100; 3.云南省农业科学院药用植物研究所,云南 昆明 650200)
目前市场上药材来源比较复杂,伪劣品经常出现;不适宜的生境、栽培、采收、炮制、储存、生产、包装、运输方法等均可导致药材有效成分变化而影响其临床疗效;傣药资源地域性明显,蕴藏量有限,大面积毁林种茶、橡胶、香蕉致使多种野生资源蕴藏量急剧减少,甚至到了濒危或易危的程度,如傣百解、荷包山桂花、古山龙、蓬莱葛等。鉴于此,积极地开展傣药生药学研究,确保基源的真实性、品质的优良性、资源的可持续发展至关重要。
灯台叶傣名“摆埋丁别”,系夹竹桃科(Apocynaceae)鸡骨常山属糖胶树(Alstonia scholaris (L.) R. Br.)的干燥叶,能清火解毒、消肿止痛、止咳化痰,用于治疗“拢达儿”(腮腺、颌下淋巴结肿痛)、“农杆农暖”(乳房肿痛)、“乃多皇卖唉列特来”(肺热咳嗽痰多)、“兵洞飞暖”(疮疡疔肿)[1]。其主产于云南、广西、广东、湖南、海南、福建、台湾及东南亚各国,生长于海拔1300m以下的丘陵山地疏林中、水沟边[1,2],富含生物碱、萜类、黄酮等成分,具有抗炎镇痛、止咳平喘、抗肿瘤、调节血脂血压、调节免疫等药理活性[3-6]。灯台叶为《云南省中药材标准》(第七册)所收载品种,该标准检验项目少,缺乏定量和特征性鉴别指标,无法全面评价该药材质量优劣[7],故本研究从基源、性状、显微特征、光谱特征、薄层鉴别、定量分析等方面对灯台叶进行生药学研究,旨在为灯台叶质量标准提升、完善提供科学依据。
1 材料
1.1 仪器:TS-12D+生物组织自动脱水机、QP-生物组织切片机、CS-VI型摊片烤片机、BM-VIII生物组织包埋机(孝感市宏业医用仪器有限公司),80i Nikon 生物显微镜(日本尼康),UV-2550双通道紫外-可见分光光度计(日本岛津),Frontier型傅里叶变换红外光谱仪(美国Perkin Elmer公司),YP-2压片机(上海山岳科学仪器有限公司),1260型高效液相色谱仪(美国Agilent),GZX-9032MBE数字鼓风干燥箱(上海博讯实业有限公司医疗设备厂),电子分析天平(美国奥豪斯公司)。
1.2 试药
1.2.1 试剂:组织标本固定液(无锡市江原实业技贸总公司),TO型生物制片透明剂(广州市中南化工仪器有限责任公司经销),固绿FCF(国药集团化学试剂有限公司),番红花红T(天新精细化工开发中心),丁香油(国药集团化学试剂有限公司),分析纯甲醛溶液(汕头市达濠精细化学品有限公司),中性树胶(中国上海标本模型厂),甲醇、乙醇、乙酸乙酯、石油醚、甲酸、三氯甲烷、丙酮等分析纯试剂(天津风船化学试剂科技有限公司),分析纯溴化钾(成都化学试剂厂),色谱级乙腈、甲醇(色谱纯美国fisher)。
1.2.2 对照品:灯台叶对照药材(中国食品生物制品鉴定研究所),鸭脚树叶碱、芦丁(中国食品药品鉴定研究院),熊果酸、齐墩果酸(上海源叶生物科技有限公司)。
1.2.3 样品信息:本研究所用样品采自云南西双版纳,经西双版纳傣族自治州傣医医院赵应红傣药主任药师鉴定为夹竹桃科植物糖胶树的叶子,具体信息见表2。
2 方法与结果
2.1 原植物鉴别:乔木,高7m,直径28cm。枝轮生,皮孔密集,具白色乳汁,无毛。叶轮生,每轮3~10片,倒披针形或匙形,倒卵状长圆形、偶见椭圆形或长圆形,长7~28cm,宽2~11cm,革质,无毛,基部楔形,顶端通常圆钝或微凹,偶见急尖或渐尖;侧脉密生而平行,25~50对,近水平横出至叶缘连接;叶柄长1.0~3.0cm。聚伞花序顶生,被柔毛,总花梗长4~7cm;花梗长约1mm;花冠白色,高脚碟状,花冠筒长6~10mm,中部以上膨大,内面有柔毛,裂片在花蕾期或裂片基部向左旋转覆盖,长圆形或卵状长圆形,长2~4mm,宽2~3mm;雄蕊长圆形,长约1mm,着生在花冠筒膨大处,内藏;子房2心皮,离生,密被柔毛,花柱丝状,长4.5mm,柱头棒状,顶端2深裂;花盘环状。蓇葖2,细长,线形,长20~57cm,外果皮近革质,灰白色,直径2~5mm;种子红棕色,长圆形,两端有红棕色长缘毛,缘毛长1.5~2cm。花期6~11月,果期10月至次年4月[8]。

2.2 性状鉴别:本品呈倒卵状长圆形或长圆形,长约12~26cm,宽4~6cm。灰绿色,全缘,上表面色深且具有光泽,下表面颜色较浅无光泽;侧脉40~50条,近平行,于边缘处连接。革质。气微,味微苦。以叶厚、色灰绿者为佳。

2.3 显微鉴别
2.3.1 茎横切面组织结构:灯台树嫩茎横切片观可见木栓细胞数列,皮层、形成层、韧皮部散在分布多数草酸钙方晶和簇晶。中柱鞘有多数成片的纤维群,维管束双韧型,木质部导管单个径向。髓部宽广,细胞呈现类圆形,见图3。

2.3.2 叶横切面组织结构:叶横切面观可见表皮外有较厚角质层,主脉上下表皮内部均分布有厚角组织。薄壁细胞中含草酸钙方晶及簇晶。栅栏组织由1~2列细胞构成,延伸至中脉厚角组织处。海绵组织中散在分布较多草酸钙方晶及簇晶。中脉维管束双韧型,呈U型或V型排列。木质部导管单个径向排列。韧皮部可见乳管分布,外方有纤维断续环绕,周围细胞中有草酸钙方晶形成晶鞘[9],见图4。

2.3.3 茎粉末特征:本品粉末呈黄绿色。表皮细胞多角形增厚;木薄壁细胞呈长方形,细胞壁有连珠状增厚;草酸钙方晶较多,棱角锐尖;偶见石细胞。纤维长梭形,胞腔较大;可见网纹、具缘纹孔及梯形导管。分泌组织中可见黄色物质。

2.3.4 叶粉末特征:本品粉末黄绿色。上表皮细胞呈多角形,垂周壁较平略增厚,可见线状角质纹理;草酸钙方晶较多偶见簇晶,直径25~35μm,棱角锐尖。纤维长梭形,直径15~45μm,壁不甚厚,胞腔较大,可见晶鞘纤维。导管为网纹、螺纹,直径5~35μm。木薄壁细胞长方形,长条形,长75~125μm,宽15~45μm,壁呈链珠状增厚,纹孔明显。乳管内含黄色颗粒状物。

2.4 薄层鉴别
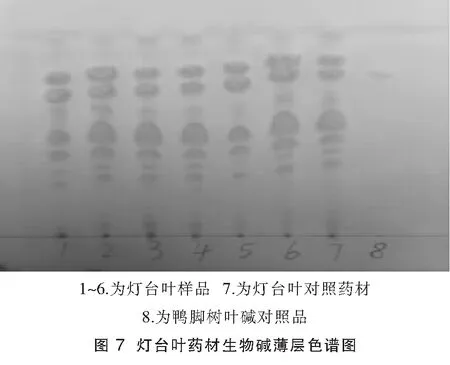
2.4.1 生物碱类成分薄层鉴别:精密称取不同批次灯台叶粉末2 g,加pH=2的盐酸水40 mL,摇匀,超声30 min,取出,干燥的玻璃漏斗过滤,滤液用浓氨试液缓慢调至颜色变为浅棕色有絮状沉淀析出(pH7~8)。用三氯甲烷20 mL萃取,取氯甲烷层,水浴蒸干,残渣加甲醇1 ml溶解作为供试品溶液。同法制成对照药材溶液。精密称取鸭脚树叶碱适量,配制成0.5 mg/mL对照品溶液。照薄层色谱法(《中国药典》一部附录)试验,吸取上述两种溶液各5 μL,分别点于同一硅胶G薄层板上,以三氯甲烷~甲醇(9:1)为展开剂,展开,取出,晾干,喷以改良碘化铋钾试液,供试品色谱中,在与对照品色谱和对照药材色谱相应的位置上,显相同颜色的橘黄色斑点。结果见图7。
2.4.2 萜类成分薄层鉴别:精密称取灯台叶粉末2g,加石油醚(30-60℃)40mL,振荡器上慢摇1h,取下,干燥玻璃漏斗过滤,弃去滤液,残渣挥干溶剂,加甲醇30mL,超声30 min,摇匀,干燥玻璃漏斗过滤,续滤液做为供试品溶液。同法制成灯台叶对照药材溶液。同法制成对照药材溶液。精密称取熊果酸对照品适量,配制成0.5 mg/mL对照品溶液。照薄层色谱法(《中国药典》一部附录)试验,取供试品溶液、对照药材溶液、对照品溶液各10μL,分别点于同一硅胶G薄层板上,以三氯甲烷:甲醇(9:1)为展开剂,展开,取出,喷以10%硫酸乙醇溶液,在105℃下烘烤15min,取出,供试品色谱中,在与对照品色谱和对照药材色谱相应的位置上,显相同颜色的紫红色斑点。见图8。

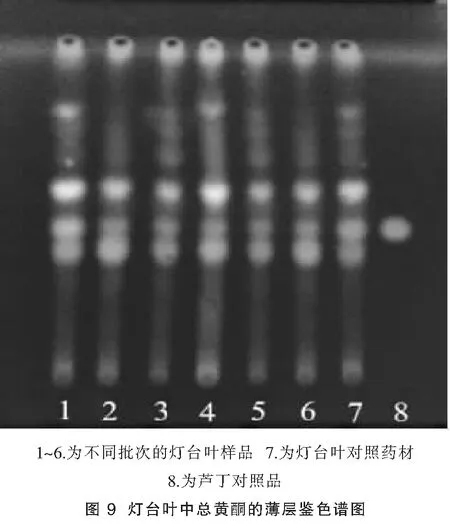
2.4.3 黄酮类成分薄层鉴别:取灯台叶粉末2 g,加甲醇20 mL,超声提取30 min,干燥玻璃滤器过滤,滤液作为供试品溶液。另去灯台叶对照药材粉末2 g,同法制成对照药材溶液。精密称取芦丁对照品适量配制成1 mg/mL对照品溶液。照薄层色谱法(《中国药典》四部附录)试验,吸取上述三种溶液各3 μL,分别点于同一硅胶G薄层板上,以乙酸乙酯-甲酸-水(8:1:1)为展开剂,展开,取出,晾干,喷以AlCl3溶液,365 nm下检视,供试品色谱中,在与对照品色谱和对照药材色谱相应的位置上,显相同颜色的黄色斑点。结果见图9。
2.5 灯台叶光谱鉴别
2.5.1 紫外可见光谱特征:精密称取灯台叶粉末0.0250 g于25 mL具塞试管中,加无水乙醇10 mL,称定重量,室温下超声提取40 min,取出,静置,再次称定,无水乙醇补足损失重量,过滤,滤液作为供试品溶液。以无水乙醇为参比液,设定扫描波长235~800 nm,狭缝宽度1.0 nm,采样间隔0.2 nm,扫描紫外-可见光谱图,每份样品平行测定3次,取平均光谱。将原始光谱图进行扣背景8点平滑处理,以消除基线漂移和光谱噪音干扰。
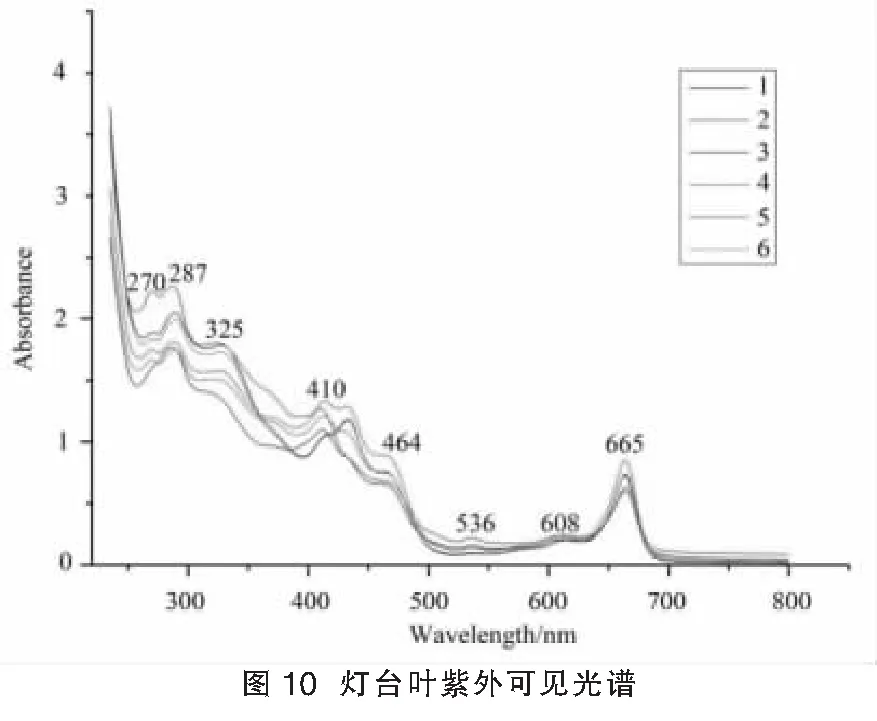
灯台叶UV-Vis光谱峰数目较多,涵盖信息量较大。根据吸收峰位置及变化的幅度可以将光谱分为三段,第一段为235~400 nm,第二段为400~500 nm,第三段为500~800 nm。第一段中吸收峰数目最多,主要集中在270 nm、287 nm和325 nm,可能是醛酮n→π*跃迁产生的R带或芳香环精细解构B带在助色团影响下红移的结果,推测可能与灯台叶中生物碱和黄酮类成分有关。同时第一段中吸光度及其变化幅度最大,体现出不同月份光谱图的指纹特征。第二段吸收峰较少主要分布在410 nm和464 nm附近,吸光度及其变化较第一段减小。第三段图谱中不同样品吸光度及变化无明显差异,但在665 nm处均有一个较大吸收峰,可能是叶绿素的吸收峰。
2.5.2 红外光谱特征:精密称定样品0.0020 g和溴化钾0.1000 g于玛瑙研钵中,充分研磨混匀后压片,每批样品平行三份。溴化钾压片置于红外光谱仪中,设定扫描范围为4000~400 cm-1,累计扫描次数16,分辨率4 cm-1,扫描后获取样品原始红外光谱。实验过程中及时扣除CO2和水分的背景干扰。原始图谱经过自动基线校正、自动平滑、纵坐标归一化处理。
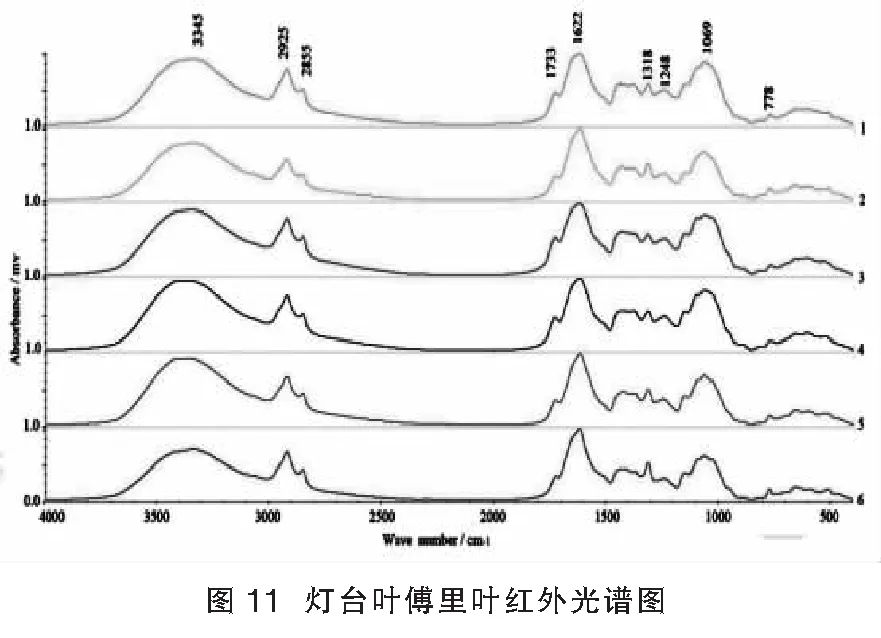
灯台叶样品在3500~2800 cm-1和1800~500 cm-1波段呈现指纹特征。吸收峰主要集中在3345、2925、2855、1733、1622、1318、1248、1069、778 cm-1。3345 cm-1吸收峰强而宽为缔合O-H伸缩振动吸收;2925 cm-1和2855 cm-1中等强度吸收峰归属为饱和C-H键的伸缩振动,即-CH2-的不对称伸缩振动和对称伸缩振动吸收峰;1733 cm-1附近中等强度吸收峰为醛羰基蓝移的结果,归属为酯羰基的伸缩振动吸收;1622 cm-1为C=C伸缩振动;1318 cm-1处弱吸收为O-H键的面内弯曲振动;1248 cm-1处中等强度吸收峰为C-O键的伸缩振动;1069 cm-1处较强吸收为C-O-C(醚键)伸缩振动;778 cm-1附近弱吸收归属为=C-H的面外弯曲振动。
2.6 含量测定
2.6.1 线性关系考察:精密称取鸭脚树叶碱、熊果酸、齐墩果酸对照品各16.1 mg、10 mg、12 mg,于10 mL容量瓶中,加色谱级甲醇溶解后定容到刻度,配制成浓度为1.61 mg·mL-1、1.0 mg·mL-1、1.2 mg·mL-1的对照品溶液。分别精密吸取鸭脚树叶碱、熊果酸、齐墩果酸对照品溶液,加甲醇稀释至不同浓度,制成单标溶液,由低至高依次进样,以浓度(mg·mL-1)为横坐标(x),峰面积为纵坐标(y)进行线性回归,得回归方程、相关系数(R2)、检测限(LOD,S/N=3)、定量限(LOQ,S/N=10)。
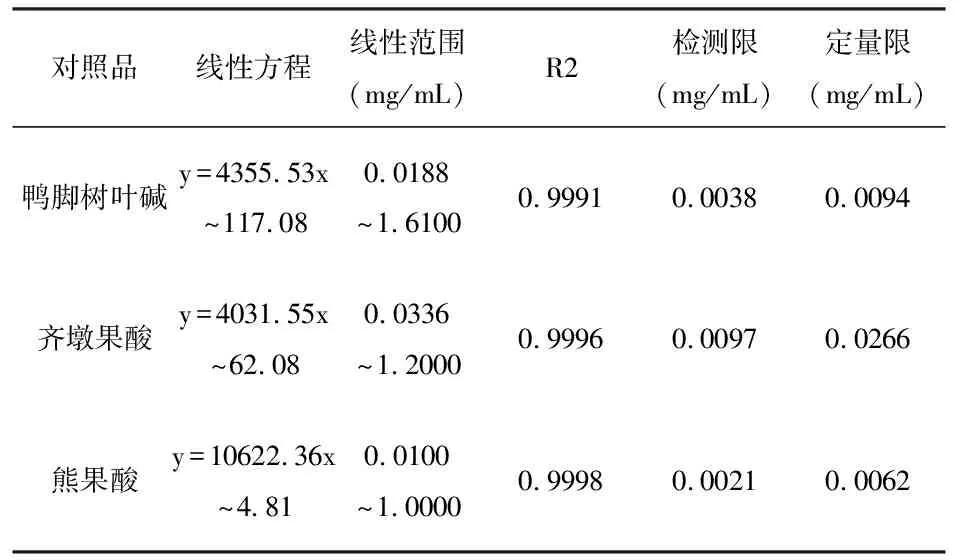
表1 鸭脚树叶碱、熊果酸、齐墩果酸线性关系考察结果
2.6.2 精密度、重复性、稳定性考察:取同一批次样品制备供试溶液,连续进样6次,计算每个成分6次峰面积的相对标准偏差,鸭脚树叶碱RSD为0.08%,熊果酸RSD为0.13%,齐墩果酸RSD为0.16%,结果表明仪器精密度良好。平行称取同一样品6份,制备供试溶液后测定,以每个成分6次峰面积RSD为参考,鸭脚叶碱0.29%,熊果酸0.64%,齐墩果酸0.53%,表明方法重复性较好。取同一批次样品,分别制备供试品溶液放置0,2,4,6,8,12,24,48 h后测定,每个成分8次进样峰面积RSD在0.29%-1.82%,表明样品供试液在48 h内稳定。
2.6.3 鸭脚树叶碱含量测定:分别取各批次样品1 g,精密称定,置洁净试管中,加pH=2的盐酸水溶液20 mL,超声提取30 min,取出,干燥玻璃漏斗过滤,滤液用氨水调至pH=8,转移至干燥的分液漏斗中,三氯甲烷萃取两次,每次20 mL,合并三氯甲烷层,水浴挥干,残渣加色谱级甲醇溶解,定容于5 mL容量瓶。采用Agilent ZORBAX Eclipse XDB C18色谱柱(250×4.6 mm, 5 μm),以乙腈-0.1%氨水(40:60)为流动相,流速1.0 mL·min-1,分别设置柱温30 ℃,检测波长287 nm,进样量10 μL。

2.6.4 熊果酸、齐墩果酸含量测定:精密称定样品0.1 g于洁净具塞试管中,加入甲醇2 mL,混匀,超声提取30 min,取出,提取液用0.22 μm微孔滤膜过滤,滤液备用。Agilent ZORBAX Eclipse XDB C18色谱柱(250×4.6 mm, 5 μm),流动相为甲醇-0.1%甲酸水(88:12),流速1.0 mL·min-1,柱温30 ℃,检测波长210 nm,进样量10 μL。
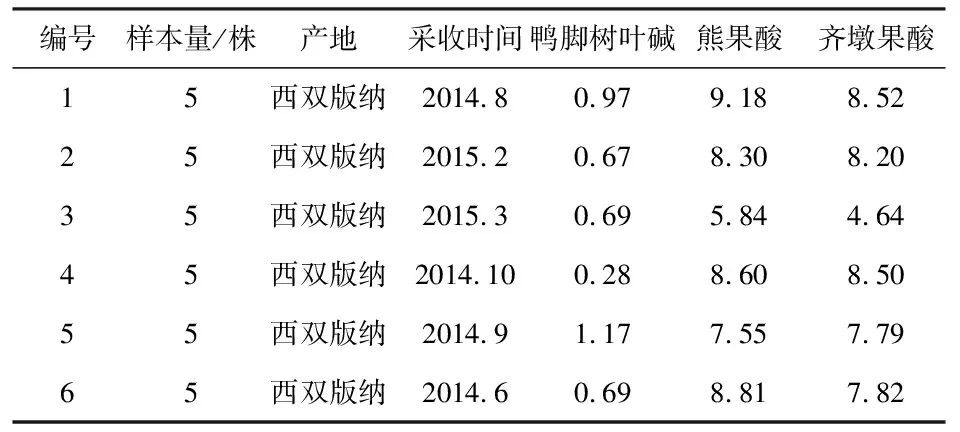
表2 不同批次样品中鸭脚树叶碱、熊果酸、齐墩果酸含量测定结果(mg·g-1)
3 结论
灯台叶原植物形态、药材形状、不同器官显微组织结构特征明显;薄层色谱分离度较好且斑点清晰;紫外可见光谱、傅里叶红外光谱吸收峰和光谱特征明显;建立的鸭脚树叶碱、熊果酸、齐墩果酸含量测定方法精密度、稳定性和重复性良好,为该药材的质量控制与资源评价提供了坚实的科学基础。
[1]林艳芳, 依专, 赵应红. 中国傣医药彩色图谱[M]. 云南民族出版社, 2003: 303-304.
[2]胡宗达, 吴兆录, 闫海忠, 等. 滇西南灯台树种植适宜区规划研究[J]. 云南大学学报(自然科学版), 2005, 27(1): 86-92.
[3]Wang CM, Chen HT, Wu ZY, et al. Antibacterial and Synergistic Activity of Pentacyclic Triterpenoids Isolated from Alstonia scholaris[J]. Molecules, 2016, 21: 139.
[4]Kandhare AD, Patil MV, Bodhankar SL. Ameliorative Effect of Alkaloidal Fraction of Leaves of Alstonia scholaris Against Acetic Acid Induced Colitis via Modulation of Oxido~nitrosative and Pro~inflammatory Cytokines[J]. Pharmacologia, 2016, 7: 170-181.
[5]Arulmozhi S, Mazumder PM, Lohidasan S, et al. Antidiabetic and antihyperlipidemic activity of leaves of Alstonia scholaris Linn. R. Br.[J]. Eur J Integr Med, 2010, 2: 23-32.
[6]Ragasa CY, Lim KF, Shen CC, et al. Hypoglycemic potential of triterpenes from Alstonia scholaris[J]. Pharm Chem J, 2015, 49: 30-33.
[7]云南省食品药品监督管理局. 云南省中药材标准第七册[S]. 云南出版集团云南科技出版社, 2005.
[8]中科院植物志编委会. 中国植物志[M]. 科学出版社, 1977: 90.
[9]Khyade MS, Vaikos NP. Pharmacognostical studies on the Leaves of Alstonia scholaris R. Br.[J]. Journal of Pharmacy Research, 2009, 2(5): 858-861.
