大米肽中压离子交换色谱分离及其免疫活性评价
2018-05-31程云辉GYunhui毛田米陈茂龙
程云辉G Yun-hui 毛田米 - 黄 璐 陈茂龙 - 文 李 许 宙
(长沙理工大学化学与生物工程学院,湖南 长沙 410114)
基于酶法降解食源性蛋白质并结合分离纯化技术从酶解肽混合物中获得活性肽一直被当作筛选食源性活性肽的经典方法[1],本课题组[2]前期已基于蛋白质酶解物疏水性的差异,通过DA201-C型大孔吸附树脂从大米蛋白质胰酶(Trypsin)酶解物中分离出具有较强免疫活性的RPHs-A3(Rice protein hydrolysates-40% ethanol fraction)组分;为进一步提高RPHs-A3组分的纯度和免疫活性,拟基于RPHs-A3组分带电性的差异,继续采用离子交换色谱对其进行分离纯化。
中压液相色谱压力范围为0.5~2.0 MPa,其压力介于低压与高压液相色谱之间。与低压柱色谱相比,具有分辨率高、分离速度快、可梯度洗脱等优势;与高压液相色谱相比,尽管在稳流、精度、检测灵敏度方面还有差距,但其制备量大、可自主填充分离柱填料而提高分离选择性等特点,使其成为近年来备受关注的活性肽分离纯化新方法[3-4]。WorkBeads 40 Q是一种以季氨基为官能团的强阴离子交换剂,具有载量高、重复性与化学稳定性好等特点,在实验室或工业规模分离纯化蛋白质、多肽和核酸等领域具有良好的应用前景。
本研究拟以小鼠巨噬细胞RAW264.7 MTT增殖试验SI值和脂多糖(LPS)炎症模型NO释放量为双考察指标,利用WorkBeads 40 Q对RPHs-A3组分进行分离纯化,在考察不同分离条件对大米免疫活性肽分离效果影响的基础上,确定中压离子交换色谱分离RPHs-A3的最佳条件,并进一步提高RPHs-A3组分的纯度和免疫活性,为中压离子交换色谱技术在活性肽分离纯化中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大米蛋白:碱提酸沉法提取;
胰蛋白酶:合肥博美生物科技有限公司;
二甲基亚砜(DMSO)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT):上海生物工程有限公司;
DMEM培养基:美国HyClone公司;
胎牛血清(FBS):美国Gibco公司;
小鼠巨噬细胞(RAW264.7):江苏省原子医学研究所;
Work Beads 40 Q:杭州开泰生物技术有限公司;
氯化钠、无水乙醇、氢氧化钠、Tris、盐酸:分析纯试剂,上海国药集团有限公司;
其他试剂:分析纯。
1.1.2 主要仪器设备
台式pH计:DELTA320型,江苏金坛市金城国胜实验仪器厂;
可见分光光度计:22PC型,上海棱光技术有限公司;
玻璃层析柱:2.6 cm×40 cm色谱柱,利穗科技有限公司;
全自动蛋白质纯化系统:APPS MV 100D型,利穗科技有限公司;
酶标分析仪:DNM-9602型,北京普朗新技术有限公司;
恒温培养箱:DNP-9052型,苏州威尔实验用品有限公司。
1.2 方法
1.2.1 大米活性肽RPHs-A3组分的制备工艺流程
一定底物浓度大米蛋白悬浮液→调pH值→一定温度下超级恒温水浴酶反应器中溶解30 min→按不同底物浓度、加酶量、pH值、温度进行酶解(pH-stat法使体系pH稳定)→灭酶(85 ℃,15 min)→离心(3 500 r/min,15 min)→上清液→真空浓缩(终体积为5~10 mL)→冷冻干燥(-45 ℃,30 Pa 以下,40 h)→大米蛋白酶解物RPHs→DA201-C型大孔吸附树脂吸附、脱盐→40%乙醇洗脱→RPHs-A3组分[5]
1.2.2 中压离子交换色谱分离方法
(1) 离子交换剂的选择:采用强阴离子交换树脂WorkBeads 40 Q对RPHs-A3组分进行分离纯化。前期研究确定RPHs-A3组分的等电点范围为pH 2.25~3.50,因此使RPHs-A3组分带负电的pH范围为pH>3.50,又因WorkBeads 40 Q的pH稳定范围为2~13,故选择WorkBeads 40 Q对RPHs-A3组分进行分离纯化。
(2) 起始缓冲液pH的选择:采用试管小试法[6]98-99确定缓冲液起始pH。首先分别配制0.50,0.01 mol/L的不同pH的缓冲液,pH以1.0为梯度,从2.0增至11.0。取10 mL的试管,每管加入1.5 mL树脂,然后依次在每支试管中加入0.5 mol/L的不同的缓冲液10 mL,混合一段时间后弃去上清液,如此反复洗涤10次。再换用0.01 mol/L的缓冲溶液,每次10 mL反复洗涤5次[7]。向洗涤好的树脂中分别加入等量浓度相同的大米免疫活性肽溶液,充分混合后,放置5~10 min后,测定上清液中未被吸附的蛋白含量。
(3) 中压离子交换色谱分离RPHs-A3组分的条件:将处理好的Work Beads 40 Q树脂填充到2.6 cm×40 cm规格的玻璃柱中,用0.01 mol/L的Tris-HCl缓冲液(pH 9.0)以10 mL/min的速度平衡层析柱3~4 BV;用平衡缓冲液配制浓度为30 mg/mL的大米免疫活性肽溶液,上样量5 mL,上样流速0.5 mL/min;上样结束后,用平衡缓冲液以10 mL/min 的流速进行洗脱,在220 nm波长下检测洗脱液吸光值,收集穿透峰;然后用0.0~0.5 mol/L的NaCl进行梯度洗脱,收集洗脱峰;对各组分进行脱盐后浓缩干燥,得到不同分离组分。
1.2.3 RPHs-A3分离组分免疫活性的测定
(1) 小鼠巨噬细胞增殖试验:采用MTT法,取对数期的RAW264.7细胞,细胞浓度为7×105个/mL、100 μL并接种于96孔板中,在37 ℃、5% CO2的培养箱中孵育4 h后,加入大米免疫活性肽,空白对照组加等量的无菌水,阳性对照组加等量IgG,继续在培养箱中孵育20 h;在终止孵育前4 h加入20 μL MTT(5 mg/L);弃掉每孔中的液体,向孔中加入150 μL二甲基亚砜,避光条件下轻震5 min[8],采用酶标仪在492 nm检测吸光度(OD值),并按式(1)计算SI值。
(1)
式中:
SI——细胞增殖指数;
OD1——试验组OD值;
OD2——对照组OD值。
(2) 小鼠巨噬细胞RAW264.7的NO释放量的测定:当培养皿中的细胞生长至对数期时,弃去细胞培养基上清,用移液枪吸取无菌PBS将细胞轻轻吹下,离心收集细胞,96孔培养板中接种3×104个/孔的细胞,每孔200 μL细胞液,在37 ℃、5% CO2培养箱中培养过夜,待细胞贴壁后,以3复孔为一组,分为对照组、LPS炎症模型组、RPHs-A3和RPHs-A3-B(1~5)预处理组,根据文献[9]修改如下:
① 对照组:均加入含10% FBS的DΜEM培养基;
② 炎症模型组:加入含10% FBS的DΜEM培养基,培养12 h,再加入用DΜEM培养基稀释的LPS溶液,培养24 h;
③ RPHs-A3和RPHs-A3-B(1~5)预处理组:加入用DΜEM培养基稀释的RPHs-A3和RPHs-A3-B(1~5)溶液,使RPHs-A3和RPHs-A3-B(1~5)的终浓度均为50 μg/mL,阳性对照组加等量IgG,培养12 h,加入用DΜEM培养基稀释的LPS溶液,培养24 h。
收集细胞培养基上清,于4 ℃、12 000×g低温离心5 min 以去除细胞杂质等。用GRIESS法检测上清中的NO含量。并按式(2)计算NO抑制率。
(2)
式中:
IR——NO抑制率;
c1——LPS刺激产生NO浓度;
c2——RPHs-A3-B(1~5)预处理后产生NO浓度。
2 结果与讨论
2.1 中压离子交换色谱分离条件的优化
2.1.1 试管小试法确定缓冲液起始pH 缓冲液起始pH值的选择对离子交换色谱吸附特性很关键[10],缓冲液起始pH决定了RPHs-A3组分及WorkBeads 40 Q的带电状态,确保WorkBeads 40 Q带充足电荷的同时决定了RPHs-A3组分带电荷的种类和数量,是RPHs-A3组分是否发生吸附的重要参数[6]86。本研究考察了在不同缓冲液起始pH下WorkBeads 40 Q对RPHs-A3组分的吸附效果,结果见表1。由表1可知,起始pH对RPHs-A3组分吸附效果影响较大,在pH为9.0的条件下,上清液中RPHs-A3组分的含量最低,为2.01 mg/mL,说明在此pH条件下RPHs-A3组分在WorkBeads 40 Q树脂上的吸附量最大,因此确定pH 9.0为最佳起始pH。
表1不同起始pH下WorkBeads 40 Q对RPHs-A3的吸附†
Table 1 The Adsorption of RPHs-A3 by WorkBeads 40 Q at different initial pH

起始pH含量/(mg·mL-1)起始pH含量/(mg·mL-1)2.05.657.04.903.05.488.04.164.05.449.02.015.05.1710.02.716.05.4111.03.11
† 上样浓度5 mg/mL。
2.1.2 离子强度变化方式对RPHs-A3组分分离效果的影响
WorkBeads 40 Q强阴离子层析柱的分离原理是基于溶质分子所带电荷性质和电荷量的不同而使其在层析柱中移动速度不同来实现分离的[11]。本研究探索了不同离子强度变化方式对WorkBeads 40 Q分离纯化RPHs-A3组分的影响,以确定最佳分离条件。选择起始缓冲液为pH 9.0、0.01 mol/L 的Tris-HCl缓冲液,极限缓冲液为含0.5 mol/L NaCl的pH 9.0、0.01 mol/L的Tris-HCl缓冲液,通过中压液相色谱将2种缓冲液按一定比例混合,可以得到NaCl浓度在0.0~0.5 mol/L连续变化的离子强度梯度。图1为采用梯度洗脱方式分离RPHs-A3组分的图谱,由图1可知,随着离子强度的增大,RPHs-A3组分依次被分为5个组分,选择性差导致分辨率较低,分离效果较差;图2为采用阶段洗脱方式分离RPHs-A3组分的图谱,由图2可知,阶段洗脱方式对RPHs-A3组分的分离效果较好,选择性好,分辨率较高。RPHs-A3组分在不同的离子强度下依次被分为5个组分,穿透峰RPHs-A3-B1为未被吸附的部分,组分RPHs-A3-B2、RPHs-A3-B3、RPHs-A3-B4、RPHs-A3-B5依次为含0.05,0.10,0.20,0.30 mol/L NaCl的pH 9.0,0.01 mol/L的Tris-HCl缓冲液从离子交换剂上洗脱下来的组分。由于起始缓冲液的离子强度较低,RPHs-A3组分与WorkBeads 40 Q上季氨基之间结合能力更强,能取代缓冲液离子而吸附到WorkBeads 40 Q上。但随着离子强度增大,缓冲液离子会与RPHs-A3组分竞争结合WorkBeads 40 Q,从而减弱了RPHs-A3组分与WorkBeads 40 Q之间的静电作用力,首先使一些带净电荷较少、吸附得不太牢固的活性肽解吸而被洗脱下来;继续增大离子强度,使结合得更为牢固的一些活性肽被洗脱,各个组分将在特定离子强度的缓冲液中被洗脱下来,从而实现分离[12]。比较图1和图2可知,阶段洗脱分离RPHs-A3组分的效果要优于梯度洗脱。由于梯度洗脱的离子强度是连续增加的,洗脱峰也连续被洗脱下来,选择性较差导致分辨率降低;阶段洗脱的离子强度是逐级增加的,各级洗脱峰相距较远,分辨率提高。本研究后续将选择阶段洗脱方式对大米免疫活性肽RPHs-A3组分进行分离纯化。

色谱柱尺寸为2.6 cm×40 cm;离子交换剂为WorkBeads 40 Q;样品为5 mL、20 mg/mL RPHs-A3组分;平衡缓冲液A为pH 9.0,0.01 mol/L Tris-HCl;洗脱缓冲液B为含1 mol/L NaCl的pH 9.0,0.01 mol/L Tris-HCl;上样流速1 mL/min;洗脱流速10 mL/min
图1 离子强度线性洗脱分离RPHs-A3组分图谱
Figure 1 The separation of fraction RPHs-A3 by linear elution of different ionic strength
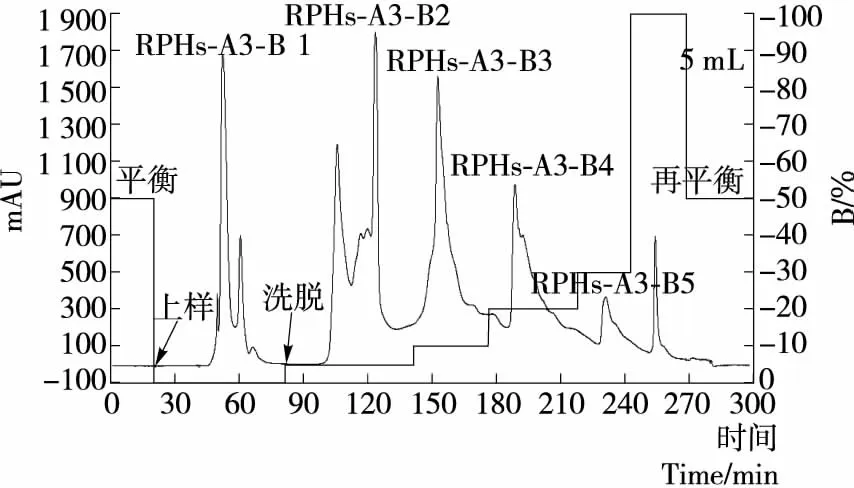
色谱柱尺寸为2.6 cm×40 cm;离子交换剂为WorkBeads 40 Q;样品为5 mL、30 mg/mL RPHs-A3组分;平衡缓冲液A为:pH 9.0,0.01 mol/L Tris-HCl;洗脱缓冲液B为含1 mol/L NaCl的pH 9.0,0.01 mol/L Tris-HCl;上样流速1 mL/min;洗脱流速10 mL/min
图2 离子强度阶段洗脱分离RPHs-A3组分图谱
Figure 2 The separation of fraction RPHs-A3 by stage elution of different ionic strength
2.1.3 上样量对RPHs-A3组分分离效果的影响 本研究探索了上样量对分离效果的影响,在不同上样量条件下WorkBeads 40 Q对RPHs-A3组分的分离效果见图3。由图3可知,随着上样量的增加,分离效果逐渐变差,分辨率降低,其原因是上样量过大超出了WorkBeads 40 Q的有效交换容量。兼顾考虑分离效率,在保证分离效果的前提下通常会选择大的上样量,故以30 mg/mL、5 mL为最佳上样量。本研究选用WorkBeads 40 Q强阴离子交换树脂、2.6 cm×40 cm色谱柱对RPHs-A3组分进行分离的较佳条件确定为:上样浓度30 mg/mL,上样量5 mL,平衡缓冲液A为pH 9.0的0.01 mol/L Tris-HCl,洗脱缓冲液B为含1 mol/L NaCl的pH 9.0、0.01 mol/L Tris-HCl,上样、洗脱流速分别为1,10 mL/min。
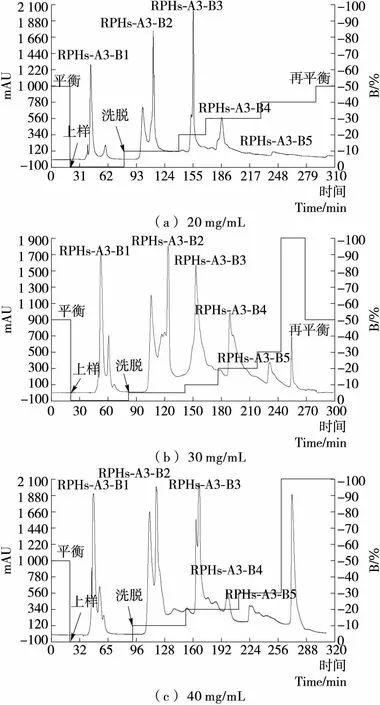
色谱柱尺寸为2.6 cm×40 cm;离子交换剂为WorkBeads 40 Q;样品为5 mL不同浓度的RPHs-A3组分;平衡缓冲液A为:pH 9.0,0.01 mol/L Tris-HCl;洗脱缓冲液B为含1 mol/L NaCl的pH 9.0,0.01 mol/L Tris-HCl;上样流速1 mL/min;洗脱流速10 mL/min
图3 不同上样量条件下RPHs-A3组分分离图谱
Figure 3 The separation of fraction RPHs-A3 under different loading conditions
2.2 中压离子交换色谱分离组分免疫活性的研究
本研究分别以小鼠巨噬细胞RAW264.7 MTT增殖试验SI值和脂多糖(LPS)炎症模型细胞内NO释放量为考察指标,考察了中压离子交换色谱各分离组分的免疫活性,结果见图4、5。

*与对照相比,P<0.05;**与RPHs相比,P<0.01;B1、B2、B3、B4、B5分别对应RPHs-A3-B1、RPHs-A3-B2、RPHs-A3-B3、RPHs-A3-B4、RPHs-A3-B5,A3对应RPHs-A3
图4 RPHs-A3-B(1~5)对小鼠巨噬细胞RAW264.7增殖活性的影响
Figure 4 The effect of fractions RPHs-A3-B(1~5) on proliferation of Murine Macrophage RAW264.7
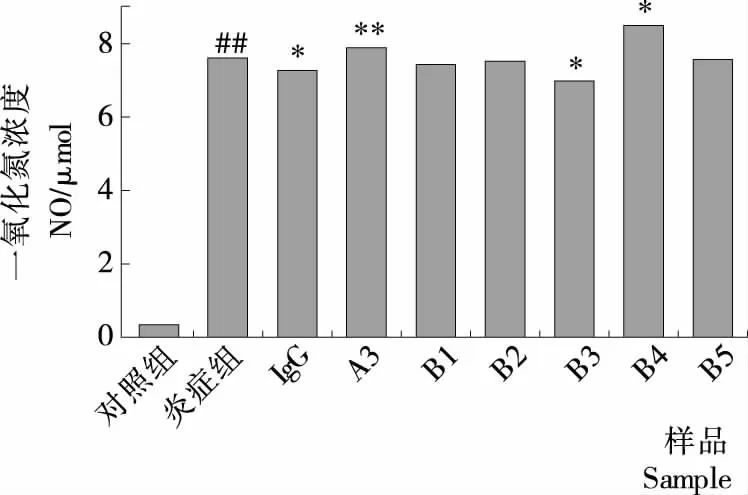
##与对照相比,P<0.01;*与炎症组相比,P<0.05;**与炎症组相比,P<0.01;B1、B2、B3、B4、B5分别对应RPHs-A3-B1、RPHs-A3-B2、RPHs-A3-B3、RPHs-A3-B4、RPHs-A3-B5,A3对应RPHs-A3
图5 RPHs-A3-B(1~5)对脂多糖(LPS)炎症模型NO释放的影响
Figure 5 The effect of fractions RPHs-A3-B (1~5) on intracellular NO release inlipopolysaccharide (LPS) inflammation model
从图4可知,组分RPHs-A3-B2、RPHs-A3-B3、RPHs-A3-B5对RAW264.7细胞皆具有较好的增殖作用,其SI值分别为1.152,1.315,1.206,与RPHs-A3组分(SI值为1.273)相比,RPHs-A3-B3组分的SI值显著提高(P<0.05)。
由图5可知,50.00 μg/mL的各分离组分对NO释放的抑制效果有着明显差异,RPHs-A3-B4对NO释放无抑制作用;RPHs-A3-B1、RPHs-A3-B2和RPHs-A3-B5 3个组分对NO释放有抑制作用,但效果不显著;而RPHs-A3-B3组分则对NO释放具有显著抑制作用(P<0.05),NO浓度可由LPS刺激的(7.605±0.000) μmol降至(6.975±0.008) μmol(P<0.05),抑制率为8.28%。MTT试验活性检测结果和炎症模型活性检测结果皆表明中压离子交换色谱分离纯化获得的免疫活性最佳组分为RPHs-A3-B3,后续研究拟将采用低压凝胶过滤色谱继续对其进行分离纯化。
3 结论
中压色谱是对常压色谱的延续与发展,具有分辨率高、分离速度快、可梯度洗脱、制备量大、可自主填充分离柱填料等优点。目前多用于天然产物的分离纯化,在生物活性肽领域里的应用较少,还有待进一步的研究。本研究表明中压离子交换色谱能显著提高大米免疫活性肽RPHs-A3组分的免疫活性,使其SI值从1.273提高到1.315(P<0.05),且对细胞内NO释放的抑制率为8.28%(P<0.05)。本研究不仅得出了中压离子交换色谱分离纯化大米免疫活性肽RPHs-A3组分的最佳条件,同时也为中压离子交换色谱技术在活性肽分离纯化中的应用提供了理论依据。
[1] 陈月华, 程云辉, 许宙, 等. 食源性生物活性肽免疫调节功能研究进展[J]. 食品与机械, 2016, 32(5): 209-213.
[2] 王璐, 陈月华, 许宙, 等. 大米免疫活性肽水解用酶的筛选[J]. 食品与机械, 2015, 31(2): 38-42.
[3] 徐嘉, 杨骏, 黄孝春, 等. 连翘酯苷反相硅胶中压制备工艺的优化[J]. 中国药师, 2012, 15(1): 47-50.
[4] FENG Jia-tao, XIAO Yuan-sheng, GUO Zhi-mou, et al. Purification of compounds from Lignum Dalbergia Odorifera, using two-dimensional preparative chromatography with Click oligo (ethylene glycol) and C18 column[J]. Journal of Separation Science, 2011, 34(3): 299-307.
[5] 卜汉萍. 大米免疫活性肽的制备及分离纯化[D]. 长沙: 长沙理工大学, 2014: 15-16.
[6] 田亚平, 周楠迪. 生化分离原理与技术[M]. 北京: 化学工业出版社, 2010.
[7] 王戈莎. 大米多肽的分离纯化及其抗氧化活性的研究[D]. 无锡: 江南大学, 2008: 13.
[8] WU Ting-feng, HSU Chiung-yueh, HUANG Huei-sheng, et al. Proteomic analysis of pycnogenol effects in RAW 264.7 macrophage reveals induction of cathepsin D expression and enhancement of phagocytosis[J]. J. Agric. Food Chem., 2007, 55: 9 784-9 791.
[9] WEN Li, CHEN Yue-hua, ZHANG Li, et al. Rice protein hydrolysates (RPHs) inhibit the LPS-stimulated inflammatory response and phagocytosis in RAW264.7 macrophages by regulating the NF-κB signaling pathway[J]. Rsc Advances, 2016, 6(75): 10.1039/C6RA08927E.
[10] 钟芳, 张晓梅, 麻建国. 大豆肽的离子交换色谱分离及其活性评价[J]. 食品与机械, 2006, 22(5): 16-19.
[11] CUMMINS P, DOWLING O, O'CONNOR B. Ion-exchange chromatography: basic principles and application[J]. Methods in Molecular Biology, 2011, 681(681): 215-228.
[12] 贾晨, 李静媛, 金玉兰, 等. 章鱼下脚料发酵液中多肽的分离及抗氧化活性的研究[J]. 青岛农业大学学报: 自然科学版, 2015, 32(1): 36-41.
