冷藏即食虾仁保藏期间品质变化
2018-05-30迟坤蕊姜竹茂杨瑞金张文斌
迟坤蕊,姜竹茂,华 霄,*,杨瑞金,丁 萍,赵 伟,张文斌
(1.食品科学与技术国家重点实验室,江苏无锡 214122;2.烟台大学生命科学学院,山东烟台 264005;3.江南大学食品学院,江苏无锡 214122)
南美白对虾(Penaeus vannmei)是世界养殖虾类产量最高的对虾品种之一[1-3],2016年我国南美白对虾的淡水养殖量已达到70万吨。南美白对虾水分含量约为70%,蛋白质占干基的90%[4],因此在捕捞、加工及保藏过程中很容易腐败变质[5]。我国传统对虾加工以带壳虾干制品和冷冻虾仁为主,干制虾水分含量低、不易变质但质地坚硬、口感差,冷冻虾仁质构、风味和新鲜度差于鲜虾[6]。对虾调理食品是将对虾经简单加工后进行保藏,经简单热处理即可食用或开袋即食,能满足快速消费需要。对虾调理食品水分含量较高,虾肉质地细腻柔软、风味接近鲜虾,但高水分含量和高水分活度有利于对虾中内源酶作用和微生物繁殖,因此如何在保持高水分的同时控制内源酶活力和微生物生长是开发高水分对虾调理食品的关键问题。
本文基于南美白对虾内源酶的热失活条件和微生物的热杀菌原理,建立了一个高水分南美白对虾调理食品的加工工艺,参考王素华等[1]的对虾加工方法,在保持虾仁原有质构及口感条件下保持高水分活度和水分含量,同时不添加任何防腐剂等添加剂,并对保藏期间内源酶活力、微生物数量、产品质构和感官评定等方面进行研究,为高水分即食调理食品的开发和保藏提供参考。
1 材料与方法
1.1 材料与仪器
南北美对虾 无锡市朝阳农贸市场;LDPE优质食品真空包装袋 台州名科塑业有限公司;Folin试剂 Sigma公司;三氯乙酸(TCA,≥99.0%)、酪蛋白(CR,≥99.0%)、Na2CO3(AR)等 国药集团。
TA.XT Plus物性分析仪 英国SMSTA公司;UV-1800紫外可见光分光光度计 日本Shimadzu公司;AA-240原子吸收分光光度计 美国Varian公司;Spectr AA-220/220z原子吸收分光光度计 美国Varian公司;GCMS-QP2010 ULTRA 气质联用仪 日本Shimadzu公司;TGL-16M低温离心机 上海卢湘仪离心机仪器有限公司;HD-4型水分活度仪 无锡市华科仪器仪表有限公司;AUX HX-PB1052料理机 佛山市海迅电器有限公司;W1-1-BS电热恒温鼓风干燥箱 上海跃进医疗器械厂;美吉斯WP300真空包装机 广东东莞凯仕电器有限公司;TES-1326s手持式温度计 台湾泰仕电子工业股份有限公司。
1.2 实验方法
1.2.1 高水分虾仁调理食品加工工艺 新鲜南美白对虾→去头、壳、虾线→沸水浴水煮100 ℃ 2 min→沥干水至无游离水滴下→真空包装(150 g/袋)→水煮至虾仁温度达到80 ℃后保持10 min→600 W微波处理2 min→4 ℃冷藏。
1.2.2 内源酶活力测定
1.2.2.1 内源蛋白酶活力 采用Foiln-酚法测定内源蛋白酶总活力[7]。将虾仁均质匀浆(10000 r/min 10 min)后,过滤取滤液在4 ℃10000 r/min离心10 min,取上清液1.0 mL在40 ℃水浴预热5 min后加入1.0 mL预热的质量分数为2%的酪蛋白溶液。准确计时保温10 min后加入2 mL 0.4 mol/L TCA溶液,继续在40 ℃下保温10 min。室温静置50 min后过滤取滤液1.0 mL,加入5.0 mL 0.4 mol/L Na2CO3溶液和1.0 mL Foiln试剂,40 ℃水浴保温20 min,冷水快速冷却至室温后在680 nm波长下测定吸光值。蛋白酶活力(U)计算公式为:
式(1)
式中:A为蛋白酶活力(U/mL);C及C0分别为样品管和空白管的酪氨酸浓度(μg/mL);V为液体酶试样第一次稀释总体积(mL);N为样品提取液第二次稀释的倍数;4为酶反应体系总体积(mL);1.0为参与反应的酶量(mL);m为试样体积(mL);10为反应时间(min)。酶的活力单位(U)定义为实验条件下1 min内转化1 mmol底物所需的酶量。
1.2.2.2 脂肪水解酶活力 参考雷启义[8]的脂肪酶测定方法,采用滴定法进行测定。将虾仁(虾仁∶0.02 mol/L pH7.5的磷酸缓冲液=1∶10)均质匀浆(10000 r/min 5 min)后过滤取滤液,在4 ℃下10000 r/min离心25 min,取上清液。50 mL酶反应器中加入5.0 mL 0.025 mol/L pH7.5的磷酸缓冲液和4.0 mL聚乙烯醇乳化液,对照组再加入15 mL 95%乙醇,40 ℃水浴预热10 min后加入5.0 mL酶提取液。准确计时保温20 min后测定组加入15 mL 95%乙醇,将所有反应溶液转移到100 mL锥形瓶中并加入3滴1%的酚酞试剂。用0.05 mol/L的NaOH溶液滴定至溶液变为粉红色并保持15 s不褪色。计算公式为:

式(2)
式中:V1为样品消耗NaOH体积(mL);V2为空白样消耗NaOH体积(mL);c为NaOH标准溶液浓度(mol/L);n1为样品稀释倍数,44;50为0.05 mol/L NaOH 1 mL相当于脂肪酸50 μmol;20为反应时间20 min。酶的活力单位(U)定义为实验条件下每分钟水解产生1 μmol游离脂肪酸所用的脂肪酶量。
1.2.2.3 脂肪氧化酶活力 参考石胜尧[9]的酶活性测定方法,采用滴定法进行测定。底物配制:0.4 mL亚油酸滴加10% 氢氧化钠 0.5 mL,使全部溶解定容至100 mL,取20 mL此液加入0.1 mL吐温-60,加0.2 mL pH9.0硼酸缓冲液定容至100 mL。将此溶液稀释40倍,使亚油酸含量为2.57 mmol/L;粗酶提取:固形物含量为5%的样品在4 ℃下搅拌离心10 min,4000 r/min 5 min后取上清液即可;测定酶活:底物2.8 mL,酶液0.2 mL混合均匀后测定234 nm处的吸光值,每15 s记一次。计算公式为:

式(3)
式中:OD15 s和OD30 s分别为加样品15 s和30 s时测得的吸光值。酶的活力单位(U)定义为每分钟氧化1.2×10-4μmol亚油酸所需酶的量。
1.2.3 水分含量测定 按GBT 9695.15-2008《肉与肉制品——水分含量测定》中“直接干燥法”测量样品水分含量。将称量瓶置于105 ℃烘箱中干燥至恒重(两次干燥称量差值<1 mg)。取样5~8 g于称量瓶中,混合均匀后置于105 ℃烘箱中烘干2 h,取出放入干燥器内冷却至室温后精确称量,再放入烘箱中烘干1 h直至前后称量结果差<1 mg。样品水分含量计算公式为:

式(4)
式中:m2为干燥前试样和称量瓶的总质量(g);m3为干燥后试样和称量瓶的总质量(g);m1为称量瓶质量(g)。
1.2.4 水分活度测定 将30个虾仁粉碎至1~5 mm大小后均匀混合,在室温下(26 ℃)置于水分活度仪中测定水分活度,测定用量为测定腔容量的1/2左右,重复测定4组(30个/组)。
1.2.5 微生物检测 取4 ℃保藏7 d过程中的不同样品,送样至无锡市疾病预防控制中心进行微生物检测,每次送样量为250 g。检测微生物包括:大肠杆菌、霉菌、酵母菌、金黄色葡萄球菌等腐败菌以及沙门氏菌、副溶血性弧菌、蜡样芽胞杆菌和气单胞菌等致病菌及菌落总数。
1.2.6 质构测定 采用TPA全质构模式测定虾仁质构。探头为P-5,测试参数:测试前速度2.0 mm/s,测试速度1.0 mm/s,测试后速度4.0 mm/s,变形(压缩比)为40%,两次压缩中间停顿时间5.0 s。虾仁接触部位保持为第二和第三腹节中间部位,每组样品包括35个虾仁,共测定4组样品,实验结果以平均值±标准偏差表示。
1.2.7 风味成分测定 取粉碎约3 g样品置于萃取瓶中,70 ℃预热10 min,色谱柱在此温度下吸附30 min,完成萃取后萃取头进入进样口解吸4 min。
GC-MS分析条件:色谱柱 TR-35MS毛细管柱;柱初温40 ℃保持3 min,以3 ℃/min程序升温至90 ℃,保持3 min,以5 ℃/min程序升温至80 ℃,以8 ℃/min程序升温至260 ℃,保持7 min,进样口温度260 ℃;载气(He)流量0.80 mL/min,不分流模式进样。质谱采用电子轰击(EI)离子源,电子能量70 eV,离子源温度260 ℃,质量扫描范围30~600 m/z,共37.5 min。
1.2.8 重金属检测 按照GB 2762-2012《食品中污染物限量》用原子吸收仪检测重金属含量。选取大小一致的虾仁个体15只,粉碎至1~5 mm大小,均匀混合后称取0.50 g样品和3.5 mL硝酸于微波消解罐中消解,冷却后赶酸并将样品定容至25 mL。制备相关测定分析元素的校正溶液并测620 nm处空白样和标样吸光值,依据校正曲线和样品的测定值求出样品的浓度值。
1.2.9 感官分析 感官评定小组包括30名食品科学专业研究生(男女比例为1∶3,年龄为21~25周岁),感官评价前先对参与人员进行感官评价培训,对虾仁中的常见质构评价有系统了解,然后进行感官评价。评价标准采用10分制,对产品的色泽、气味、口感和外观四方面进行评分,参照文献[10]做评分标准表1。实验采取盲评方式,打乱样品顺序采取单人按序评价的方法,同时考虑不同生源地参与者的差异,每个测试样品的感官评分数据去掉最高和最低后取平均值。

表1 感官评定评分标准Table 1 Sensory evaluation criteria
1.3 数据统计
用SPSS 22.0软件进行数据显著性分析,组间分析采用t-检验,显著性界值以p<0.01为非常显著,p<0.05为显著,p>0.05为不显著。
2 结果与分析
2.1 工艺条件确定
欧洲冷冻食品联合会(ECFF)建议冷藏虾类70 ℃下至少处理2 min[11],因此第一次热处理首先将虾仁在沸水浴中加热2 min,在此过程中肌肉蛋白发生热变性,肌肉纤维凝集形成网状结构,形成高分子量的不溶性蛋白质聚集体[12],此时虾肉具有很好的风味和质构,但2 min水煮不能保证完全钝化虾仁内源酶及杀灭微生物,因此需要延长热处理时间并考察处理时间对内源酶和微生物的影响。进一步地,考虑到热处理后包装过程中空气中微生物的污染,采用2 min水煮后立即真空包装,然后包装产品继续进行二次热处理钝酶杀菌。
2.1.1 蛋白酶活性 如图1所示,随二次热处理时间延长,总蛋白酶活力显著减弱,当加热时间为10 min时,残余蛋白酶活力约为生虾仁总蛋白酶活力的40%,进一步延长加热时间至15 min时酶活力没有显著下降。
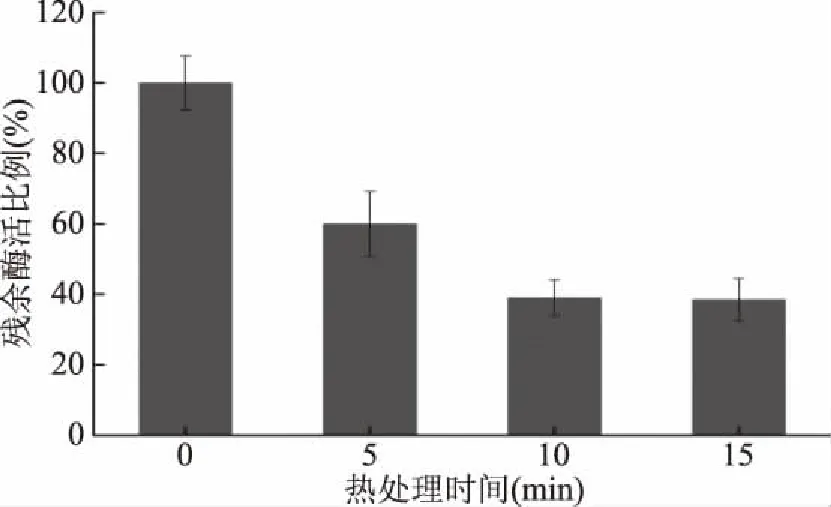
图1 二次热处理时间对虾仁蛋白酶残余活性的影响Fig.1 Effect of second thermal treatment time on residual endo-protease activity of prepared shrimp product
文献报道[13]虾的内源蛋白酶包括两个部分,不耐热部分在60~70 ℃下2 min就完全灭活;耐热部分在80 ℃下2 min不能完全灭活。文章研究结果与文献报道一致,但由于真空包装及虾仁对内源蛋白酶的传热阻碍作用和非溶液环境,产品残余酶活高于文献[14]结果。文献报道提到虾头中含有多种内源酶(蛋白酶、氧化还原酶、酯酶等),虾仁肌肉中也含有一定量的内源酶[15]。虾仁内源蛋白酶主要有钙蛋白酶、胰蛋白酶等[16],其中胰蛋白酶可能是虾仁肌肉软化的主要作用酶[17]。各种蛋白酶耐热性不同:钙蛋白酶最适温度是20 ℃;组织蛋白酶在85 ℃时基本失活;胰蛋白酶最适温度为40~70 ℃[18]。据文献报道,对虾内源蛋白酶从45~55 ℃开始失活[13],80 ℃时酶活显著下降,90 ℃下酶活残余约为最适条件下酶活的25%[15]。
2.1.2 脂肪水解酶活性 不同热处理时间段内脂肪水解酶活力变化如图2所示,虾仁中残余酶活力维持在15%~20%之间,热处理能钝化约80%的酶,在热处理时间达到10 min时酶活性残余16%左右,且延长到15 min时的结果变化不大。

图2 二次热处理时间对虾仁脂肪水解酶残余活性的影响Fig.2 Effect of second thermal treatment time on residual lipase activity of prepared shrimp product
2.1.3 脂肪氧化酶活性 脂肪氧化酶(LOX)可催化不饱和脂肪酸形成过氧化氢衍生物等挥发性物质,能直接与食品中的蛋白质和氨基酸结合而破坏人体必需脂肪酸,降低食品的风味和营养价值[19-20]。前期预实验阶段测定生虾在35 ℃保藏10 d后有吲哚及过氧化氢类物质产生,过氧化氢衍生物是由脂肪酶作用不饱和脂肪酸及酯的氧化产生[19-20],因此需要测定脂肪氧化酶活性。
图3中不同热处理时间下脂肪氧化酶残余酶活性均低于4%,说明热处理对脂肪氧化酶的破坏程度比较大。整体而言,5 min及延长时间对脂肪氧化酶残余活性影响不大,仍保持在2.5%~3.0%。

图3 二次热处理时间对虾仁脂肪氧化酶残余活性的影响Fig.3 Effect of second thermal treatment time on residual LOXs activity of prepared shrimp product
2.1.4 对虾熟制工艺条件 结合蛋白酶活性及脂肪酶活性变化,确定二次热处理时间为10 min,同时将虾仁沥干后采用真空包装,能够隔绝氧气以抑制好氧菌的繁殖、蛋白质及油脂氧化反应的发生。
但研究中发现,二次热处理的样品37 ℃下保藏3 d后,在所有样品中均发现有游离水析出(表2),推测游离水析出与残余内源蛋白酶有关,因此进一步采用600 W微波处理2 min,微波处理后样品不再析出游离水(表2)。微波是对虾加工的一种常用手段,适当的微波处理对虾的持水性、颜色和风味几乎不产生影响[13]。

表2 微波处理对虾仁析水量的影响Table 2 Effect of microwave on condensate rate of Shrimp
2.2 保藏期间品质变化
2.2.1 水分含量和水分活度 如图4所示,加工后水分含量由生虾的76%变为72%,Aw达到0.96~0.98,且在4 ℃保存7 d过程中,均没有观察到水分含量和水分活度的显著性变化(p>0.05),包装袋中也没有观察到游离水析出。在高水分环境中,内源蛋白酶可持续发挥活力,水解虾肌肉蛋白纤维,造成肌肉结构破坏,虾肉硬度下降,肌肉内水分析出成游离水,游离水进一步扩大蛋白酶作用范围,促进蛋白质水解。因此,在保持高水分含量和Aw下需要考察內源酶残余活力的变化。

图4 储藏过程中虾仁水分含量的变化Fig.4 Variation of moisture content and Aw of prepared shrimp product during storage
2.2.2 残余内源酶活性 图5为虾仁产品在4 ℃下储藏7 d过程中残余酶活力变化。在储藏期间残余蛋白酶活力相当稳定(维持在40%左右)。这一方面说明前期热处理对蛋白酶的钝化效果不可逆;另一方面低温保藏结合真空包装抑制了蛋白酶活力,低温下水分子动能降低,相应地溶液中溶质分子迁移速率降低,因此酶反应速率显著降低。保藏期间脂肪水解酶残余活力仍维持在15%~20%之间,相对来说变化不大。而脂肪水解对产品的风味形成起着重要作用,脂肪水解酶促进游离脂肪酸氧化生成氢过氧化物,经过一系列反应生成醛、酮等挥发性成分[21]。
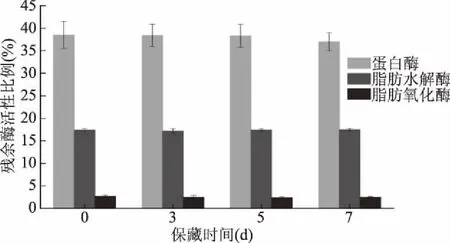
图5 储藏过程中虾仁残余酶活性变化Fig.5 Variation of residual enzymes activity of prepared shrimp product during storage
脂肪氧化酶随保藏时间的延长,残余酶活力有一定程度上的降低,但变化幅度不大,保持在2.7%左右,这可能是低温抑制了酶活力作用。动物LOXs在pH4~11,0~50 ℃条件下均能保持活性,水产类动物在中性环境中活性更高[20]。由于产品在加工过程中仅依靠热处理灭酶,因此会有诸如LOX1类的脂肪氧化酶仍有活性;且虾仁中钙离子含量较高,Ca2+可将LOXs活性中心的Fe2+转变成Fe3+激活LOXs。残余酶继续作用于底物,催化多不饱和脂肪酸(PUFA)氧化,导致动物性食品风味、色泽及质构劣化[20],因此有效评价脂肪氧化酶活性作用还需要进行风味物质的鉴定。
2.2.3 微生物残留 以对虾体表的微生物主要集中于虾壳,体内微生物主要存在于虾头、虾线(肠道)和肌肉中,主要致病菌有副溶血性弧菌、单增李斯特菌和沙门氏菌[22],优势腐败菌为假单胞菌和气单胞菌[23]。因此以低温肉制品行业标准GB4789.20-2003中规定104CFU/g菌落数作为产品的菌落总数上限[24]以及食品中致病菌限量标准中沙门氏菌为0,金黄色葡萄球菌100 CFU/g,副溶血性弧菌100 MPN/g[25]为参照。分别测定了对虾产品在4 ℃保藏7 d过程中的微生物菌落总数。共检测8种微生物,包括大肠杆菌、霉菌、金黄色葡萄球菌、沙门氏菌、副溶血性弧菌、蜡样芽孢杆菌和气单胞菌。采用真空包装可以抑制霉菌和副溶血性弧菌的生长,并在一定程度上影响兼性厌氧微生物的生长;而产品水分活度(0.96~0.98)可满足表所有微生物生长所需最低Aw0.85。表3为产品4 ℃下保藏过程中的微生物生长情况,保藏期内产品微生物菌落总数没有变化,表明产品加工工艺可有效杀灭或抑制对虾中的微生物生存和繁殖。微生物没有变化是由于加工时热处理对大部分微生物有致死或伤害作用,并且低温保藏有利于抑制微生物繁殖。
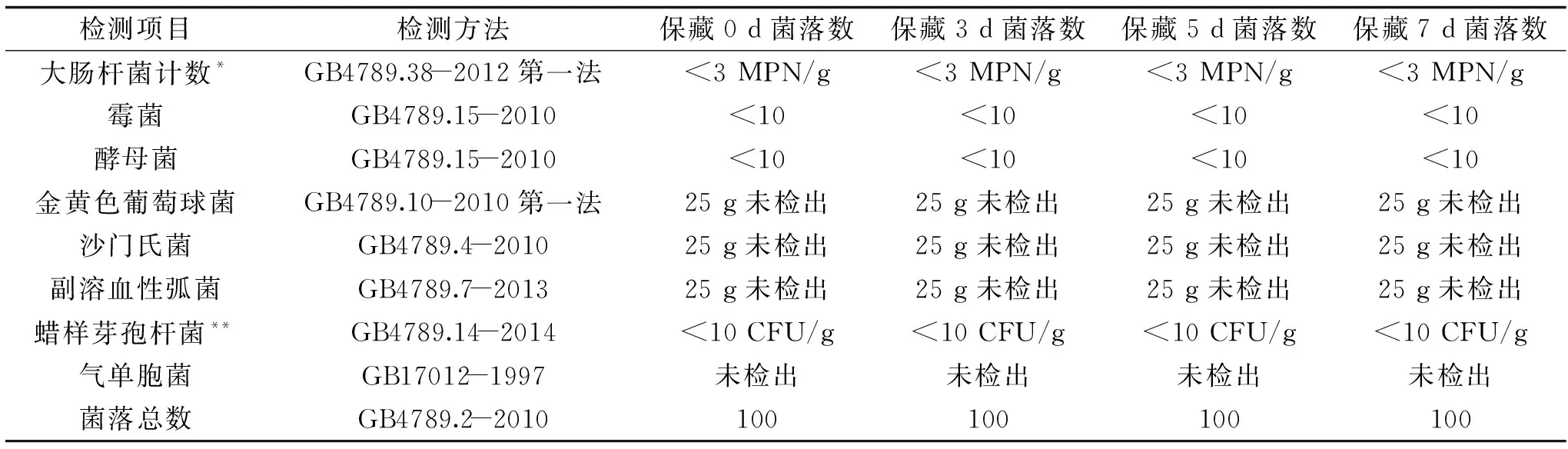
表3 储藏过程中虾仁的腐败菌和微生物菌落总数变化Table 3 Variation of bacterial plate count of shelled shrimp stored at 4 ℃ for 7 days
2.2.4 TPA质构分析 表4为4 ℃保藏7 d过程中的产品质构变化。首先,样品硬度仅为300~410 g,远小于半干制虾仁的6000~9000 g[26],这是因为产品的水分含量达到70%以上,降低了硬度;而在保藏过程中产品硬度略有增加(p<0.05)。在保藏期间,产品的内聚性、咀嚼性均没有较大变化而弹性略有降低(p<0.05)但不影响口感,证明在储藏期间产品并没有明显丧失原有的蛋白质凝胶质构。在保藏期间,样品的回复性减小,说明构成凝胶的蛋白质分子间相互作用强度减小,粘性有所提高,这可能是蛋白酶在保藏期间发生作用破坏蛋白质空间结构造成的组织变化,但结合样品弹性及内聚性的变化情况,可认为储藏期间产品对压缩力(如咀嚼)的响应性下降。造成质构变化的原因首先在于残余内源蛋白酶对肌原纤维蛋白和胶原纤维蛋白的缓慢降解,造成蛋白分子量下降,凝胶网络结构强度因此下降[27-28];其次采用真空包装,大气压持续作用于产品造成蛋白网络结构压缩,抗形变能力下降。当加热条件足够时,蛋白质中的离子键和氢键数量显著减少,疏水作用显著增强,肌肉质构得到强化[29]。

表4 储藏过程中虾仁的质构变化Table 4 Variation of texture parameters of prepared shrimp during storage
2.2.5 风味成分变化 表5对比了保藏前后产品风味物质的变化。保藏前测定的风味物质有75种,保藏7 d后81种,其中可鉴定69种风味物质,在风味物质的数量上明显高于文献报道的36~45种挥发性风味成分[21,30]。相较与文献,增加的风味物质有醇类3种、酯类1种、醛类4种、烯烃类3种以及10多种烷烃类和吲哚类物质。这些物质的产生可能与产品的加工方式有关,残余酶作用产生了挥发性物质。脂肪水解酶作用游离脂肪酸产生过氧化氢衍生物、脂肪氧化酶氧化产生挥发性物质、蛋白酶分解蛋白产生的氨基酸等。但进行风味成分分析时没有检测到脂肪水解酶产物(甘油和游离脂肪酸)存在,因此推测在低温真空条件下7 d内残余酶活力发挥作用较小。
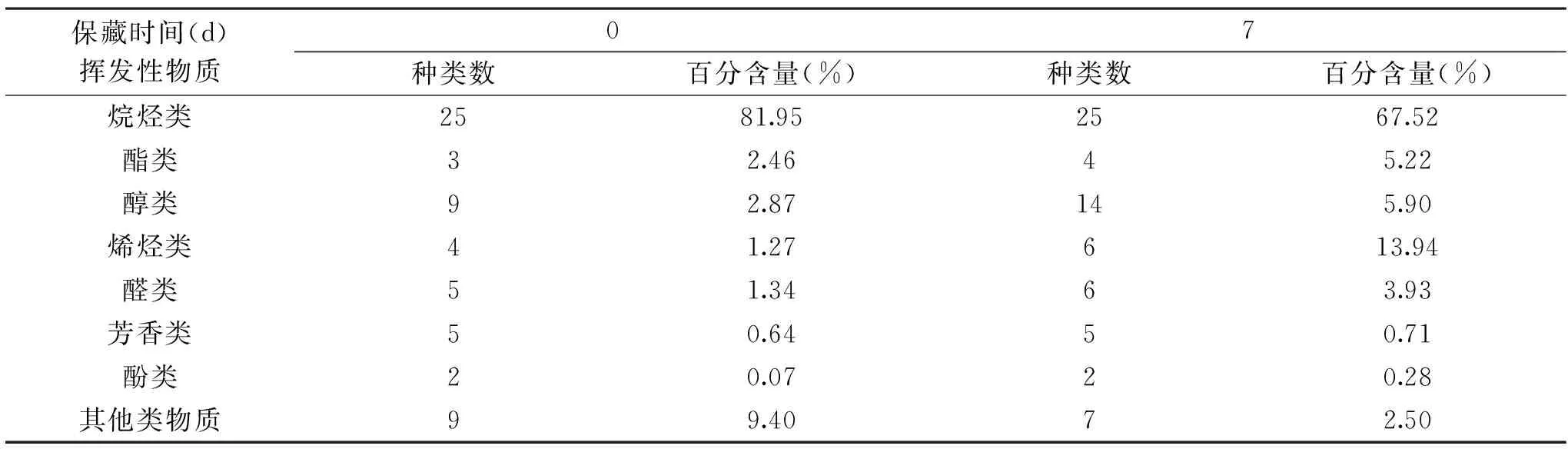
表5 虾仁风味分子种类及相对含量Table 5 Composition and percentage of flavor compounds of shelled shrimp product
相对含量较高的烷烃类是构成虾仁风味的重要成分,而醛类物质虽然百分含量比较低,但感觉阈值(0.005~10 μg/kg)较小,因而对虾仁风味有较大贡献[31-33]。保藏期间增加的有酯类1种、醇类5种、烯烃类2种。酯类物质的生成可能是由于微波促进醇和酸的酯化反应[34];醇类、醛类和醚类的变化是内源酶对蛋白质及油脂的催化作用、热降解、美拉德反应等作用结果。
2.2.6 重金属离子 重金属污染是水产食品安全风险的一个重要来源。重金属离子可能由对虾生长的环境、食物及加工过程中设备、器具等途径向对虾体内迁移,由于重金属离子性质比较稳定,很难在加工过程中被去除。根据国标GB 2762-2005《食品中污染物限量》相关规定,对产品中的Cu、Cr、Cd、Pb、Hg等重金属离子的含量进行测定,结果如表6所示。5种重金属离子的含量均小于规定的限量值,证明该产品具有食用安全性。

表6 产品重金属检测结果Table 6 The results of heavy metals content of shelled shrimp product
2.2.7 感官评定 按1.2.9所述方法对4 ℃下保藏不同天数的样品进行感官评分。特别地,为了评价当产品保藏超过7 d后的可接受程度,选择了一组保藏12 d的样品进行对照。感官评定结果如表7所示,在第7 d,样品的颜色有略有加深,因此色泽评分有所降低(p>0.05)。保藏期间由于虾体内还原性物质(例如多酚类化合物)受光照、残余氧化还原酶作用发生氧化反应,产生深色物质,导致虾表面略变暗;在第12 d时,产品的色泽进一步劣变,但总体劣变速度较为缓慢。这一方面是因为真空包装隔绝O2分子,抑制氧化反应;另一方面是因为热和微波处理钝化了大部分内源酶,结合低温保藏降低了酶反应速率。综合表5结果可知风味变化主要是由于醇和烯烃等物质的增多引起的。在第7 d产品质构评分略有下降,这是由于产品蛋白质凝胶质构劣变引起的,但由于产品水分含量达到70%以上,因此整体口感柔软,质构评分总体可接受。在第12 d时,质构劣变加剧,评分下降到5.2,质构接受程度已经较低。总体接受性为色泽、风味和质构的综合评分,新鲜的产品(0 d)的感官评分为24.2,在第7 d产品的总体接受性下降到21.3,说明保藏期间产品感官还是产生了一定负面效果;所有评定员认为产品品质可以接受,但从消费角度考虑,推荐在保藏0~4 d内食用为好。

表7 储藏时间对虾仁感官评分的影响Table 7 Effect of storage time on sensory score of shrimp
3 结论
本文给出了采用水煮、真空包装、微波处理、低温保藏相结合(煮制时间为2 min,热加工时间为10 min,微波处理时间为2 min)的工艺,制备了一种水分含量70%(w/w)以上、水分活度0.95以上的白对虾虾仁调理食品,依据感官及酶活性结果选择产品货架期7 d。采用上述工艺,可钝化约60%的总内源蛋白酶活力并抑制货架期内残余酶活力;货架期内产品硬度上升,但粘性、弹性略微下降;风味物质中醇类和酯类略微增多;产品的微生物和重金属离子指标均达到标准。产品工艺在保持高水分活度和货架期之间取得了较好的平衡,在0~4 d内消费可获得更好的感官品质。
[1]王素华,陈积明,朱海,等. 凡纳滨对虾熟虾仁的工艺研究及保藏特性分析[J]. 南方水产,2010,6(2):76-80.
[2]王素华,陈积明,朱海,等. 凡纳滨生虾仁储藏特性研究及货架期测试[J]. 储运保鲜,2011(7):386-388.
[3]伍玉洁. 常温保藏半干南美白对虾虾仁的研制[D]. 无锡:江南大学,2006.
[4]董志俭,王庆军,黄静雅,等. 南美白对虾蒸制过程中水分状态及质构的变化[J]. 中国食品学报,2015,15(2):231-236.
[5]石红,郝淑贤,李来好,等. 即食半干虾加工工艺研究[J]. 南方水产,2010,6(2):41-45.
[6]夏文水,项建琳,杨芳琪. 提高冷冻虾仁持水性[J]. 冷饮与速冻食品工业,1997(4):18-19.
[7]钱嘉渊. 酶的测定方法(译)[M]. 北京:中国轻工业出版社,1991.
[8]雷启义,邹凯,周江菊,等. 脂肪酶活力测定方法及其比较[J]. 凯里学院学报,2011,29(6):43-45.
[9]石胜尧,张延坤,郭大发,等. 大豆脂肪氧化酶活性的测定[J]. 营养学报,1996,18(3):354-357.
[10]黄晓春,候温甫,杨文鸽,等. 冷藏过程中美国红鱼生化特征的变化[J]. 食品科学,2007,28(1):337-340.
[11]ECFF. Recommendations for the production of prepacked chilled food[EB/OL]. http://www.ecff.net/images/ECFF_Recommendations_2nd_ed_18_12_06.pdf,2015-08-24.
[12]袁莉莉. 凡纳滨对虾肉糜凝胶特性研究及虾肉肠的研发[D]. 湛江:广东海洋大学,2013.
[13]Thomas V,Geerurui V,Jan D B,et al. Thermal inactivation kinetics of proteases and polyphenoloxidase in brown shrimp(Crangoncrangon)[J]. Food Chemistry,2016,197:641-647.
[14]孙链,周辉,徐宝才. 低温肉制品腐败微生物控制技术研究进展[J]. 肉类研究,2010(7):40-45.
[15]陈康玉,彭椼,何翠萍,等. 南美白对虾虾头内源酶的分离纯化[J]. 现代食品科技,2010,26(6):573-581.
[16]李学鹏. 中国对虾冷藏过程中品质评价及新鲜度指示蛋白研究[D]. 杭州:浙江工商大学,2011.
[17]陈诗妍,吉宏武,李承勇,等. 凡纳滨对虾内源蛋白酶对肌原纤维蛋白的降解作用[J]. 食品工业科技,2015,36(5):149-155.
[18]Striket C,Benjakul S,Visessanguan W. Effect of legume seed on the inhibition of proteolytic activity and muscle degradation of fresh water prawn(Macrobrachiumrosenbergii)[J]. Food Chemistry,2011,129(3):1093-1099.
[19]左进华,董海洲. 大豆脂肪氧化酶研究现状[J]. 粮食与油脂,2009(9):1-3.
[20]刘东敏,刘永乐,建辉,等. 动物脂肪氧化酶及其对动物性食品的影响研究进展[J]. 食品与机械,2012,28(1):253-258.
[21]张露. 低钠干腌猪肉制品加工技术研究[D]. 南京:南京农业大学,2014.
[22]张昭寰. 南美白对虾中常见食源性致病菌快读检测技术及分子预测微生物模型的构建[D]. 上海:上海海洋大学,2015.
[23]曹荣. 对虾生物保鲜与其熟制品保藏技术的研究[D]. 青岛:中国海洋大学,2009.
[24]白艳红,赵电波,毛多斌,等. 低温肉制品加工过程卫生质量控制研究[J]. 食品研究与开发,2006,27(6):83-86.
[25]中华人民共和国国家卫生和计划生育委员会.GB 29921-2013食品安全国家标准食品中致病菌限量[S].北京市王府井大街36号:商务印书馆,2013.
[26]WANG Dao-ying,HAN Dong,ZHANG Muhan,et al. Changes in actomyosin dissociation and endogenous enzyme activities during heating and their relationship with duck meat tendemess[J]. Food Chemistry,2013,141:675-679.
[27]蔡林林,吴冬梅,李小禹. 热风干燥温度对凡纳滨对虾虾仁质构的影响[J]. 食品工业,2013,34(11):108-111.
[28]曹荣,刘淇,尹邦忠,等. 虾仁TPA质构分析及不同熟制加工方式对其品质的影响[J]. 食品研究与开发,2010(6):1-4.
[29]李晓龙,刘书成,解万翠,等. 水煮加热虾肉蛋白变化研究[J]. 食品工业科技,2015,36(15):66-69,73.
[30]池岸英. 凡纳滨对虾微波蒸煮参数优化及风味成分分析[D]. 湛江:广东海洋大学,2012.
[31]丁浩宸,李栋芳,张燕平,等. 南极磷虾虾仁与4种海虾虾仁挥发性风味成分对比[J]. 食品与发酵工业,2013,39(10):57-62.
[32]A M Spanier,M Flores,K W McMillin,et al.The effect of post-mortem aging on meat flavor quality in Brangus beef correlation of treatments,sensory,instrumental and chemical descriptors[J]. Food Chemistry,1997,59(4):531-537.
[33]郑宇,刘畅,李林洁,等. 浓缩苹果汁加工过程挥发性风味物质变化规律[J]. 分析与检测,2015,41(11):121-128.
[34]柳艳修,宋华,张铁晶,等. 微波促进的磷钼酸对酯化反应的催化性能[J]. 化工进展,2010,29(4):670-372.
