羧甲基壳聚糖包裹椰子油脂质体 制备的工艺优化
2018-05-30吕方方李艳南
吕方方,陈 华,宋 菲,李艳南
(1.华中农业大学食品科技学院,湖北武汉 430061;2.中国热带农业科学院椰子研究所,海南文昌 571339;3.海南省椰子深加工工程技术研究中心,海南文昌 571339)
椰子(CocosnuciferaL.)是棕榈科椰子属植物,是热带地区主要的木本油料作物和食品能源作物,有“生命之树”之称。椰子果实中含油率约36%,天然椰子油中富含月桂酸(C12)、辛酸、癸酸等中短链脂肪酸,具有抑制细菌、抑制病毒、提高人体免疫力等功能[1]。脂质体是一种新型的微胶囊化技术,具有提高被包封物的稳定性、利用率,并使其具有靶向性等优点[2-3]。由于椰子油油腻的口感和水溶性差,极大程度限制了椰子油的发展,因此为改善椰子油口感和水溶性,保护营养成分并使其实现靶向输送,提高利用率,也为椰子油在食品工业及日用化学工业等方面的广泛应用提供一种方法,拓宽了椰子油的使用范围。对于椰子油的研究除了其本身性质外,利用不同的方法或者不同的膜材进行微胶囊的制备也是热点之一。
近十几年来,羧甲基壳聚糖因其具有很好的生物相容性、可降解性、水溶性和保湿性等优点,在医学、农业和食品工业等领域被广泛研究并取得一定的成果。如:在医学领域将其用作包扎伤口、人造骨骼和药物控缓释载体。在化妆品中可替代价格昂贵且具有保湿性的透明质酸,在食品工业上作为一种良好的保鲜剂,应用于水果、蔬菜的保鲜。
国内外对于脂质体在化妆品、食品和医药等领域取得很大的进展,特别是作为有效成分载体的研究和应用[4]。目前,对于椰子油微胶囊的报道较为普遍,而关于椰子油脂质体的研究至今未见任何报道。本文首次对椰子油脂质体进行制备,拟采用薄膜-超声分散法[5-8]制备椰子油脂质体,以包封率为指标,优化脂质体制备的工艺和配方,还对其进行了显微镜观察,检测了包封率、MDA和释放度,旨在制备出包封率高、稳定性好和实现延缓释放的椰子油脂质体。
1 材料与方法
1.1 材料与仪器
椰子油 纯度100%,文昌椰村人家椰子加工专业合作社;大豆卵磷脂(SPC) 纯度>92%,浙江高茂生物科技;氢化大豆卵磷脂(HSPC) 纯度>93%,河南华悦化工产品;胆固醇(CHO) 河南合生源化工有限公司;石油醚(60~90 ℃)、无水乙醇 分析纯,海南宏远达科技有限公司。
XHF-D高速分散器 生物科技股份有限公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;SHZ-Ⅲ循环水式多用真空泵 上海知信实验仪器技术有限公司;超声波清洗机 深圳市超艺达科技有限公司;AL204-IC电子天平 梅特勒-托利多仪器(上海)有限公司;DK-98-11A电热恒温水浴锅 天津市泰斯特仪器有限公司;UV752N紫外分光光度计 北京利康达圣科技发展有限公司;PHS-3C pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 羧甲基壳聚糖(CMCT)包裹椰子油脂质体的制备 取一定比例的磷脂(SPC和HSPC混合物,且质量比为9∶1[9])、CHO、椰子油,加入50 mL无水乙醇,在8000 r/min高速分散器上分散溶解3 min,溶解后置于圆底烧瓶中,55 ℃水浴旋转蒸发,除去无水乙醇,直至在圆底烧瓶底部形成均匀薄膜后继续蒸发30 min除去残余乙醇;加入80 mL磷酸盐(0.05 mol/L,pH6.5)缓冲液,在减压条件下旋转,水合、洗膜30 min,之后在一定超声强度下超声一定时间,即得椰子油脂质体。
将不同比例的羧甲基壳聚糖水溶液置于35 ℃水浴下,用电动搅拌器以600 r/min搅拌,同时缓慢滴加刚制备的椰子油脂质体,待所有椰子油脂质体悬浮液全部滴加进入羧甲基壳聚糖溶液后,继续搅拌30 min,调节pH至一定值,存于4 ℃冰箱中,所得羧甲基壳聚糖包裹椰子油脂质体,表示为CMCT-椰子油脂质体[10-11]。
1.2.2 工艺优化设计
1.2.2.1 单因素实验 固定电动搅拌速度600 r/min,温度35 ℃,磷脂与胆固醇质量比4∶1,磷脂与椰子油质量比1∶2.5,pH6.5,超声强度为600 W,超声时间10 min,分别以CMCT与磷脂质量比(1∶8、1∶10、1∶12、1∶14、1∶16)、磷脂与CHO质量比(2∶1、4∶1、6∶1、8∶1、10∶1)、磷脂与椰子油质量比(3∶1、2∶1、1∶1、1∶2、1∶3、1∶4)、介质pH(4.0、4.5、5.0、5.5、6.0、6.5)、超声强度(600、650、700、750、800 W)、超声时间(10、20、30、40、50 min)6个因素为影响因素,考察各因素对包封率的影响。每次实验重复3次。
1.2.2.2 正交实验 在单因素实验的基础上,选取CMCT与磷脂质量比(A)、磷脂与CHO质量比(B)、磷脂与椰子油质量比(C)、介质pH(D)、超声强度(E)和超声时间(F)6个因素,采用正交实验L18(63)对工艺进行优化,得出最优配方并进行验证实验,得出最优组合。各因素和水平见表1。

表1 因素实验水平表Table 1 Factor test level table
1.2.3 CMCT-椰子油脂质体质量评价
1.2.3.1 CMCT-椰子油脂质体的微观形态 将上述CMCT-椰子油脂质体和经无水乙醇稀释40倍的椰子油用电子显微镜进行观察。
1.2.3.2 包封率(Entrapment Efficiency,EE)的测定 配制一定浓度的椰子油-无水乙醇溶液,以无水乙醇为空白对照,经紫外分光光度计在200~400 nm范围内扫描,获得椰子油的最大吸收波长为225 nm。配制成一系列浓度梯度为1.0、2.0、3.0、4.0、5.0 mg/mL的标准溶液,通过紫外可见分光光度计在225 nm处测定不同浓度下的椰子油-无水乙醇溶液的吸光度。以质量浓度为横坐标,吸光度值为纵坐标,得标准曲线方程。
精密量取1 mL CMCT-椰子油脂质体,按占总体积比例计算其中所含椰子油量为m总,加入2 mL石油醚,3000 r/min离心5 min,萃取游离椰子油,分离石油醚与脂质体,相同操作5次,残留物用无水乙醇定容10 mL,于225 nm处测吸光度并计算其所对应的椰子油的量作为m游[12-13]。
1.2.3.3 丙二醛(MDA)测定 分别通过测定4 ℃和24 ℃在0、3、5、7、14 d的MDA含量,来判断所制备的CMCT-椰子油脂质体磷脂的氧化情况。测定MDA含量的具体操作方法参考Xia S Q等[14]和郑会娟[15]方法。
1.2.4 脂质体体外释放度研究 紫外检测标准曲线:精密称取椰子油10 mg,用无水乙醇配成浓度为1 mg/mL的储备液。用0.9% NaCl分别稀释成浓度为30、5、80、160、320 μg/mL的溶液,以0.9%NaCl为空白对照,225 nm为检测波长,测定吸收值A,以吸收值A对质量浓度ρ(μg/mL)制得标准曲线[16-17],此标曲用于释放度的测定。
释放度测定方法:精密移取0.5 mL CMCT-椰子油脂质体,加入透析袋中,用透析夹夹紧,放入盛有100 mL 0.9% NaCl的烧杯中,置于37 ℃,100 r/min的水浴恒温振荡器中,分别于0.5、1、2、4、6、8、10、12、24 h取5 mL外液,同时补充5 mL等量新鲜0.9% NaCl。以0.9% NaCl为空白对照,在225 nm处测定吸收值A。将吸收值A代入标准曲线,计算释放的游离药物总量,计算各时间点脂质体的释放度[16-17]。
以下式计算累积释放度:

1.3 数据统计分析
文中实验数据均为3次平行实验,测试结果以均值±标准差来表示。采用SPSS 17.0软件进行统计分析,p<0.05表示差异显著。正交实验结果与分析见表2,方差分析结果见表3。
2 结果与分析
2.1 椰子油标准曲线的制作
如图1所示,以质量浓度ρ为横坐标,以吸光度Abs为纵坐标制作的椰子油标准曲线,其R2为0.9994,表明线性关系良好。(A=0.1681ρ+0.0066)。

图1 椰子油标准曲线Fig.1 Coconut oil standard curve
2.2 单因素实验
2.2.1 CMCT与磷脂质量比对包封率的影响 由图2可以看出,随着CMCT含量的减少,包封率先增加后降低,当CMCT与磷脂质量比为1∶14时,包封率最高达74.56%±0.20%。这可能是最初CMCT含量高、粘度大并且呈絮状物缠绕在脂质体周围,并未对脂质体进行有效的包埋,当CMCT的量减少到一定程度后,使其在脂质体周围形成一层致密的保护层进而提高了包封率。这与白春清[18]研究结果所述原因一致。在CMCT与磷脂质量比为1∶14基础上若再次减少CMCT含量则使其不能完全包封脂质体导致包封率的降低。
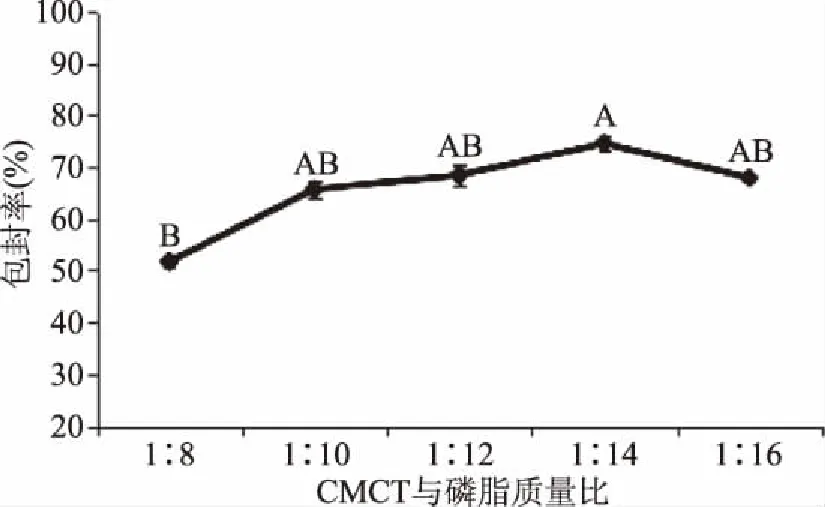
图2 CMCT与磷脂质量比对包封率的影响Fig.2 Effect of CMCT to PC ratio on the encapsulation efficiency of coconut oil注:不同字母表示显著性差异(p<0.05);相同字母表示显著性差异(p>0.05),图3~图7同。
2.2.2 磷脂与CHO质量比对包封率的影响 由图3可知,随着CHO含量的减少,包封率先增加后减少,当磷脂与CHO质量比为6∶1时包封率最高,达84.78%±0.10%。这是因为CHO可以改变磷脂在脂质双层结构中的排列次序及流动性[19],增加膜强度,提高脂质体的稳定性,而当磷脂与CHO质量比为6∶1时,二者产生较好的协同作用,得到了较高的包封率,并起到稳定脂质双分子层的作用。

图3 磷脂与CHO质量比对包封率的影响Fig.3 Effect of phospholipid to cholesterol ratio on encapsulation efficiency
2.2.3 磷脂与椰子油质量比对包封率的影响 由图4可以看出,随着椰子油含量的增加,包封率先增加后降低,当磷脂和椰子油质量比为1∶3时包封率最高,达91.65%±0.40%。这表明在磷脂含量一定时,增加椰子油的量可使双分子层内部非极性尾端的含量上升,即提高包封率,但继续增加含量,膜材料磷脂不足以包封造成包封率下降及椰子油的浪费。
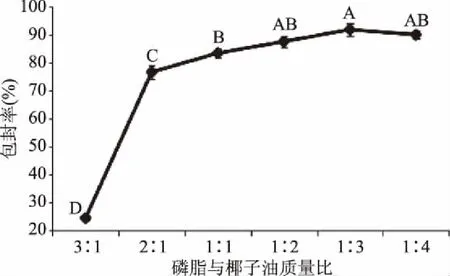
图4 磷脂与椰子油质量比对包封率的影响Fig.4 Effect of lipid to coconut oil ratio on encapsulation efficiency

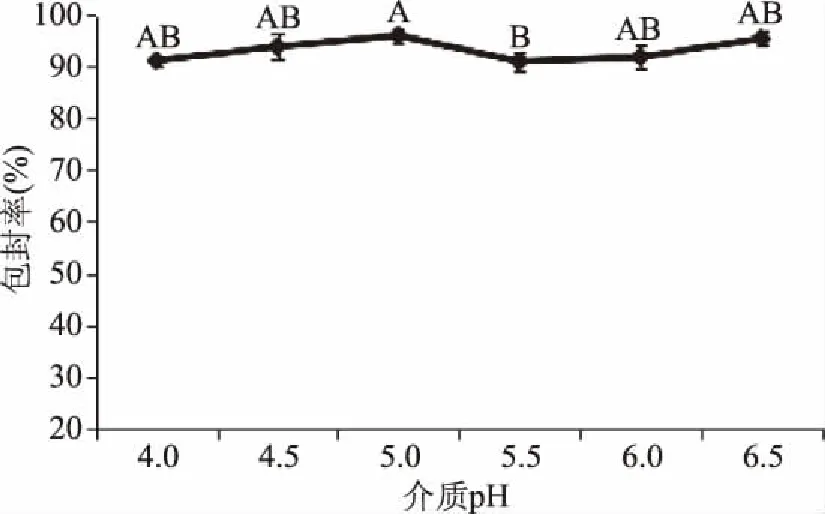
图5 介质pH对包封率的影响Fig.5 Effect of dielectric pH on encapsulation efficiency
2.2.5 超声强度对包封率的影响 由图6可以看出,随着超声强度的增加,包封率先增加后减小,超声强度为700 W时,包封率最高,达到90.21%±0.20%。这是因为超声强度越高,提供的能量越大,强度较低时促进粒子分散,并且保证羧甲基壳聚糖层对传统椰子油脂质体的均匀包封[18]。但当超声强度过高时,导致芯材泄露,造成脂质体包封率下降,同时,造成分散开的粒子间发生融合聚集,导致粒径变大,由此可以说明适当的超声强度可以提高包封率。
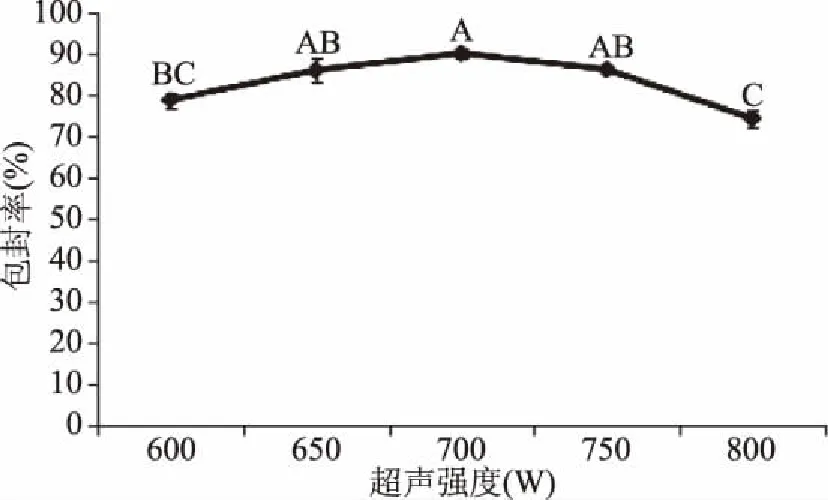
图6 超声强度对包封率的影响Fig.6 Effect of ultrasonic strength on encapsulation efficiency
2.2.6 超声时间对包封率的影响 由图7可以看出,超声时间为20 min时,包封率最高,达到98.27%±0.20%,继续延长超声时间包封率反而降低。这是因为超声时产生的振荡作用可使脂质体粒径变小,从而使各粒径之间的大小差距变得更小且更加均匀,其悬液更加稳定,但超声时间过短,粒径过大,脂质体不稳定,最终导致脂质体发生沉淀。超声时间过长会通过改变局部水化介质的温度引起脂膜发生相变,破坏脂质体的结构,使得包封的椰子油泄露,引起包封率的下降[21]。因此,只有达到适当的超声时间,分散作用发挥出最佳效果。

图7 超声时间对包封率的影响Fig.7 Effect of ultrasonic time on encapsulation efficiency
2.3 正交实验结果与分析
由表2、表3可知,最佳组合为:A3B3C2D1E3F2即:为8∶1,磷脂与椰子油质量比为1∶3,pH为4.5,超声强度为750 W,超声时间为20 min。对此组合条件下进行多次验证实验,包封率可以达到96.94%±0.20%。由表2分析可知各因素对CMCT-椰子油脂质体制备的影响程度依次为:磷脂与椰子油质量比>超声时间>CMCT与磷脂质量比>介质pH>超声强度>磷脂与胆固醇质量比,由表3分析可知在p=0.05水平上,CMCT与磷脂质量比、磷脂与椰子油质量比、介质pH和超声时间的影响达到了显著水平(p<0.05)。
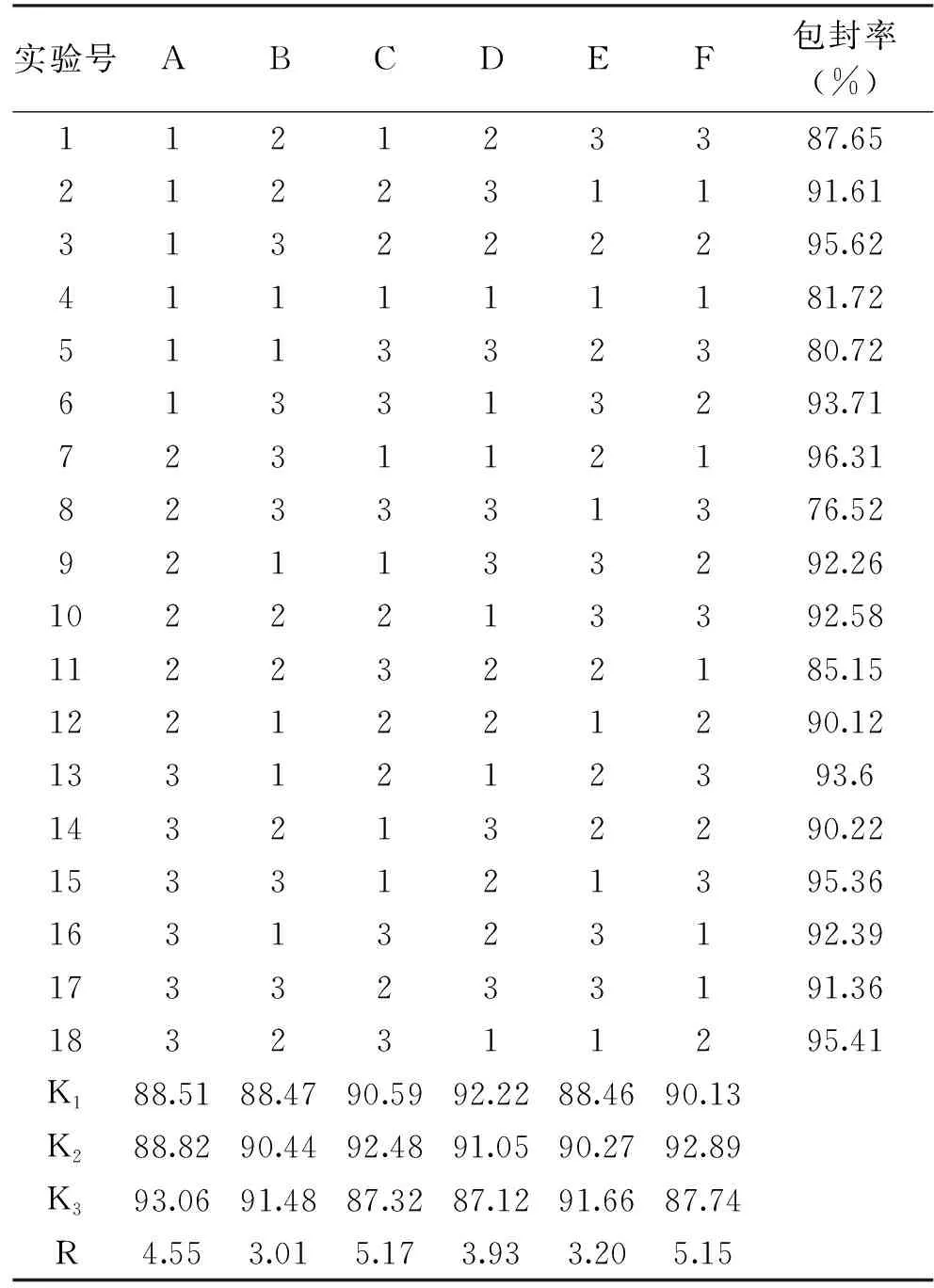
表2 正交实验设计与结果Table 2 Orthogonal experiment design and results

表3 方差分析Table 3 Variance analysis
2.3.1 质量评定
2.3.1.1 椰子油脂质体的微观形态 由图8可以看出,经无水乙醇稀释的椰子油形状不规则,而经薄膜-超声分散法制备的CMCT-椰子油脂质体呈圆形或者椭圆形,双分子膜呈指纹结构,形态完整,该结果说明将椰子油包封在脂质体中使其均匀分散,能更好地发挥椰子油的作用。
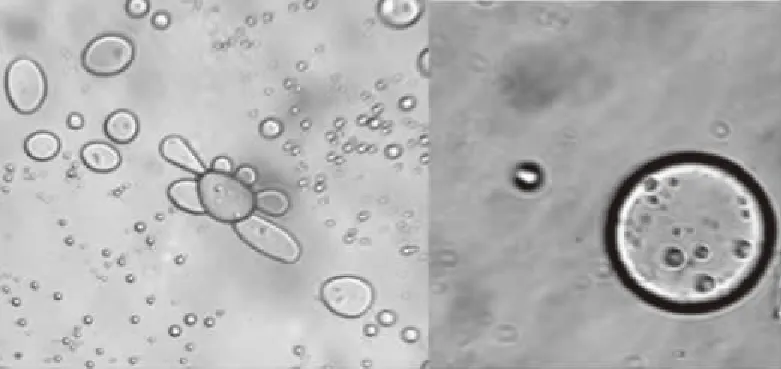
图8 显微镜图片Fig.8 Microscope picture注:(左图:无水乙醇稀释的椰子油,40×;右图:CMCT-包裹椰子油脂质体,250×)。
2.3.1.2 丙二醛的测定 由图9可以看出,随着放置时间的延长丙二醛的含量呈现先上升后下降,且第3 d的MDA最高,这是因为放置的初期,烧瓶内上部空间或混悬液中残留的氧加速了过氧化物的生成,而分解速度较低,导致丙二醛含量增加;放置一段时间后,由于氧的消耗,使过氧化物的生成速度明显降低,从而使测得的氧化值丙二醛值下降。结果表明,4 ℃的MDA值均低于24 ℃且都小于0.1 μg/mg,说明MDA值对温度具有依赖性。Ulmius J等[22]提出MDA含量小于0.1 μg/mg时,不会发生溶血。

图9 MDA随时间的变化曲线Fig.9 MDA with time curve
2.3.1.3 CMCT-椰子油脂质体体外释放度 以质量浓度ρ为横坐标,以吸光度Abs为纵坐标制作释放度紫外检测标准曲线,R2为0.9952,线性关系良好。(A=0.0012ρ+0.2052)
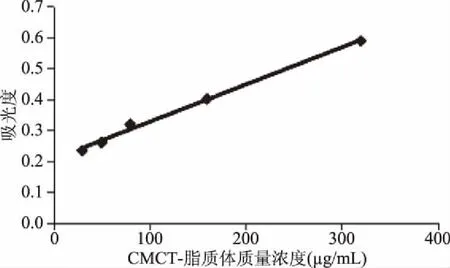
图10 释放度标准曲线的制备Fig.10 Preparation of standard curve of release
CMCT-椰子油脂质体释放度实验结果如图11所示,CMCT-椰子油脂质体在0.9%NaCl中的释放过程为:0.5~1 h较缓慢;1~24 h属于均速释放的过程。其中1 h的累积释放度为6.86%±0.20%,24 h的累积释放度为41.28%±0.30%。得出结论:薄膜-超声分散法制备的CMCT-椰子油脂质体具有很好的缓释效果。
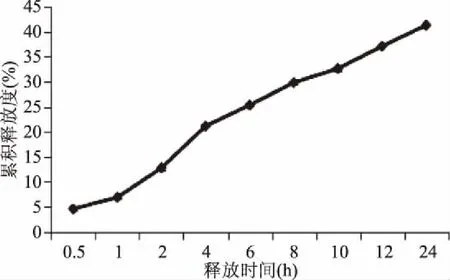
图11 CMCT-椰子油脂质体累积释放度曲线Fig.11 CMCT-coconut oil liposome cumulative release curve
3 结论
薄膜-超声分散法制备CMCT-椰子油脂质体的最佳制备条件为CMCT与磷脂质量比为1∶16,磷脂与CHO质量比为8∶1,磷脂与椰子油量比为3∶1,pH4.5,超声强度750 W,超声时间20 min,此条件下实际包封率为96.94%±0.20%。MDA含量实验结果表明薄膜-超声分散法制备CMCT-椰子油脂质体稳定性好。体外释放实验结果表明24 h后CMCT-椰子油脂质体累积释放度可达到41.28%±0.30%。以上结果表明:该实验制备的CMCT-椰子油脂质体具有包封率高、稳定性好、延缓释放效果好。本文对椰子油脂质体的制备方法和理化性质及其体外释放性能进行了初步研究,为脂质体的制备提供了一定的理论依据,并对脂质体在食品行业和日化工业应用提供了参考。
[1]AstriYulia Sari Lubis,SyariefTaufik H,MelyanaNurul W.The comparison of Striae Graviddarum(SG)number and erythema degree after 8-weekolive oiland virgin coconut oil application among the primigravidatrimester II in tanjungpinang[C]. AASIC,2016.
[2]CuiH,LiW,LiC,et al. Liposome containing cinnamon oil with antibacterial activity against methicillin-resistantStaphylococcusaureusbiofilm[J]. Biofouling,2016,32(1):215-225.
[3]Y Chen,Q Wu,Z Zhang,et al. Preparation of curcumin-loaded liposomes and evaluation of their skin permeation and pharmacodynamics[J]. Molecules,2012,17:5972-5987.
[4]吴韶敏,曹劲松.脂质体技术应用于食品工业的最新研究进展[J].中国油脂,2007,32(3):42-46.
[5]刘高梅,任海伟.葵花籽油脂质体的制备及其稳定性研究[J].中国粮油学报,2011,26(11):47.
[6]Bai C Q,Peng H L,Xiong H,et al.Carboxymethylchitosan-coated proliposomes containing coix seed oil:Characterisation,stability andinvitrorelease evaluation[J]. Food Chemistry,2011,129:1695-1702.
[7]May WencheJøraholmen,ŽeljkaVanic,IngunnTho,et al. Chitosan-coated liposomes for topical vaginal therapy:Assuringlocalized drμg effect[J]. International Journal of Pharmaceutics,2014,472:94-101.
[8]Soo Nam Park,Na Rae Jo,So Ha Jeon.Chitosa n-coated liposomes for enhanced skin permeation ofresveratrol[J]. Journal of Industrial and Engineering Chemistry,2014,20:1481-1485.
[9]程娜娜,陆兔林,陈军,等.莪术油复合磷脂脂质体的制备工艺[J].中国实验方剂学杂志,2010,16(18):15.
[10]Yuan J J,Frank G,Ling J,et al. Preparation,characterization,and antioxidant activity evaluation of liposomes containing water-soluble hydroxytyrosol from olive[J]. Molecules,2017,22:870.
[11]Frenzel M,SteffentH A. Whey protein coating increases bilayer rigidity and stability of liposomes in food-like matrices[J]. Food Chemistry,2015,173:1090-1099.
[12]王宁,齐麟,王娅,等.温度响应型吡唑醚菌酯微囊的制备与性能表征[J].农药学学报,2017,19(3):383.
[13]徐云龙,王伟,钱秀珍.茶树油纳米脂质体制备及处方设计与优化[J].沈阳药科大学学报,2007,24(5):263-266.
[14]Xia S Q,Xu S Y,Zhang X M. Optimization in the preparation of coenzymeQ10nanoliposomes[J]. Agric. Food chemistry,2006,54:6358-6366.
[15]郑会娟.羧甲基壳聚糖包覆的中链脂肪酸纳米脂质体的制备及其性质研究[D].南昌:南昌大学,2012:17.
[16]吕文莉,郭健新,平其能.灯盏花素脂质体的制备及其理化性质的测定[J].中国天然药物,2004,2(5):2-3.
[17]李蕊,王梅.去氢骆驼蓬碱长循环磁纳米脂质体的制备及体外性质的研究[J].西北药学杂志,2017,32(2):183-184.
[18]白春清.羧甲基壳聚糖包覆薏苡仁油前体脂质体的制备、表征、稳定性及体外释放研究[D].南昌:南昌大学,2011:38-39.
[19]Ionescu D,GaneaC. A study of quercetin effects on phospholipid membranes containing cholesterol using Laurdan fluorescence[J]. European Biophysics Journal,2012,41:307-318.
[20]林友文,苏燕评,蒋智清.羧甲基壳聚糖水凝胶的pH敏感性及体外释药性能[J].福建医科大学学报,2005,39(3):331-334.
[21]陈健,张灵芝,谢彦瑰.杨梅苷脂质体的薄膜超声法制备工艺研究[J].中国食品添加剂,2010,4:201-205.
[22]Ulmius J,Lindblom G,Wennerstrom H,et al. Molecular organization in the lipid-crystalline phase of Lecithin-sodium cholate-water systems studied by nuclear magnetic resonance[J].Biochemistry,1982,21:1553.
