果梅绿原酸超声 提取工艺及其抗氧化活性
2018-05-30王兴娜吴晓红陈宝宏
王兴娜,吴晓红,周 惠,余 芳,王 帆,*,陈宝宏,*
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014;2.江苏经贸职业技术学院工程技术学院,江苏南京 211168)
果梅(PrunusmumeSieb. Et Zucc)为蔷薇科植物,又分为白梅、青梅和红梅[1]。我国是果梅的原产地,也是适合种植果梅地域最广的国家[2]。果梅具有很强的抗氧化能力[3-6],据Han[7]等2001年报道,果梅中的芦丁具有较强的抗氧化能力,Yan等[8]2014年报道果梅中的绿原酸具有清除过氧化氢自由基的能力。
正是由于绿原酸具有抗氧化等多种生物功能[10-15],是国际公认的“植物黄金”,需要从植物中提取出来;而在加工过程中,绿原酸很容易与蛋白质中的极性基团结合,影响蛋白的色泽,降低了果品的营养价值[16],这就需要在加工前把绿原酸去除,因此研究绿原酸的提取工艺无论在医药行业还是食品加工业都是很有必要的。
绿原酸含量高的植物有杜仲(树皮中可达5%)、金银花(花中可达5%)、向日葵(籽实中可达3%)、咖啡(咖啡豆中可含2%)、菊花(0.2%)。绿原酸提取方法主要有两种,分别是水提法和有机溶剂提取法。其中杜仲叶绿原酸水提法的最佳工艺条件为:温度60 ℃,料液比(g∶mL)1∶15,提取时间3 h[17]。水提法还有纤维素酶辅助法[16,18-19]。目前还是以乙醇提取法使用较多。杜仲叶中绿原酸乙醇提取法的最佳提取工艺为:乙醇浓度40%,料液比(g∶mL)1∶35,超声波时间30 min,浸泡时间60 min,此条件下绿原酸的得率为8.0418 mg/g[20]。乙醇提取法多以超声辅助提取[21-27]。目前尚未见果梅中绿原酸提取工艺研究的报道。
本文拟采用超声波辅助乙醇提取果梅果肉中绿原酸,对其工艺进行优化,并在前期研究[5]的基础上,用芦丁作阳性对照,用氧化自由基吸收能力(ORAC)为指标,对果实中绿原酸的抗氧化活性作进一步评价,以期为果梅中绿原酸的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
果梅 品种为软条红梅,采自国家果梅种质资源圃(南京);绿原酸标准品 南京景竹生物有限公司;AAPH(偶氮二异丁脒盐酸盐)、芦丁标准品 美国Sigma公司;Trolox(水溶性维生素E) 美国Acros Organics公司;荧光素钠、氯仿、乙酸乙酯、正丁醇、PBS、无水乙醇、NaOH试剂、稀硫酸等 均为国内分析纯。
多功能酶标仪 Mirotek Laborsystem GmbH,Overath Germany;旋转蒸发仪RE-52AA 上海亚荣生化仪器厂;电子天平TE214S 德国赛多利斯股份公司;HH-8数显恒温水浴锅 常州国华电器有限公司;MP3002电子天平 上海恒平科学仪器有限公司;800-1离心机 江苏省金坛市荣华仪器制造有限公司;KQ-300DE超声波清洗器 昆山市超声仪器有限公司;UV5500紫外可见分光光度计 上海元析仪器有限公司;控温多用组织捣碎机 江阴市保利科研有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;微机型pH计 上海康仪仪器有限公司。
1.2 实验方法
1.2.1 绿原酸的提取 果梅果实去核后每份10.0 g称量好,剪碎、捣碎后加入不同体积、不同浓度的酸乙醇(用稀盐酸和NaOH调整)浸泡24 h后,用300 W超声波在不同温度下辅助提取绿原酸20~60 min。绿原酸提取液在25 ℃经4000 r·min-1离心10 min,取上层清液于25 mL容量瓶中,经多次洗涤离心后,用60%乙醇定容至刻度,取其中的1 mL用60%乙醇稀释至25 mL,用紫外分光光度法在328 nm测定提取液的吸光值(A)。
1.2.2 绿原酸提取量的测定
1.2.2.1 绿原酸标准曲线绘制 配制系列浓度为0.0004、0.0008、0.0012、0.0016、0.002、0.0024、0.0028 mg·mL-1的绿原酸标准溶液。在328 nm处测定吸光度,以吸光度值A为纵坐标,以绿原酸标准溶液浓度C为横坐标,绘制绿原酸标准曲线。
1.2.2.2 绿原酸提取量的计算 以对应浓度的乙醇溶液为空白对照。将A代入1.2.2.1得到的绿原酸标准曲线,得到稀释后的绿原酸含量(C)。绿原酸提取含量η(mg/10 g)按以下公式计算:
η=C×25×25/M
式中,C-稀释后绿原酸浓度(mg·mL-1);M-果梅肉鲜重(g);一个25为稀释倍数;一个25为体积(mL)。
1.2.3 果梅肉绿原酸提取单因素实验 准确取果梅果肉10.0 g,加入乙醇进行提取,分别以乙醇浓度、pH、料液比、超声时间、超声温度、提取次数作为因素,每次以一个因素为变量,其它定量,分别测定提取液的吸光值,并计算绿原酸提取量。
1.2.3.1 乙醇浓度对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,5份,按料液比(g∶mL)1∶6的比例分别加入40%、50%、60%、70%、80%的乙醇溶液,调pH=4。浸泡24 h后,在50 ℃下,300 W超声30 min。共提取2次。
1.2.3.2 料液比对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,5份,按料液比(g∶mL)1∶4、1∶5、1∶6、1∶7、1∶8分别加入60%乙醇,调pH=4。浸泡24 h后,50 ℃用300 W超声辅助提取30 min。共提取2次。
1.2.3.3 超声时间对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,5份,按料液比1∶6(g∶mL)加入60%乙醇溶液,调节pH=4。浸泡24 h后,分别在50 ℃用300 W超声辅助提取20、30、40、50、60 min。共提取2次。
1.2.3.4 pH对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,5份,按料液比(g∶mL)1∶6加入60%乙醇溶液,分别调pH=2、3、4、5、6。浸泡24 h后,在50 ℃用300 W超声辅助提取30 min。共提取2次。
1.2.3.5 超声温度对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,5份,按料液比(g∶mL)1∶6分别加入60%乙醇溶液,调节pH=4。浸泡24 h后,300 W超声辅助提取30 min,超声温度分别为20、30、40、50、60 ℃。共提取2次。
1.2.3.6 提取次数对果梅肉绿原酸提取效果的影响 准确称取果梅果肉10.0 g,8份,按料液比(g∶mL)1∶7分别加入60%乙醇溶液,调节pH=4。浸泡24 h后,在50 ℃用300 W超声辅助提取30 min。分别提取1、2、3、4、5、6、7、8次。
1.2.4 正交实验 根据单因素实验结果,按表1因素水平表进行正交实验设计,以优化提取条件。每个处理重复三次。

表1 正交实验因素水平表Table 1 Factors and levels table of orthogonal experiment
1.2.5 绿原酸氧化自由基的吸收能力(ORAC)测定 在96微孔板上加入100 μL不同浓度的绿原酸待测液,同时加入不同浓度的Trolox做对照,再用12道移液器在每孔中加入50 μL 200 nmol/L荧光素钠混合,37 ℃反应15 min后,向每孔中加入50 μL 80 mmol/L的AAPH,诱发荧光淬灭。使用酶标仪的实验设置参数为:激发波长485 nm,发射波长528 nm,37 ℃;循环数:35;循环周期:210 s;振荡:8 s;振荡幅度:4 mm。
ORAC值=[(AUC样品-AUCAPPH)/(AUCTrolox-AUCAAPH)]×(MTrolox/M样品)
式中,AUC-荧光衰退曲线下面积(Area under curve);M-摩尔浓度(Molarity)。
2 结果与分析
2.1 绿原酸标准曲线
由绿原酸溶液浓度(C)和吸光值(A)作图,得线性方程为A=77.946C+0.005(R2=0.9987),线性范围为0.0000~0.0028 mg/mL。

图1 绿原酸吸光值与浓度变化曲线图Fig.1 Variation curve of absorbance and concentration of chlorogenic acid
2.2 单因素实验结果与分析
2.2.1 不同乙醇浓度对果梅肉绿原酸提取量的影响 由图2可知,乙醇浓度由40%提高到60%,绿原酸提取量随着浓度的增加而增加;从60%到80%,绿原酸提取量随着浓度的增加而减少,60%乙醇浸泡提取得到的绿原酸量最高。邓素兰等[28]认为70%以上的乙醇溶液会引起绿原酸沉淀。

图2 乙醇浓度对果梅果肉绿原酸提取量的影响Fig.2 Effect of ethanol concentration on the extraction of chlorogenic acid from Prunus mume
2.2.2 不同料液比对果梅肉绿原酸提取量的影响 由图3可知,料液比(g:mL)为1∶7时经过两次提取,提取得到15.3596 mg/10 g鲜重的绿原酸,是料液比(g:mL)为1∶9提取两次得到绿原酸量(16.216 mg/10 g鲜重)的95%。在1∶7之前,随着料液比的增大,绿原酸提取量较快增长;在1∶7之后,随着液料比的增大,绿原酸提取增加量变化不大。由此可见,料液比为1∶7 (g∶mL)时,较节约且效率较高,可作为提取果梅中绿原酸合适的料液比。
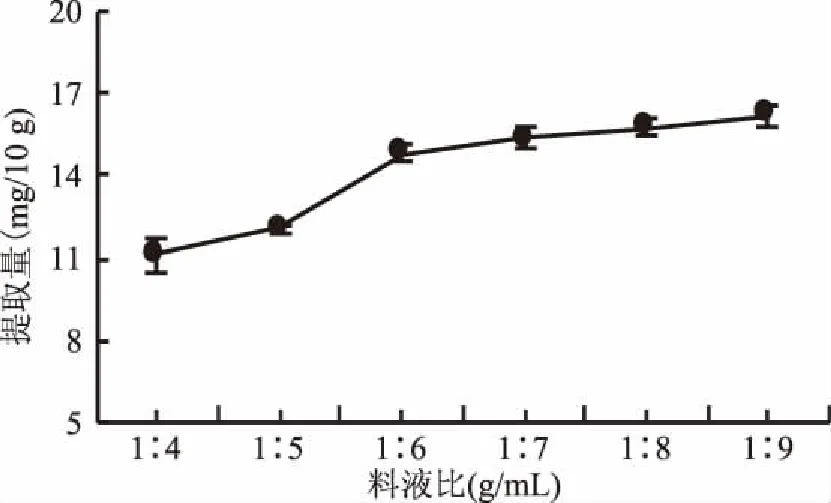
图3 料液比对提取果梅果肉中绿原酸的影响Fig.3 Effect of the ratio of material to liquid on the extraction of chlorogenic acid from Prunus mume
2.2.3 不同超声温度对果梅肉绿原酸提取量的影响 从图4可以看出,用60%乙醇浸泡果梅,然后不同温度下超声30 min,50 ℃前随着超声温度的上升,提取的绿原酸含量也越来越多,在温度为50 ℃时,提取量达到最大;随后温度越高,绿原酸提取量逐渐降低。

图4 超声温度对提取果梅果肉中绿原酸的影响Fig.4 Effect of ultrasonic temperature on the extraction of chlorogenic acid from Prunus mume
因为绿原酸易溶解于热水、乙醇,所以随着温度升高,提取量变大;但绿原酸的邻二酚羟基结构不稳定,温度过高时易氧化分解而使提取率下降,另一方面,在水介质中,超声波产生的微射流对细胞表面产生冲击、剪切,这需要密度与内压比高,在爆破时能形成一定高温与强压梯度的气泡,温度较高时不利于气泡的生成,也造成提取率下降。本实验结果证明,50 ℃的超声温度较适合。
2.2.4 不同超声时间对果梅肉绿原酸提取量的影响 从图5可以看出,用60%乙醇浸泡果梅,随着超声时间变长,绿原酸提取量变高,但超过30 min后,随着超声时间加长,提取量反而下降,需要限定超声时间为30 min。
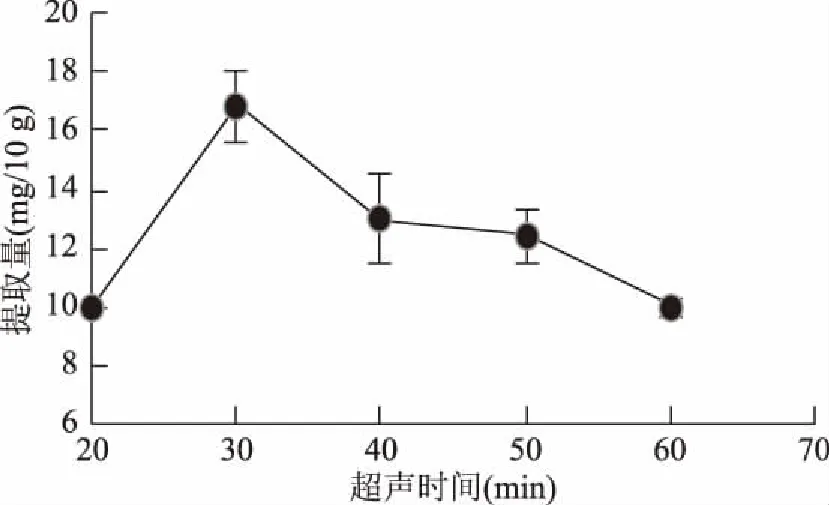
图5 超声时间对提取果梅果肉中绿原酸的影响Fig.5 Effect of ultrasonic time on the extraction of chlorogenic acid from Prunus mume
若要从植物中提取活性成分,需要破碎细胞壁或打通溶剂进入细胞内的通道。细胞壁的主要成分是纤维素、半纤维素及木质素,而超声波能很好的降低纤维素的结晶度和聚合度,打开结晶区,同时使半纤维素部分水解,并除去木质素的包裹,打通溶剂进入细胞内的通道,使提取时间缩短,提高绿原酸的提取率,所以30 min内,超声有利于绿原酸的提取。但超声提取时间过长,容易产生热效应,导致绿原酸发生降解[29],所以绿原酸的提取量又开始下降。
2.2.5 不同pH对果梅果实绿原酸提取量的影响 从图6可知,绿原酸提取量先随着pH的增大而增大,在pH=4时达到最大提取量,随后,随着pH的增大而减小。可见pH=4的60%乙醇提取绿原酸效果最佳。因为绿原酸为酚酸类化合物,在酸性条件下,有利于其溶出,并且酸性条件能使原料的细胞壁软化,因此,一般用酸乙醇进行提取。
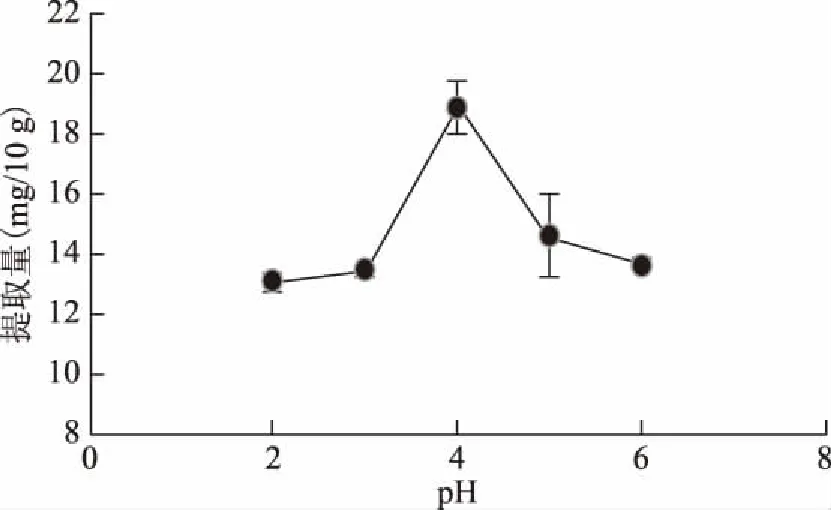
图6 pH对提取果梅果肉中绿原酸的影响Fig.6 Effect of pH value on the extraction of chlorogenic acid from Prunus mume
2.2.6 不同提取次数对绿原酸提取量的影响 从图7可以看出,在最佳单因素条件下,提取8次时,绿原酸的累积提取量为20.3 mg/10 g鲜重;提取次数3次时,提取到的绿原酸的量为19.8 mg/10 g,占8次总提取量的97.4%。因此,如果为节约时间和成本,一般提取3次即可。

图7 提取次数对提取果梅中绿原酸的影响Fig.7 Effect of extraction times on the extraction of chlorogenic acid from Prunus mume
2.3 正交实验结果分析
由表2正交实验均值可以得出提取工艺的最佳组合为A2B2C2D2E2F3,可知,绿原酸的最佳提取工艺是乙醇浓度为60%(A2),料液比(g∶mL)为1∶7(B2),pH为4(C2),超声时间为30 min(D2),超声温度为50 ℃(E2),提取次数为4次(F3)。由极差分析结果可以看出,提取次数对果梅果实中绿原酸提取量影响最大,料液比次之,超声温度、pH、乙醇浓度、超声时间的影响依次减弱。

表2 正交实验结果Table 2 Results of orthogonal test
验证实验表明,在乙醇浓度为60%,料液比(g∶mL)为1∶7,pH为4,超声时间为30 min,超声温度为50 ℃时,提取3次、4次、8次时绿原酸的提取量分别为19.8 mg/10 g鲜重、20.0 mg/10 g鲜重、20.3 mg/10 g鲜重,3次、4次绿原酸的提取量分别占8次的97.4%和98.5%,考虑到3次、4次绿原酸的提取量差异小,加之时间与经济成本,因此,确定提取3次。最终确定最佳组合为A2B2C2D2E2F2,即乙醇浓度为60%(A2),料液比(g:mL)为1∶7(B2),pH为4(C2),超声时间为30 min(D2),超声温度为50 ℃(E2),提取次数为3次(F2),此时绿原酸提取量为19.8 mg/10 g鲜重。
2.4 绿原酸ORAC测定
ORAC法以偶氮类化合物AAPH作为过氧自由源,荧光素钠为荧光指示剂,Trolox为定量标准,用酶标仪进行分析。经测定,绿原酸与芦丁的ORAC值如表3。

表3 芦丁和绿原酸的ORAC值Table 3 ORAC values of chlorogenic acid and rutin
从表3的回归方程及相关系数可见,芦丁和绿原酸的浓度与(AUC样品-AUCAPPH)之间都存在良好的线性相关。回归方程的曲线斜率可以表示各自的抗氧化能力,ORAC值就是各样品曲线斜率与Trolox曲线斜率的比值。经计算,绿原酸比芦丁的ORAC值有显著差异(0.01 根据正交实验和单因素实验结果,最终确定果梅肉中绿原酸提取的最佳工艺条件为:乙醇浓度 60%、料液比(g∶mL)为1∶7、pH为4、超声时间30 min、超声温度50 ℃、提取次数3次。在此提取工艺条件下,得到的绿原酸量为19.8 mg/10 g鲜重。提取过程中,除提取次数和料液比的控制很重要,可以提高绿原酸的提取量外,超声温度、pH的控制也非常重要。 经测定发现,绿原酸的氧化自由基清除能力比芦丁强很多。可见,绿原酸在果梅中含量较高,而其对多种类型的氧化源都具有较强抗氧化能力,因此绿原酸可以作为果梅中一个重要的抗氧化功能成分加以研究。 [1]石嘉怿,张英. 高效液相色谱法测定青梅花、枝、叶中绿原酸类化合物[J].食品科学,2011,32(2):191-194. [2]李庆卫. 梅研究进展[J]. 北京林业大学学报,2004,26(S1):116-122. [3]韩明,曾庆孝,肖更生,等. 青梅提取物对油脂抗氧化性能的研究[J]. 食品研究与开发,2005,26(2):143-146. [4]张慧敏,李远志. 青梅汁抗氧化特性的研究[J]. 食品工业,2016,37(4):104-108. [5]王兴娜,汪晶,黄午阳,等. 青梅果实不同极性组分的抗氧化活性[J]. 江苏农业学报,2016,32(1):211-215. [6]韩明. 青梅果多酚提取及其与抗氧化相关性研究[J]. 食品研究与开发,2007,28(6):31-34. [7]Han JT,Lee SY,Kim KN.Rutin,antioxidant compound isolated from the fruit ofPrunusmume[J]. Journal of the Korean Society of Agricultural Chemistry and Biotechnology,2001,44(1):35-37. [8]Yan XT,Lee SH,Li W,et al. Evaluation of the antioxidant and antiosteoporosis activities of chemical constituents of the fruits ofPrunusmume[J]. Food Chemistry,2014,156:408-415. [9]Daozong Xia,Xiaoqin Wu,Jiayi Shi,et al.Phenolic compounds from the edible seeds extract of Chinese Mei(PrunusmumeSieb. et Zucc)and their antimicrobial activity[J].LWT-Food Science and Technology,2011,44:347-349. [10]Ohnishi M,Morishita H,Iwahashi H,et al.Inhibitory effects of chlorogenic acids on linoleic acid peroxidation and haemolysis[J].Phytochemistry,1994,36(3):579-583. [11]Ren Y D.Anti-hepatitis B virus activity of chlorogenic acid,quinic acid and cafeic acidinvivoandinvitro[J].Antiviral Res.2009,83(2):186-190. [12]Kasai H,Fukad S,Yamaizumi Z,et al. Action of chlorogenic acid in vegetables and fruits as an inhibitor of 8-hydroxydeoxy guanosine formationinvitroand in rat carcinogenesis model[J]. Food and Chemical Toxicology,2000,38(5):467. [13]Gao T Y,Ci Y X,Jian H Y,et al. FTIR investigation of the interaction of tumor cells treated with caffeic acid and chlorogenic acid[J]. Vibrational Spectroscopy,2000,24(2):225. [14]Haitao Shi,Ameng Shi,Lei Dong,et al. Chlorogenic acid protects against liver fibrosisinvivoandinvitrothrough inhibition of oxidative stress[J]. Clinical Nutrition,2016,35:1366-1373. [15]Tunnicliffe J M,Eller L K,Reimer R A,et al.Chlorogenic acid differentially affects postprandial glucose and glucose-dependent insulin tropic polypeptide response in rats[J].Applied Physiology,Nutrition,an d Metabolism,2011,36(5):650-659. [16]王志华,王东洁,赵晋府. 葵花籽绿原酸酶法提取工艺研究[J]. 食品科学,2004,25(1):97-100. [17]王茜,李智,何琦.杜仲叶中绿原酸提取分离工艺条件的研究[J].离子交换与吸附,2008,24(1):73-80. [18]林春梅,周鸣谦. 正交实验优化纤维素酶法提取牛蒡根皮中绿原酸工艺[J]. 食品科学,2013,34(6):64-67. [19]王瑶. 菊花秸秆绿原酸提取工艺的研究[D]. 合肥:安徽农业大学,2013. [20]张蕾,张娜,展雯琳. 正交法优选杜仲叶中绿原酸提取工艺[J]. 现代食品,2016,(14):97-100. [21]刘振春,钱月. 响应面优化超声波微波辅助提取葵花籽绿原酸工艺[J]. 西北农林科技大学学报:自然科学版,2016,44(10):157-164. [22]张小斌,陈书存,雷燕妮.商洛杜仲叶中绿原酸的提取工艺优选研究[J]. 陕西农业科学,2016,62(3):34-39,51. [23]庞秀芬,段若依,赵青,等. 超声辅助索氏提取忍冬果实中绿原酸的工艺优化[J]. 生物资源,2017,39(2):125-129. [24]吴亚超,赵万顺,张文生,等. 栀子中栀子苷和绿原酸的提取工艺研究[J]. 天然产物研究与开发,2016,28(6):910-915. [25]关海宁,刁小琴,乔秀丽,等. 超声协同微波辅助提取稻壳绿原酸的工艺优化[J]. 食品工业,2016,37(1):43-47. [26]黄小梅,邓祥,吴狄. 金银花中绿原酸的超声波提取工艺优化[J]. 食品研究与开发,2015,36(2):41-44. [27]尤秀丽,池路花,曹芸梅,等. 响应面法优化微波超声双辅助提取金银花绿原酸工艺[J]. 食品工业科技,2014,35(12):272-276. [28]邓素兰,余继宏,邓芳琴. 金银花中绿原酸提取工艺的对比[J]. 吉首大学学报:自然科学版,2007,28(2):109-112. [29]肖卓炳,郭瑞轲,郭满满,等. 金银花中绿原酸超声微波双辅助提取工艺优化[J]. 食品科学,2012,33(22):111-114.3 结论
