洋葱皮不同溶剂提取物的体外抗氧化、 抑制α-糖苷酶活性研究
2018-05-30刘世馨杜咏梅侯小东刘新民付秋娟张晓敬
刘世馨,杜咏梅,侯小东,刘新民,付秋娟,张晓敬
(1.中国农业科学院烟草研究所,山东青岛 266101;2.中国农业科学院研究生院,北京 100081)
洋葱(AlliumcepaL.)是食用最广泛的蔬菜之一,具有预防癌症、抗氧化、降血脂、降血糖等多种保健功效[1]。除鲜食外,洋葱还被加工成洋葱粉、洋葱醋、洋葱黄酮胶囊等高附加值产品[2]。在洋葱食用或产品加工过程中,洋葱皮则作为废弃物而浪费。
洋葱皮含有丰富的黄酮、多酚类物质[3],其含量是内部鳞茎的2~6倍[3-5],槲皮素及其糖苷是洋葱皮黄酮类化合物的主要成分[5],据Bhimanagouda S. Patil 报道,洋葱皮槲皮素含量比洋葱鳞茎高达5倍[6]。研究表明,洋葱皮提取物具有较好的抗氧化[7]、减肥[8]、抗血栓[9]、抗炎症作用[10]。Gawlik-Dziki等人将洋葱皮槲皮素和多酚分别作为食品添加剂,提高了面包的抗氧化性[11],抑制胃癌细胞,预防消化道癌症[12]。研究表明,植物多酚、黄酮类化合物具有较好的降血糖作用,通过抑制α-糖苷酶活性以延缓肠道糖类吸收是其降低餐后血糖的主要机制之一[13-14]。目前有关洋葱皮提取物抑制α-糖苷酶活性的研究报道较少。
白明生等[15]研究了洋葱皮总黄酮的超声波提取工艺,陈佳等[16]研究了洋葱皮总黄酮纤维素酶法提取及其抗氧化特征,蒋少华等[17]比较了乙醇回流提取法、超声提取法和微波提取法对洋葱皮总黄酮的提取效果。目前,有关不同提取溶剂对洋葱皮总黄酮、槲皮素的提取效果及其提取物抗氧化、抑制α-糖苷酶活性研究还未见报道。本研究以洋葱皮为材料,研究不同溶剂对洋葱皮总多酚、总黄酮、槲皮素的提取效果及其提取物抗氧化、抑制α-糖苷酶活性,为洋葱资源的梯次高效利用及高附加值功能食品开发提供研究基础。
1 材料与方法
1.1 材料与仪器
洋葱皮样品 山东洋葱食品加工厂;槲皮素对照品 纯度95%,Adamas公司;维生素E(VE)对照品 纯度97%,ALDRICH公司;1,1-二苯基-2-三硝基苦肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸二铵盐(ABTS) TCL公司;2,4,6-三吡啶基三嗪(TPTZ) 阿拉丁公司;吩嗪硫酸甲酯(PMS)、beta-烟酰胺腺嘌呤二核苷二钠(NADH) SIGMA公司;氯化硝基四氮唑蓝(NBT) BIOBEST公司;α-糖苷酶 来源于酵母,750U,SIGMA公司;阿卡波糖 纯度95%,源叶生物公司;对-硝基苯酚-α-D-葡萄糖苷(PNPG)、Folin-Ciocalteu 试剂 SIGMA公司;甲醇、醋酸 为色谱纯;过硫酸钾、NaNO2、AlCl3、石油醚、乙酸乙酯、乙醇、二甲基亚砜(DMSO)等 均为分析纯。
BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;SBL-30DT超声波恒温清洗机 宁波新芝生物科技股份有限公司;循环水式多用真空泵 郑州长城科工贸有限公司;Re100-pro 旋蒸仪 SCILOGEX公司;Multiskan Fc酶标仪 Thermo赛默飞世尔(上海)仪器有限公司;ACQUITY UPLC超高效液相色谱系统、UV检测器 美国Waters公司;其他为实验室常规设备。
1.2 实验方法
1.2.1 洋葱皮提取方法 将紫洋葱皮烘干粉碎至60目备用,参照文献[18]分别精密称取20 g粉末8份,按1∶12 (g/mL)比例加入石油醚、乙酸乙酯、无水乙醇、95%、80%、60%、40%乙醇和水,40 ℃超声浸提20 min,抽滤,滤渣分别用200、180 mL上述溶剂重复提取2次,每次20 min,三次滤液合并,50 ℃减压浓缩至干,称取获得提取物的质量,获得的提取物用DMSO溶解,配制成质量浓度为2%的溶液,该溶液为提取物母液。
1.2.2 洋葱皮提取物总多酚、总黄酮及槲皮素含量测定 根据相关化合物测定方法要求,将1.2.1获得的洋葱皮提取物母液分别用甲醇稀释至适宜浓度,获得总多酚、总黄酮及槲皮素待测液。
1.2.2.1 总多酚的测定 总多酚的测定采用Folin-Ciocalteu比色法,参照Singleton的方法[19],并做一些修改,以没食子酸作标样,绘制标准曲线。移取25 μL稀释后的Folin-Ciocalteu试剂(用水稀释10倍),分别加入25 μL 10~100 μg/mL的没食子酸溶液,充分混匀后室温反应5 min,依次加入100 μL蒸馏水和25 μL 20% Na2CO3溶液,充分混匀,黑暗条件室温反应30 min,760 nm测定吸光度,每处理3次重复,得到没食子酸质量浓度Y(μg/mL)与吸光度A的线性回归方程为y=6.0088x+0.0171,R2=0.9969。根据回归方程计算洋葱皮提取物中总多酚含量,结果以没食子酸当量表示,单位为mg/g,洋葱皮提取物总多酚纯度和提取率计算方法:


式中:M1表示提取物质量,单位为g,M表示称取洋葱皮粉末质量,单位为g。
1.2.2.2 总黄酮的测定 总黄酮的测定采用氯化铝比色法,参照Jia,Zhishen的方法[20],以槲皮素作标样,绘制标准曲线。吸取100 μL 0.066 mol/L的NaNO2于96孔板中,分别加入50 μL 100~800 μg/mL的槲皮素溶液,充分混匀后室温反应5 min后,加入15 μL 10% AlCl3,充分混匀室温反应6 min,最后加入100 μL 1 mol/L的NaOH终止反应,在510 nm测定吸光度,每处理3次重复,得到槲皮素质量浓度y(μg/mL)与吸光度A的线性回归方程为y=2.0324x+0.0585,R2=0.9991。根据回归方程计算提取物中总黄酮含量,结果以槲皮素当量表示,单位为mg/g,洋葱皮提取物总黄酮纯度及提取率计算方法与1.2.2.1同。
1.2.2.3 槲皮素的测定 洋葱皮提取物槲皮素含量参照崔涛的方法[21],用液相色谱测定。称取适量槲皮素对照品,配制成20、30、40、60、80 μg/mL的对照品工作溶液。提取物待测液过0.22 μm微孔滤膜,用液相色谱分离、检测,外标法定量,每处理3次重复。洋葱皮提取物槲皮素纯度及提取率计算方法与1.2.2.1同。
液相色谱条件为:Waters ACQUITY UPLC BEH C18色谱柱(150 mm×2.1 mm,1.7 μm)柱温为35 ℃;流速为0.3 mL/min;进样体积为5 μL;流动相A为纯甲醇,流动相B为含0.5%(V/V)醋酸水溶液;程序梯度为:0~2 min,35% A;2~4 min,35%~60% A;4~6 min,60%~80% A;6~8 min,80%~100% A;8~10 min,100%~80% A;10~12 min,80%~60% A;12~13 min,60%~35% A;检测波长为370 nm。
1.2.3 洋葱皮提取物体外抗氧化活性实验 将1.2.1获得的洋葱皮不同溶剂提取物母液(浓度为2%)分别用甲醇稀释,配制成浓度为20、40、80、100、200、400、800、1000 μg/mL的待测溶液。
1.2.3.1 总还原能力测定 总还原能力测定参考Ang,LZP的方法[22],准确吸取150 μL FRAP试剂于96微孔板中,加入50 μL不同浓度(20~1000 μg/mL)的洋葱皮提取物待测液,反应10 min后在593 nm下测吸光值,以槲皮素甲醇溶液作阳性对照,50 μL甲醇代替样品加入FRAP试剂中作空白对照,每个处理重复3次。还原力用样品反应后的吸光值Ai表示。
1.2.3.2 DPPH·清除能力测定 DPPH·清除能力测定参考 Fabrizia Brisdelli的方法[23],吸取50 μL不同浓度(20~400 μg/mL)的洋葱皮提取物待测液加入到150 μL 0.3 mmol/L DPPH·甲醇溶液中,混匀后于暗处30 ℃反应30 min,用酶标仪517 nm波长下测定吸光度值,以槲皮素/VE甲醇溶液作阳性对照,50 μL甲醇代替样品加入到DPPH·甲醇溶液中作为空白对照,每个处理重复3次。DPPH·清除率按照以下公式进行计算:

式中:Ao为空白的吸光度值,Ai为样品反应溶液的吸光度值。
IC50指待测样品抑制率达到50%时对应的提取物浓度。其计算方法为:以待测样品浓度为自变量(X),抑制率为因变量(Y),获得待测样品浓度与其清除DPPH·能力的关系线性方程,根据线性方程,计算待测样品抑制率达到50%时对应的提取物浓度IC50值。
1.2.3.3 ABTS+·清除能力测定 ABTS+·清除能力测定参考Ang,LZP的方法[22],将1.1 mg/mL的ABTS+·甲醇溶液和0.68 mg/mL的过硫酸钾水溶液等体积混合,暗室静置过夜,制备ABTS+·工作液;调整吸光度0.7左右,取150 μL以上试剂于96孔板中,加入50 μL不同浓度(20~400 μg/mL)的洋葱皮提取物待测液,室温暗处反应30 min。用酶标仪734 nm波长测定吸光度。以槲皮素/VE甲醇溶液作阳性对照,50 μL甲醇代替样品加入ABTS+·工作液中作为空白对照,每个处理做3次重复。ABTS+·清除率和IC50值计算方法与1.2.3.2相同。
1.2.4 洋葱皮提取物抑制α-糖苷酶活性实验α-糖苷酶抑制活性测定参照Masao Hattori的方法[25],并做调整。实验分为对照空白组、对照反应组、样品空白组和样品反应组,在96孔板中进行加样。依次加入0.1 mol/L磷酸缓冲液(pH为6.8)、不同浓度(100~1000 μg/mL)的洋葱皮提取物待测液和2.0 mmol/L PNPG底物,混合均匀,于37 ℃水浴保温10 min,取出,加入37 ℃水浴的0.9 U/mL酶溶液,充分混匀,于37 ℃水浴反应20 min,加入150 μL 1.0 mol/L 的Na2CO3溶液终止反应,405 nm测定吸光度,以槲皮素/阿卡波糖甲醇溶液作阳性对照,每处理3个重复。α-糖苷酶的IC50值计算方法与1.2.3.2相同。根据以下公式计算α-糖苷酶的抑制率:

式中:Ab为对照空白吸光度值,Ac为对照反应吸光度值,As为样品空白吸光度值,Asb为样品反应吸光度值。
1.3 数据分析
采用Excel和DPS 17.0软件进行数据处理和统计分析,结果用平均值±SD表示,采用最小显著差异法(LSD)进行方差分析。
2 结果与分析
2.1 洋葱皮提取物总多酚、总黄酮、槲皮素的提取率及纯度
由表1看出,石油醚提取物总多酚、总黄酮、槲皮素的提取率及纯度均较低,乙酸乙酯提取物总多酚、总黄酮、槲皮素纯度较高,但其提取率较低。水及乙醇溶液对洋葱皮总多酚、总黄酮及槲皮素的提取率均显著高于石油醚、乙酸乙酯,随乙醇浓度升高,总多酚、总黄酮、槲皮素提取率及纯度均呈先升高后降低趋势,其中,60%乙醇提取物总多酚、总黄酮、槲皮素提取率最高,分别达5.5%、9.87%、3.25%,60%乙醇提取物总多酚、总黄酮的纯度分别高达(33.12%±0.39%)、(59.44%±0.38%),均显著高于水及其他浓度乙醇溶液提取物。综合考虑不同溶剂对洋葱皮总多酚、总黄酮、槲皮素提取率及纯度,60%乙醇溶液效果最好。

表1 不同溶剂洋葱皮提取物总多酚、总黄酮、槲皮素提取率和纯度Table 1 The extraction rate and purity of the total polyphenols,total flavonoids and quercetin of different solvent onion peel extracts
2.2 洋葱皮提取物体外抗氧化活性
2.2.1 总还原能力 由表2可见,在20~1000 μg/mL质量浓度范围内,同一溶剂洋葱皮提取物随其质量浓度的增加,其还原能力呈逐渐增加趋势(吸光度越大,还原能力越强)。在提取物质量浓度一致的情况下,随乙醇浓度的增加,其总还原力呈先增加后降低的趋势,其中40%~80%乙醇提取物总还原力显著高于其他溶剂提取物。

表2 不同溶剂洋葱皮提取物总还原力(A593)Table 2 Total reducing power absorbance of different solvent onion peel extracts(A593)

表3 不同溶剂洋葱皮提取物DPPH·清除率及其IC50值Table 3 DPPH· scavenging rate and IC50 value of different solvent onion peel extracts
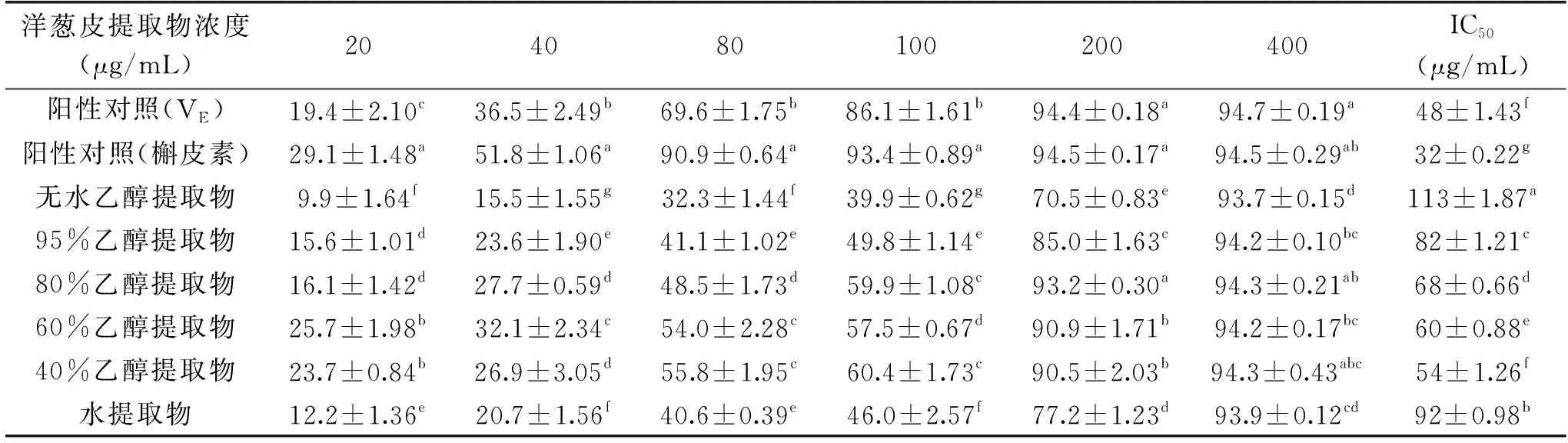
表4 不同溶剂洋葱皮提取物ABTS+·清除率及其IC50值Table 4 ABTS+· scavenging rate and IC50 value of different solvent onion peel extracts

表5 不同溶剂洋葱皮提取物清除率及其IC50值Table scavenging rate and IC50 value of different solvent onion peel extracts

2.3 洋葱皮提取物抑制α-糖苷酶活性
由表6看出,在同样质量浓度条件下,洋葱皮不同溶剂提取物对α-糖苷酶活性抑制率均显著高于同浓度的阿卡波糖(p<0.05),说明洋葱皮提取物对α-糖苷酶具有较好的抑制作用。在100~1000 μg/mL质量浓度范围内,同一溶剂洋葱皮提取物随着提取物质量浓度增加,其对α-糖苷酶活性抑制率逐渐增大。在提取物质量浓度一致的情况下,随乙醇浓度增加,其提取物对α-糖苷酶活性抑制率呈先增高后降低趋势,其中,40%、60%乙醇溶液提取物抑制α-糖苷酶活性IC50值显著小于其他溶剂提取物(p<0.05),其IC50值分别为(329±3.12)、(364±2.72) μg/mL。当提取物质量浓度达到1000 μg/mL时,40%、60%乙醇溶液提取物对α-糖苷酶活性抑制率分别达84.4%、83.0%,与槲皮素对α-糖苷酶活性抑制率接近。
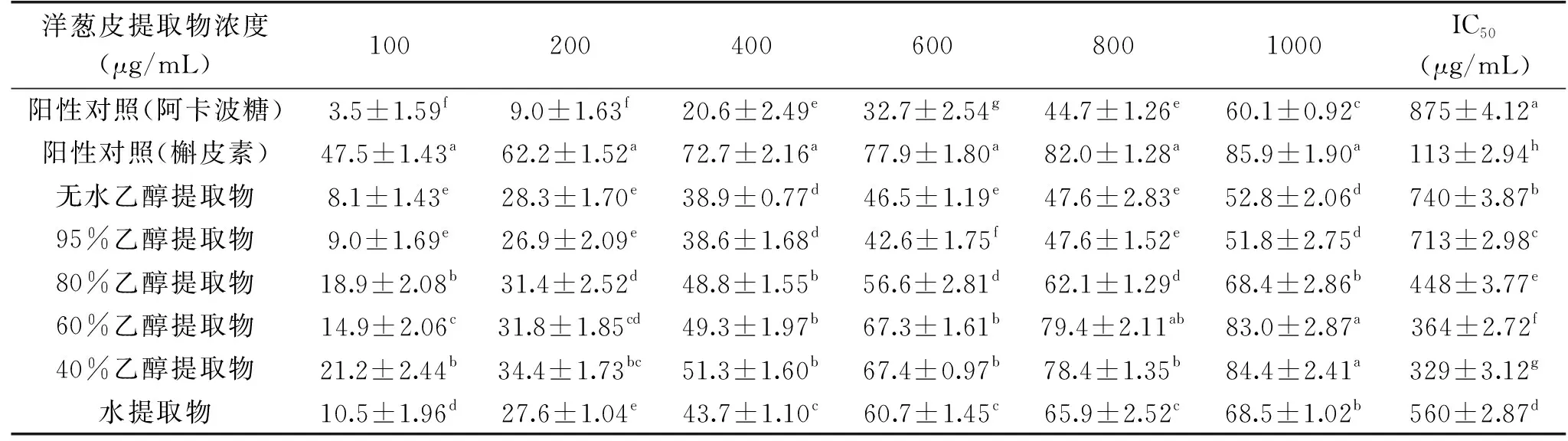
表6 不同溶剂洋葱皮提取物α-糖苷酶活性抑制率及其IC50值Table 6 Inhibition rate of α-glucosidase activities and IC50 value of different solvent onion peel extracts
2.4 洋葱皮提取物抗氧化、抑制α-糖苷酶活性与其总多酚、总黄酮、槲皮素含量的相关性分析

表7 洋葱皮提取物的抗氧化、抑制α-糖苷酶活性与总多酚、总黄酮、槲皮素含量的相关性Table 7 The correlation between antioxidant,inhibition of α-glucosidase activities and contents of the total polyphenols,total flavonoids and quercetin of onion peel extracts
3 结论与讨论
本研究分别以水、40%~100%乙醇溶液、乙酸乙酯、石油醚为溶剂提取洋葱皮活性成分,综合分析不同溶剂提取物总多酚、总黄酮及槲皮素的提取率和纯度,以60%乙醇作为溶剂对洋葱皮活性成分的提取效果最好。综合考虑不同溶剂提取物对总多酚、总黄酮及槲皮素的提取率和纯度以及其体外抗氧化、抑制α-糖苷酶活性,以60%乙醇作为溶剂最好。通过相关分析发现,不同溶剂提取物总黄酮、槲皮素含量与其抗氧化、抑制α-糖苷酶活性相关性均达极显著水平,尤其槲皮素含量与提取物生物活性相关性最高。
根据研究结果,洋葱皮60%乙醇溶液提取物中总多酚、总黄酮、槲皮素的含量(或纯度)分别达33.1%、59.4%、19.7%,槲皮素属于黄酮类化合物,因此,洋葱皮乙醇提取物活性成分主要为多酚及黄酮类化合物,由于多酚及黄酮类化合物均具有酚羟基,二者含量的测定结果中可能存在交叉,从而使提取物中多酚、黄酮类物质总量的测定结果(达92.5%)可能比实际值偏高。当然,洋葱皮还含有多糖等其他活性成分,下一步还需加强研究。
有大量研究表明总多酚和总黄酮是抗氧化活性的物质基础,多酚和类黄酮含量较高的样品显示出更高的抗氧化活性[3],孙霁寒等[26]、刘曦等[18]、张伟等[27]研究表明豆腐柴、蓝莓叶和黑莓籽提取物的抗氧化活性和总黄酮、总多酚含量有关。总黄酮和槲皮素的抗氧化作用更是受到人们的重视,枇杷叶、小麦胚芽中黄酮都有较好的清除自由基能力[28-29]。Myung-Hee Kim等[30]研究了洋葱皮提取物的抗氧化和降糖活性。洋葱皮富含黄酮类化合物,尤其槲皮素含量丰富,因此,洋葱皮提取物可作为天然强抗氧化剂和α-糖苷酶抑制剂的来源。
王菲等[31]、陈海龙等[32]、韩强等[33]采用响应面法分别对金花葵花总黄酮、黄蜀葵花槲皮素、杨梅渣槲皮素的提取工艺进行了优化,Wiestaw Wiczkowski等[34]探讨了洋葱皮槲皮素及其衍生物的生物利用度,In Seong Choi等[35]利用酶水解法和纳米模型高效回收了废弃洋葱皮中的黄酮槲皮素。为更好地利用洋葱皮农业废弃物资源,在本研究基础上采用响应面法进一步将洋葱皮总黄酮和槲皮素提取工艺优化,并进行纯化,将纯化后的产物进行应用性研究,为洋葱保健食品和天然抗氧化剂的开发提供理论基础。
[1]廖春龙,阮征,印遇龙,等.洋葱化学成分、生理保健功能和我国洋葱加工现状与发展趋势[J]. 食品工业科技,2010,31(8):409-412.
[2]Lee E J,Patil B S,Yoo K S.Antioxidants of 15 onions with white,yellow,and red colors and their relationship with pungency,anthocyanin,and quercetin[J]. LWT-Food Science and Technology,2015,63(1):108-114.
[3]Albishi T,John J A,Al-Khalifa A S,et al. Antioxidative phenolic constituents of skins of onion varieties and their activities[J]. Journal of Functional Foods,2013,5(3):1191-1203.
[4]徐德峰,张卫明,孙晓明,等. 洋葱皮中黄酮类化合物的初步分析[J]. 食品科技,2006,31(8):275-279.
[5]张维冰,王智聪,张凌怡. 超高效液相色谱-光电二极管阵列检测-串联四级杆质谱法测定红洋葱中黄酮醇及其糖苷类化合物[J]. 分析化学,2014,42(3):415-422.
[6]Patil B S,Pike L M,Yoo K S. Variation in the Quercetin Content in Different Colored Onions(AlliumcepaL.)[J]. Journal of the American Society for Horticultural Science American Society for Horticultural Science,1995,120(6):909-913.
[7]Suh H J,Lee J M,Cho J S,et al. Radical scavenging compounds in onion skin[J]. Food Research International,1999,32(10):659-664.
[8]Moon J,Do H J,Kim O Y,et al. Antiobesity effects of quercetin-rich onion peel extract on the differentiation of 3T3-L1 preadipocytes and the adipogenesis in high fat-fed rats[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2013,58(2):347.
[9]Lee S M,Moon J,Chung J H,et al. Effect of quercetin-rich onion peel extracts on arterial thrombosis in rats[J]. Food & Chemical Toxicology,2013,57(6):99-105.
[10]Kim J,Kim J S,Park E. Cytotoxic and anti-inflammatory effects of onion peel extract on lipopolysaccharide stimulated human colon carcinoma cells[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2013,62(12):199-204.
[11]Gawlik-Dziki U,Aswieca M,Dziki D,et al. Quality and antioxidant properties of breads enriched with dry onion(AlliumcepaL.)skin[J]. Food Chemistry,2013,138(2-3):1621-1628.
[12]Gawlik-Dziki U,Kaszuba K,Piwowarczyk K,et al. Onion skin-Raw material for the production of supplement that enhances the health-beneficial properties of wheat bread[J]. Food Research International,2015,73:97-106.
[13]翟清波,李诚,王静,等. 植物多酚降血糖和降血脂作用研究进展[J]. 中国药房,2012(3):279-282.
[14]俞灵莺,李向荣. 植物黄酮类抗糖尿病及其并发症的研究进展[J]. 环境卫生学杂志,2000(6):331-335.
[15]白明生,陈彦云,李国旗. 洋葱皮总黄酮的超声波提取工艺研究[J]. 食品科技,2008,33(12):190-193.
[16]陈佳,徐怀德,米林峰,等. 洋葱皮总黄酮纤维素酶法提取及抗氧化研究[J]. 食品科学,2011,32(4):37-41.
[17]蒋少华,王文亮,弓志青,等. 洋葱皮中类黄酮不同提取工艺的比较[J]. 食品科技,2014(8):191-195.
[18]刘曦,祝连彩,王伯初. 蓝莓叶不同溶剂提取物抗氧化活性研究[J]. 食品工业科技,2013,34(12):101-105.
[19]Lamuela-Raventós R M,Singleton V L,Orthofer R. Analysis of Total Phenols and Other Oxidation Substrates and Antioxidants by Means of Folin-Ciocalteu Reagent[M]//Exercises in general chemistry and qualitative analyses[J]. Wiley & sons,1999:152-178.
[20]Jia Z,Tang M,Wu J. The determination of flavanoid contents on mulberry and their scavenging effects on superoxide radical[J].Food Chemistry,1999,64(4):555-559.
[21]崔涛,夏伟军,彭玲芳. 七叶莲提取物中总黄酮和槲皮素的含量测定[J]. 药物分析杂志,2011(11):2054-2057.
[22]Ang L Z P,Hashim R,Sulaiman S F,et al.Invitro,antioxidant and antidiabetic activites of Gluta torquata[J]. Industrial Crops & Products,2015,76:755-760.
[23]Brisdelli F,Perilli M,Sellitri D,et al. Cytotoxic activity and antioxidant capacity of purified lichen metabolites:aninvitrostudy[J]. Phytotherapy Research,2013,27(3):431-437.
[24]Sachiko Hirota,Taeko Shimoda A,Umeo Takahama. Tissue and Spatial Distribution of Flavonol and Peroxidase in Onion Bulbs and Stability of Flavonol Glucosides during Boiling of the Scales[J]. Journal of Agricultural & Food Chemistry,1998,46(9):3497-3502.
[25]Ma ChaoMei,Sato,N,Li XiaoYu,et al. Flavan-3-ol contents,anti-oxidative andα-glucosidase inhibitory activities of Cynomorium songaricum[J]. Food Chemistry,2010,118(1):116-119.
[26]孙霁寒,黄玲艳,顾嘉昌,等. 豆腐柴提取物不同极性部位的总酚、总黄酮含量及体外抗氧化活性[J]. 食品工业科技,2017,38(15):55-58.
[27]张伟,尹震花,张勇,等. 黑莓籽总多酚、总黄酮含量及其抗氧化活性[J]. 食品工业科技,2015,36(8):125-128.
[28]付晓丹,汤春丰,刘壤莲,等. 枇杷叶黄酮提取物的抗氧化作用研究[J]. 食品工业科技,2015,36(1):135-139.
[29]罗松明,张志清,向建军,等. 小麦胚芽中黄酮类物质的超临界CO2萃取及其抗氧化作用[J]. 食品工业科技,2012(1):272-274.
[30]Kim M H,Jo S H,Jang H D,et al. Antioxidant activity andα-glucosidase inhibitory potential of onion(AlliumcepaL.)extracts[J]. Food Science & Biotechnology,2010,19(1):159-164.
[31]王菲,孙一焱,解长海,等. 金花葵花总黄酮的提取及体外抗氧化活性研究[J]. 食品工业科技,2017,38(16):189-193,198.
[32]陈海龙,江帆,丁小艳,等. 响应面分析法优化黄蜀葵花中金丝桃苷、异槲皮苷、槲皮素提取工艺的研究[J]. 食品工业科技,2015,36(24):216-221.
[33]韩强,陈卫,叶立斌,等. 响应面法优化杨梅渣中槲皮素提取工艺的研究[J]. 食品工业科技,2011(10):316-320.
[34]Wiczkowski W,Nèmeth K,Bucin Ski A,et al. Bioavailability of quercetin from flesh scales and dry skin of onion in rats[J]. Polish Journal of Food & Nutrition Sciences,2003,12(53):95-99.
[35]Choi I S,Cho E J,Moon J H,et al. Onion skin waste as a valorization resource for the by-products quercetin and biosugar[J]. Food Chemistry,2015,188:537-542.
