PtRu合金催化剂电催化氧化甲醇的作用机理
2018-05-30王媛媛原沁波卫国强段东红张忠林王恩志郝晓刚刘世斌
王媛媛,原沁波,卫国强,段东红,张忠林,王恩志,李 瑜,郝晓刚,刘世斌
(1.太原理工大学 化学化工学院,太原 030024;2.清华大学 水沙科学与水利水电工程国家重点实验室,三江源协同创新研究中心,北京 100084)
直接甲醇燃料电池(DMFC)结构简单,操作简单,安全环保,易于运输,应用前景十分广阔,已成为21世纪最重要的绿色化学与实现清洁能源的新技术之一[1]。纳米金属Pt是现今DMFC单元催化剂中活性最高、使用最为普遍的材料,但DMFC阴阳两极的电化学反应属于多相催化过程,反应中间产物(COads等)易引起催化剂中毒失活[2],以至于纳米金属Pt性能低下和失活成为DMFC研究发展的关键核心问题。催化机理的明确与深化理解对催化剂的发展至关重要[3],催化机理的研究可为提高催化剂性能,改进催化剂制备方法提供坚实的理论依据。
PtRu合金是目前稳定性以及电化学活性最好的一种纳米合金催化剂[4],但对于其电催化甲醇氧化机理一直存在争议,阻碍了Pt基纳米金属催化剂的进一步发展。据已有的文献可知,较多的研究者主张“双功能机理”[5-7]。这一机理早在1987年由WATANABE et al[8]在研究PtRu纳米合金电催化氧化甲醇的过程中提出。机理认为,H2O分子在PtRu纳米合金的表面Ru活性位上发生活化,活化生成的OHads可促进PtRu纳米合金在低电势下氧化占据Pt活性位的COads,从而减少COads对Pt活性位的覆盖率,提高抗COads中毒的性能。电子效应[4,9]是TODA et al[10]在合成并研究PtFe纳米合金催化剂性能时提出。研究发现,当Fe原子比达到50%时,其催化活性比纳米Pt/C高出25倍,认为活性提高的主要原因是纳米金属表面Pt原子的5d轨道空穴的增加,不是Pt原子间距的改变,由此提出了一个新的理论即“电子效应机理”。之后,LIU et al[11]合成了SiO2负载的PtPd纳米合金,在对比XPS测试的纳米合金与纳米纯Pt的Pt4f结合能时发现,合金中Pt4f结合能都向更大值偏移,说明PtPd纳米合金中Pt原子与Pd原子间存在强烈的电子交互作用。
核壳结构催化剂中,壳层金属会与核层金属之间发生相互作用(如电子效应、协同效应等),从而改变壳层金属性质,提高催化性能。目前,成功合成的核壳型催化剂有:Fe2O3@Pt,Ag@Pt,Co@Pt,Ni@Pt,Cu@Pt,Ru@Pt[12]等。RAMREZ et al[13]采用量子化学法研究二元核壳型R@Pt(R=Au,Rh,Co,Cu,Ni,Ag等)催化剂模型ORR活性时,通过计算发现,核层金属可改变壳层Pt原子的d轨道空穴和Pt晶格间距,有效减弱CO在Pt原子表面的吸附,提高氧还原反应转换效率,说明双金属核壳结构催化剂中电子交互作用提高其催化活性。
目前,众多研究者们或主张双功能机理,或主张电子效应机理,对Pt基纳米合金催化活性提升的认识不够一致,明显影响了新型催化剂的研究发展进程。虽然,双功能机理和电子效应从不同的角度出发,能够阐明Pt基纳米合金的一些实验现象,各有一定的优势,但都存在某些实验现象无法解释的困境。
本课题组赵硕等[14]成功合成了Ru@Pt/C核壳型催化剂,并且证明其存在电子效应。本文在此基础上采用不同的制备方法合成直径相近、Pt/Ru原子比例不同的合金型PtRu/C和核壳型Ru@Pt/C催化剂,通过EDS、XPS等一系列物理技术手段,不同的表征方式说明两种催化剂中Pt,Ru原子间的电子效应的存在及其强度;通过循环伏安法、交流阻抗法表征催化剂电化学性能,通过对比分析,进一步揭示明确合金型PtRu/C催化剂电催化甲醇氧化的催化作用机理,为DMFC用Pt基纳米金属催化剂的发展提供支持。
1 实验部分
1.1 材料与试剂
四氯化铂(PtCl4,99.9%,ALDRICH),三氯化钌(RuCl3,99.9%,ALDRICH),硼氢化钠(NaBH4,99.99%,ALDRICH),Nafion乳液(质量分数5%,美国杜邦公司);XC-72导电炭黑(美国Carbor公司),其余试剂均为分析纯级。
1.2 催化剂的制备
PtRu/C、Pt/C催化剂的制备采用文献[15]制备方法。先将PtCl4、RuCl3前驱体溶解于四氢呋喃(THF)、超纯水(H2O)、乙醇(C2H5OH)三元混合溶液中,负载在XC-72导电碳黑上,再以NaBH4溶液作还原剂充分还原,离心洗涤后,真空烘干,研磨制得催化剂。
Ru@Pt/C催化剂的制备采用KAPLAN et al[16]所发表文献中制备方法。RuCl3溶解于HCl溶液中,XC-72导电碳黑负载后,调节PH值,分两次滴加NaBH4还原剂,之后再加入PtCl4的HCl溶液,滴加NaBH4还原剂。最后离心洗涤,真空烘干,研磨制得催化剂。
不同n(Pt)∶n(Ru)比例的样品可通过调整PtCl4,NaBH4和XC-72导电碳黑等的加入量用上述方法制备,纯Pt/C则无需加入RuCl3,依据Pt/Ru原子比,分别将样品标记为Pt0.33Ru1/C,Pt0.5Ru1/C,Pt1Ru1/C,Pt2Ru1/C,Pt/C;Ru1@Pt0.33/C,Ru1@Pt0.5/C,Ru1@Pt1/C,Ru1@Pt2/C.
1.3 薄膜工作电极的制备
以玻碳电极作为工作电极基底,用超细Al2O3粉末(<2 μm)擦拭玻碳电极表面,之后放在丙酮中超声洗涤去除表面杂质,放入烘箱空气气氛下40 ℃烘干;称量0.012 g样品于10 mL烧杯中,加入3 mL超纯水、2 mL无水乙醇混合,细胞粉碎机中超声分散10 min至混合物形成油墨状,微量移液器量取25 μL悬浊液涂于玻碳电极表面,空气气氛下烘箱中50 ℃烘干,再取10 μL Nafion乳液涂催化剂上,红外灯下80 ℃烘烤成膜,即得到薄膜工作电极。本实验工作电极催化剂担载量为0.212 mg/cm2.
1.4 催化剂的物理表征
催化剂晶型采用D/max-2500型X射线衍射仪(XRD,日本Rigaku公司)进行检测,辐射源为Cu Kα,管电压40 kV,管电流40 mA,扫描范围2θ=5°~85°,扫描速度8(°)/min.催化剂的微观形貌采用JEM-2010型透射电子显微镜(TEM,日本电子株氏会社)进行观察,加速电压为200 kV.催化剂元素组成采用LEO 438VP型能谱分析仪(EDS,德国 LEO公司)进行测量。纳米金属浅表面层元素组成及电子态采用Thermo Scientific ESCALAB 250Xi-XL型X射线光电子能谱仪(XPS,美国热电公司)进行分析。
1.5 催化剂的电化学表征
用三电极体系在VMP2型多通道恒电位仪(美国PAR公司)上对催化剂样品进行电化学性能表征。其中玻碳电极(中国艾达恒晟科技有限公司)为工作电极,Pt片(中国高仕睿联科技有限公司)为对电极,Hg/Hg2SO4(MSE,中国艾达恒晟科技有限公司)为参比电极;电解液为0.5 mol/L H2SO4+xmol·L-1CH3OH(x=0,0.2,0.5,1.0),实验均在室温(25±1 ℃)下进行;循环伏安测试电位区间为-0.74 V~0.70 V,扫速为20 mV/s;交流阻抗测试的测试电位为0.2 V.测试前,电解液中通入高纯Ar气约30 min,除去电解液中溶解的O2,CO2.
2 结果与讨论
2.1 催化剂的物理表证结果
PtRu/C和Pt/C催化剂的XRD谱图见图1(a).谱图中A,B,C样品存在4个较强的衍射峰,衍射角2θ=39.76°,46.24°,67.45°,81.29°分别对应于Pt的(111)、(200)、(220)及(311)晶面,未出现金属Ru的衍射峰,说明Ru原子可能以合金形式存在,Pt基纳米合金呈面心立方晶体结构;而且随着Pt原子比的减小,衍射峰强度减弱,表明纳米金属粒子的晶化程度有降低的趋势。在Pt0.5Ru1/C催化剂的谱图中(D),Pt(200),(220),(322)晶面的衍射峰几乎消失,Pt(111)晶面衍射峰出现宽化,这可能是因为Pt原子比较小,晶型不够完整,有非晶态的趋势;在Pt0.33Ru1/C催化剂的谱图中(E),仅在2θ=39.76°位置出现了一个宽的秃峰,这可能是由于Pt原子比过小,Pt原子的配位数降低,原子间距增加,形成了类似非晶态的纳米粒子,此时Pt0.33Ru1/C的性能不再遵循晶态纳米金属的规律。图中Pt2Ru1/C(B),Pt1Ru1/C(C),Pt0.5Ru1/C(D)催化剂的Pt(111)晶面衍射峰相对于Pt/C较明显地向右偏移,这一现象表明,Ru原子进入金属Pt的晶格,取代了部分Pt原子,形成PtRu合金[17]。

A-Pt/C;B-n(Pt)∶n(Ru)=2∶1;C-n(Pt)∶n(Ru)=1∶1;D-n(Pt)∶n(Ru)=0.5∶1;E-n(Pt)∶n(Ru)=0.33∶1图1 不同n(Pt)∶n(Ru)比值的PtRu/C和Ru@Pt/C催化剂的XRD谱图Fig.1 XRD spectra of PtRu/C and Ru@Pt/C catalysts with different n(Pt)∶n(Ru) values
Ru@Pt/C和Pt/C催化剂的XRD谱图见图1(b).谱图中衍射角2θ=39.76°,46.24°处的衍射峰分别对应于Pt(111),(200)晶面,未出现金属Ru的衍射峰,初步推断金属Ru核层被金属Pt形成的壳层包裹,形成核壳型Ru@Pt/C催化剂。对比图中Ru1@Pt0.33/C,Ru1@Pt0.5/C,Ru1@Pt1/C,Ru1@Pt2/C和Pt/C的Pt(111)晶面衍射峰发现,随着Pt原子比的增大,衍射峰强度增强。Ru1@Pt0.33/C(E)催化剂Pt(111)衍射峰强度较低且宽化,其它晶面的衍射峰几乎观察不到,可能是因为Pt原子比过小,Pt壳层过薄,呈现为微晶薄膜结构[19];Ru1@Pt0.5/C(D)催化剂的Pt(111)晶面衍射峰有明显的宽化现象,说明金属Pt壳层的厚度较薄,但在这样的厚度下金属Pt壳层已接近单晶结构。
PtRu/C催化剂和Ru@Pt/C催化剂中Pt(111)晶面衍射峰相对于Pt/C发生偏移,是因为Ru原子的加入对Pt原子产生电子诱导效应,改变了Pt金属晶体的晶格参数[18]。这种情况下,本研究用PtRu/C催化剂和Ru@Pt/C催化剂中Pt(111)晶面衍射峰相对于Pt/C催化剂Pt(111)晶面衍射峰的偏移值表征Pt基纳米金属存在的电子效应强度。不考虑Pt0.33Ru1/C催化剂,由图2可见,Pt纳米金属呈晶态结构时,随Pt原子比增大,两种催化剂Pt(111)晶面衍射峰偏移值减小,即电子效应强度减小,在各自体系中,Pt1Ru1/C,Ru1@Pt0.5/C催化剂电子效应最强,Ru1@Pt0.5/C强度大于Pt1Ru1/C催化剂。n(Pt)∶n(Ru)=1∶1时,两种催化剂电子效应接近,n(Pt)∶n(Ru)=2∶1时,Ru@Pt/C催化剂电子效应大于PtRu/C催化剂,这是因为Pt,Ru金属形成核壳结构,当Pt原子比较大时,Ru金属核可通过晶格膨胀效应补偿,使金属Pt壳层的晶格参数变化幅度相对较大。当Pt金属有非晶态趋势时,Pt原子的配位数有所降低,也不再严格遵循晶态结构金属Pt的规律,所以Pt0.5Ru1/C催化剂的电子效应减弱。
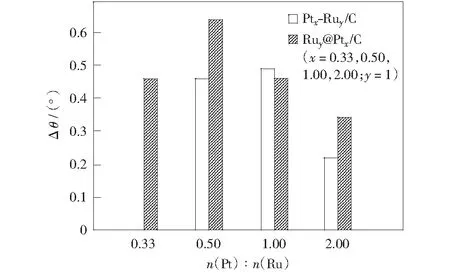
图2 PtRu/C、Ru@Pt/C催化剂的Pt(111)晶面衍射峰相对于Pt/C偏移值Δθ与n(Pt)∶n(Ru)比值的关系Fig.2 Histogram between Δθ of specific Pt (111) diffraction peak and different n(Pt)∶n(Ru) values of PtRu/C,Ru@Pt/C catalysts
表1和表2分别为制备的PtxRuy/C和Ruy@Ptx/C两类催化剂的EDS、XPS测试结果。EDS检测到的Pt/Ru原子比可近似为纳米金属体相的平均原子比,而XPS检测得到的Pt/Ru原子比值是纳米金属浅表层原子的平均原子比[20]。由表1和表2中EDS数据可看到,EDS实测出的Pt/Ru原子比与加入前驱体盐Pt/Ru原子比计算值相近,表明在适宜的实验操作条件下NaBH4能够将PtCl4和RuCl3完全还原。表1中XPS实测出的Pt/Ru原子比也与加入前驱体盐Pt/Ru原子比计算值近似相同,这说明本研究制备的合金型PtRu/C催化剂确实为合金结构。表2中XPS测出的Pt/Ru原子比远大于同一样品EDS测出的Pt/Ru原子比,说明本研究制备的核壳型Ru@Pt/C催化剂纳米金属表面拥有更高比例的Pt元素,结合本研究制备方法的特点,进一步证明纳米金属Ru核被纳米金属Pt层包裹,Ru@Pt/C催化剂呈核壳型纳米结构[21]。
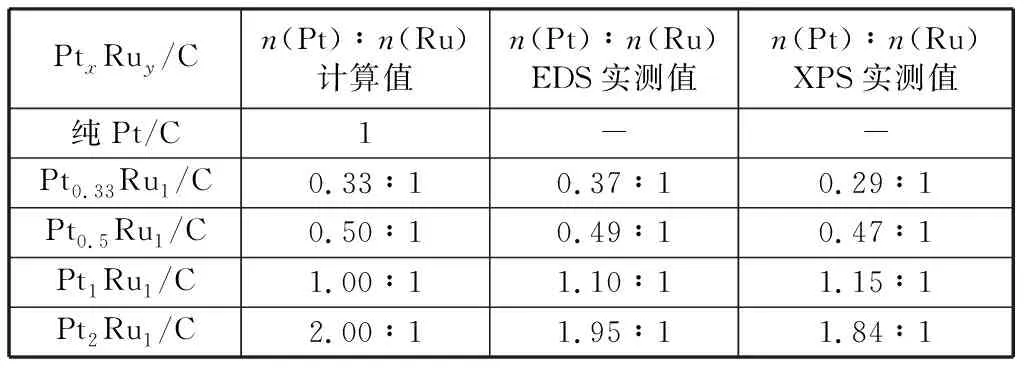
表1 不同Pt/Ru原子比PtxRuy/C催化剂n(Pt)∶n(Ru)计算值及EDS,XPS实测值Table 1 Comparisons between stoichiometric value of n(Pt)∶n(Ru) and EDS,XPS measured value of n(Pt)∶n(Ru) in different PtxRuy/C catalysts

表2 不同Pt/Ru原子比Ruy@Ptx/C催化剂n(Pt)∶n(Ru)计算值及EDS,XPS实测值Table 2 Comparisons between stoichiometric value of n(Pt)∶n(Ru) and EDS,XPS measured value of n(Pt)∶n(Ru) in different Ruy@Ptx/C catalysts
图3展示了不同n(Pt)∶n(Ru)比值PtRu/C和Ru@Pt/C催化剂中Pt4f轨道的结合能。图中,两种催化剂中的Pt4f结合能相对于纳米纯Pt的Pt4f结合能均发生正移,此现象说明合金和核壳结构中Pt原子的电子向Ru原子未填满的d轨道转移[11]443,Pt的5d轨道空穴增加,内层轨道电子的结合能增大。通常,这种Pt原子和Ru原子的电子交互作用,被称为“电子效应”。
图4为两种催化剂的Pt4f7/2结合能相对于Pt/C催化剂Pt4f7/2结合能的偏移值与Pt/Ru原子比的关系。可看出当Pt呈晶态结构时,两种催化剂随着Pt原子比的增大Pt4f7/2结合能偏移值减小,即电子效应强度减弱, Pt1Ru1/C和Ru1@Pt0.5/C催化剂在各自体系中电子效应最强,且Ru1@Pt1,2/C催化剂分别与 Pt1Ru1,2/C催化剂的电子效应强度相近。当纳米Pt呈非晶态结构或有非晶态趋势时,Pt0.5Ru1/C,Pt0.33Ru1/C和Ru1@Pt0.33/C催化剂的Pt4f7/2结合能偏移值减小,不具备晶态结构Pt金属的性质。

A-n(Pt)∶n(Ru)=1∶1;B-n(Pt)∶n(Ru)=2∶1;C-Pt/C;D-n(Pt)∶n(Ru)=0.5∶1;E-n(Pt)∶n(Ru)=0.33∶1图3 不同n(Pt)∶n(Ru)比值PtRu/C催化剂和Ru@Pt/C催化剂Pt4f轨道的精细谱图Fig.3 Spectrogram of Pt4f orbits of different PtRu/C and Ru@Pt/C catalysts
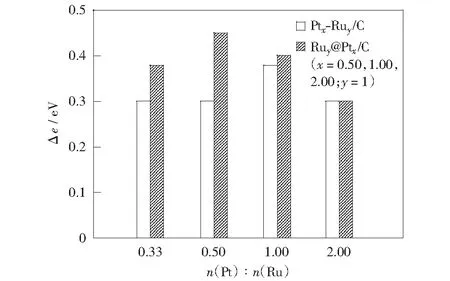
图4 不同催化剂的Pt4f7/2结合能偏移值Δe与n(Pt)∶n(Ru)比值的关系Fig.4 Diagram between Δe of Pt4f7/2 binding energy peaks and different n(Pt)∶n(Ru) values of different catalysts
Pt1Ru1/C催化剂的HRTEM见于图5.不同Pt/Ru比例的PtRu/C催化剂制备方法相同,所以总体形貌和结构类似,在此选取Pt1Ru1/C催化剂电镜图进行分析。从图5(a)可知,制备出的催化剂呈球形或类球形,分散性较好。由图5(b)可看出金属粒子的晶体结构,平均粒径约为9~11 nm,局部放大图中不同金属粒子各自晶格的规则明显、走向不同,表明Pt原子与Ru原子形成了合金型催化剂。
核壳型Ru1@Pt0.5/C催化剂的HRTEM见于图6.选取Ru1@Pt0.5/C催化剂电镜图进行分析。从图6(a)可知,催化剂呈球形或类球形,分散性较好。由图6(b)可看出金属粒子的晶体结构,中间颜色较深的为Ru核层金属,外面颜色较浅的壳层为Pt金属,厚度约为1~2 nm,平均粒径约10 nm,与合金型PtRu/C催化剂粒径相近。

图5 Pt1Ru1/C催化剂的HRTEM图Fig.5 HRTEM images of Pt1Ru1/C alloy catalysts

图6 Ru1@Pt0.5/C催化剂的HRTEM图Fig.6 HRTEM images of Ru1@Pt0.5/C core-shell catalysts
2.2 催化剂的电化学表证结果
图7展示了3种催化剂在0.5 mol/L H2SO4溶液中的循环伏安曲线,金属Pt的吸脱附CV曲线的变化可分为4个电位区间,即-0.75~-0.4 V氢的吸脱附区,-0.4~-0.2 V的双电层区和-0.2~0.6 V的氧化区和高于0.6 V的析氧区。图中可看出,Ru@Pt/C展示与Pt/C催化剂非常相似的氢吸脱附和双电层的CV特征,并未出现金属Ru的溶解氧化峰,在-0.2~0.6 V氧化区和析氧区显示出较高的氧化电流,在回扫过程中,氧还原电流明显较高,表明本研究制备的Ru@Pt/C催化剂易于被氧化,对析氧反应、氧还原反应的活性较高,符合核壳结构特征[22]。PtRu/C催化剂的氧化电流峰较其他两种催化剂有一定提前,各区的反应电流相应较大,具有PtRu/C催化剂的特征[23]。
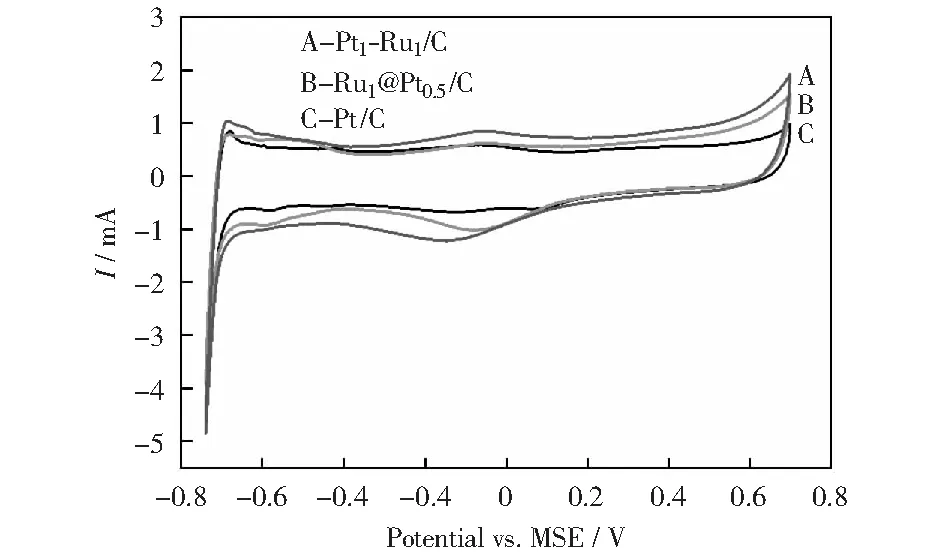
图7 不同催化剂在0.5 mol/L H2SO4溶液中的循环伏安曲线Fig.7 CV curves of different catalysts in 0.5 mol/L H2SO4

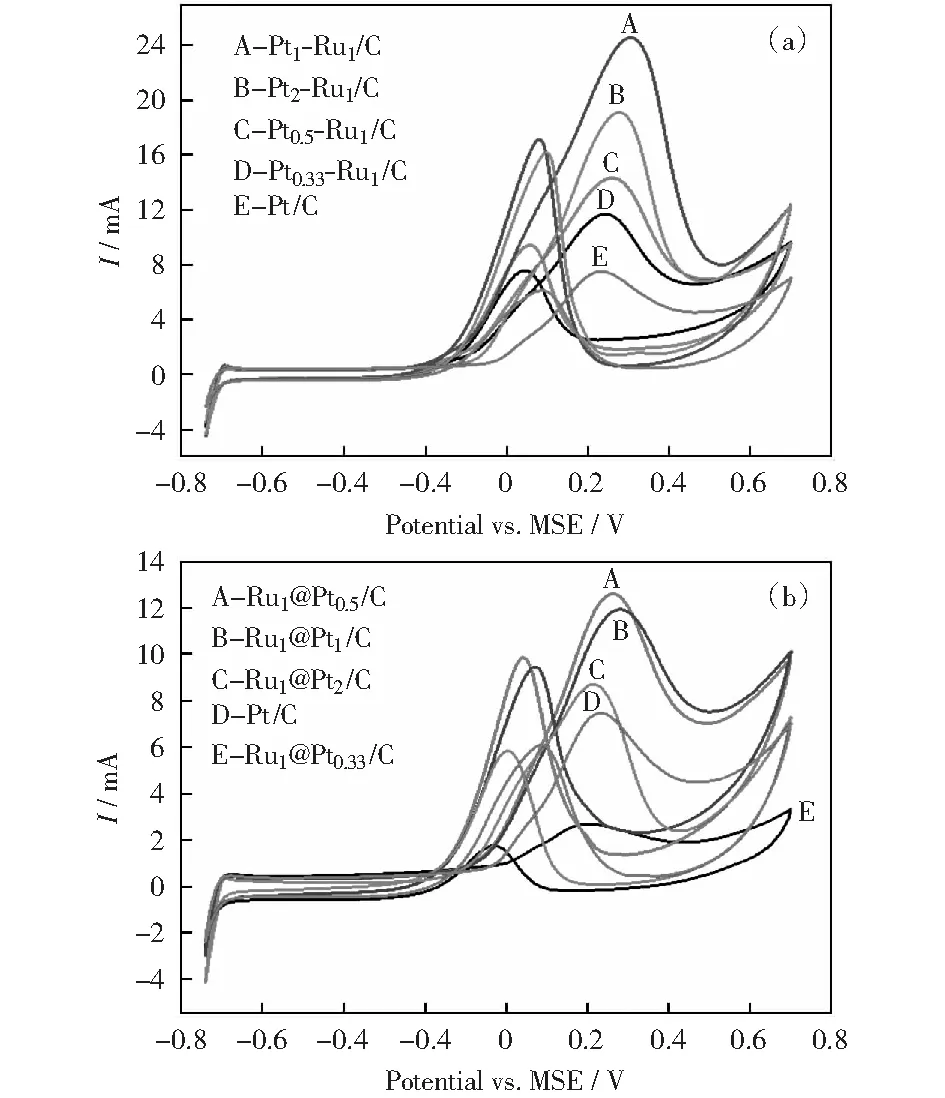
图8 不同n(Pt)∶n(Ru)比值PtRu/C和Ru@Pt/C催化剂在0.5 mol/L H2SO4+1.0 mol/L CH3OH溶液中的循环伏安曲线Fig.8 CV curves of different PtRu/C and Ru@Pt/C catalysts in 0.5 mol/L H2SO4+1.0 mol/L CH3OH
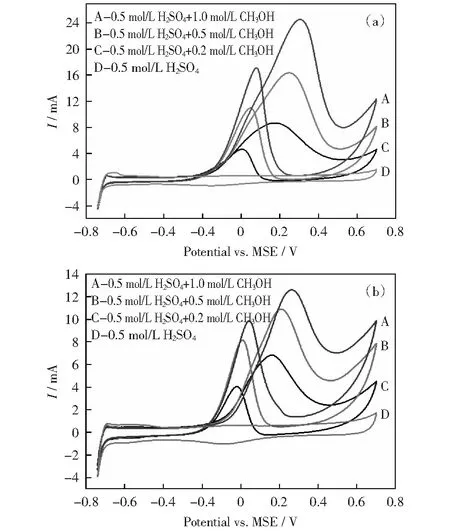
图9 Pb1Ru1/C和Ru1@Pt0.5/C催化剂在不同甲醇浓度电解液中的循环伏安曲线Fig.9 CV curves of Pb1Ru/C and Ru1@Pt0.5/C catalysts in electrolytes with different methanol concentration
图10比较了不同催化剂在0.5 mol/L H2SO4+1.0 mol/L CH3OH电解液中甲醇氧化峰电流、交流阻抗值与Pt/Ru原子比的关系。从图中可看出,随Pt/Ru原子比的增大,Ru@Pt/C催化剂催化活性先增大后减小,Ru1@Pt0.5/C的活性最高,此规律与其电子效应对Pt/Ru原子比关系的规律相一致。Ru1@Pt0.33/C尽管也存在类似于其它核壳型纳米金属的电子效应,但催化活性低于Pt/C,说明该催化剂可能存在其它的催化效应,其关键在于Pt原子比较小,Pt壳层呈多微晶结构,晶界原子的比例较高,相应的催化机理有待进一步探讨。
相对于Ru@Pt/C催化剂,同一Pt/Ru比例下,PtRu/C催化剂电催化甲醇的峰电流均较高,比较两种类型催化活性最高的催化剂,Pt1Ru1/C的峰电流约为Ru1@Pt0.5/C的2倍。图10(b)中两种催化剂的交流阻抗特性均呈“倒火山型”,所反映出的催化活性的规律与循环伏安法的规律相一致。两种电化学方法的测试结果说明,合金型PtRu/C催化剂电催化活性明显优于核壳型Ru@Pt/C催化剂。
图11(a)是在0.5 mol/L H2SO4+1.0 mol/L
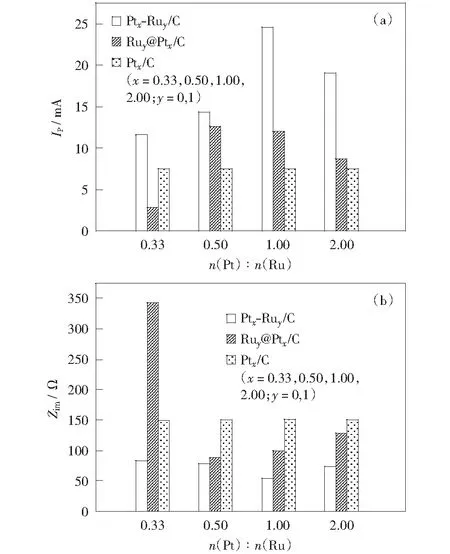
图10 不同催化剂在0.5 mol/L H2SO4+1.0 mol/L CH3OH电解液中的峰电流与n(Pt)∶n(Ru)比值的关系图(a)和电荷转移电阻与n(Pt)∶n(Ru)比值的关系图(b)Fig.10 Diagram of the peak current vs. n(Pt)∶n(Ru) (a) and the impedance spectra vs. n(Pt)∶n(Ru) (b) of different catalysts in 0.5 mol/L H2SO4+1.0 mol/L CH3OH
CH3OH中,Ru@Pt/C催化剂催化甲醇氧化峰电流相对于Pt/C的增加值与Pt4f轨道电子结合能偏移值(作为电子效应的表征值)的关系曲线。图中峰电流增加值即为Ru@Pt/C在表面Pt原子电子效应作用下相对于Pt/C所增加的催化活性,由图中的关系曲线可见,Ru@Pt/C的催化活性增加幅度与电子效应强度基本呈线性关系。这里Ru1@Pt0.33/C中Pt呈微晶态薄膜,不遵循晶态金属Pt规律,不参与线性拟合。由XPS测试结果可知,Pt1Ru1/C,Pt2Ru1/C中Ru的3p1轨道结合能分别相对纯金属Ru原子下降3.7,3.9 eV,说明PtRu纳米合金中Ru原子接收到电子,此效应与合金中Pt原子移去电子相印证。在PtRu纳米合金的晶格完整情况下,其表面Pt,Ru原子所占面积比与其原子比相近,如Pt1Ru1表面Pt,Ru原子所占面积各为1/2.假设表面Ru原子所具催化活性与Pt原子相同,并且假设因电子效应导致的峰电流增加值符合图11(a)中曲线关系,则Pt1Ru1/C表面Pt,Ru原子因电子效应导致的活性提升幅度(以峰电流提升值表征)约为3.53 mA,图11(b)中分别列出了Pt/C催化甲醇氧化峰电流值、电子效应促进作用下PtRu/C的峰电流计算值、以及PtRu/C催化甲醇氧化峰电流实测值。可看出,即使假设Ru原子所具活性与Pt原子相同,PtRu/C催化甲醇氧化峰电流实测值依然远大于有电子效应促进作用的计算值。众所周知,金属Ru对甲醇电氧化的活性远远低于金属Pt,PtRu/C纳米合金催化剂的活性相对于Pt/C大幅提高的原因,不仅仅限于纳米合金中的电子效应,还应该与Ru原子活性位的特殊性能有关。

图11 催化剂在0.5 mol/L H2SO4+1.0 mol/L CH3OH电解液中峰电流与电子效应的关系图(a)以及峰电流计算值、实测值与n(Pt)∶n(Ru)比值的关系图(b)Fig.11 Relation curves of the peak current vs. electronic effect (a) and relation curves of peak current vs. n(Pt)∶n(Ru) (b) of PtRu/C catalyst in 0.5 mol/L H2SO4+1.0 mol/L CH3OH
根据WILLIAM et al[26]的研究可以知道,甲醇在金属Pt电极表面的电氧化有以下主要步骤:

由公式可知,甲醇通过一系列脱氢和吸附解离步骤实现氧化,其中中间产物COads占据Pt表面活性位,易引起催化剂中毒。双功能机理认为:Ru原子的特性在于,它不吸附甲醇[26],只吸附H2O分子,可快速在Ru原子表面形成OHads,Ru-OHads促进CO在低电势下氧化,因此大幅度提升了催化剂的抗CO中毒能力和催化活性,如下公式所示:

至此可认为峰电流实测值高出计算值的部分是双功能机理作用下的催化活性提高。综合以上不同方面的信息可以确信,合金型PtRu/C催化剂电催化甲醇氧化是电子效应和双功能机理共同作用。
3 结论
1) 制备的3种纳米金属粒子为球形,平均粒径较为接近,约10 nm,物理表征和电化学证实,Ru@Pt纳米金属为核壳型结构,PtRu纳米金属为合金型结构。
2) 两种双金属纳米粒子的Pt4f结合能都有增大趋势,表明Pt原子的电子向Ru原子的d轨道偏移,增加了Pt5d轨道空穴。这种不同元素原子间的电子偏移,即所谓“电子效应”,促进了Ru@Pt/C对甲醇电氧化的催化活性,相较Pt/C有明显提高,而且电子效应越强,纳米金属Pt的活性越高。
3) 不同电化学方法表征结果表明,合金型PtRu/C催化剂电催化甲醇氧化的活性明显高于Ru@Pt和Pt/C,其催化作用机制不仅存在Pt活性位的“电子效应”促进作用,而且还存在Pt,Ru活性位的“双功能活性中心”促进作用。有关PtRu纳米合金催化机制的认识,将对Pt基纳米金属新型催化剂的研发提供新的基础。
:
[1] 李金峰,宋焕巧,邱新平.直接甲醇燃料电池阳极催化剂的研究进展[J].电源技术,2007,131(2):167-170.
LI J F,SONG H Q,QIU X P.Research progress of anode catalysts for direct methanol fuel cell[J].Chinese Journal of Power Sources,2007,131(2):167-170.
[2] SONG S,ZHOU W,LIANG Z,et al.The effect of methanol and ethanol cross-over on the performance of PtRu/C-based anode DAFCs[J].Applied Catalysis B Environmental,2005,55(1):65-72.
[3] MUNK J,CHRISTENSEN P A,HAMNETT A,et al.The electrochemical oxidation of methanol on platinum and platinum+ruthenium particulate electrodes studied by in-situ FTIR spectroscopy and electrochemical mass spectrometry[J].Journal of Electroanalytical Chemistry,1996,401(1/2):215-222.
[4] 李伟,黄青丹,黄红良,等.DMFC阳极PtRu催化剂的研究进展[J].电池工业,2007,12(3):200-204.
LI W,HUANG Q D,HUANG H L,et al.Research progress of PtRu catalysts for direct methanol fuel cells[J].Chinese Battery Industry,2007,12(3):200-204.
[5] IWASITA T,HOSTER H,JOHN-ANACKER A,et al.Methanol oxidation on PtRu electrodes.Influence of surface structure and Pt-Ru atom distribution[J].Langmuir,2000,16(2):522-529.
[6] LEE C H,LEE C W,KIM D I,et al.Characteristics of methanol oxidation on Pt-Ru catalysts supported by HOPG in sulfuric acid[J].International journal of hydrogen energy,2002,27(4):445-450.
[7] TING C C,LIU C H,TAI C Y,et al.The size effect of titania-supported Pt catalysts on the electrocatalytic activity towards methanol oxidation reaction primarily via the bifunctional mechanism[J].Journal of Power Sources,2015,280:166-172.
[8] WANTANABE M,UCHIDA M,MOTOO S.Preparation of highly dispersed Pt+Ru alloy clusters and the activity for the electro-oxidation of methanol[J].Journal of Electro-analytical Chemistry and Interfacial Electrochemistry,1987,229(1/2):395-406.
[9] PEREIRA L G S,PAGANIN V A,TICIANELLI E A.Investigation of the CO tolerance mechanism at several Pt-based bimetallic anode electrocatalysts in a PEM fuel cell[J].Electrochimica Acta,2009,54(7):1992-1998.
[10] TODA T,IGARASHI H,WATANABE M.Enhancement of the electrocatalytic O2reduction on Pt-Fe alloys[J].Journal of Electroanalytical Chemistry,1999,460(1):258-262.
[11] LIU J,ZOU S,XIAO L,et al.Well-dispersed bimetallic catalysts confined in mesoporous metal oxides and their optimized catalytic activity for nitrobenzene hydrogenation[J].Catalysis Science & Technology,2014,4(2):441-446.
[12] YANG J,LEE J Y,CHEN L X,et al.A phase-transfer identification of core-shell structures in Ag-Pt catalysts[J].The Journal of Physical Chemistry B,2005,109(12):5468-5472.
[14] 赵硕,段东红,卫国强,等.核壳型Ru@Pt在甲醇电催化氧化反应中的电子效应研究[J].太原理工大学学报,2016,47(4):471-477.
ZHAO S,DUAN D H,WEI G Q,et al.Electronic effect of core-shell Ru@Pt nano-particle catalysts in methanol electro-oxidation[J].Journal of Taiyuan University of Technology,2016,47(4):471-477.
[15] 陈煜,唐亚文,李钢,等.一种制备碳载高合金化Pt-Ru催化剂的方法 [J].无机化学学报,2006,22(1):59-64.
CHEN Y,TANG Y W,LI G,et al.Preparation of carbon supported high alloying Pt-Ru catalyst[J].Chinese Journal of Inorganic Chemistry,2006,22(1):59-64.
[16] KAPLAN D,BURSTEIN L,ROSENBERG Y,et al.Comparison of methanol and ethylene glycol oxidation by alloy and core-shell platinum based catalysts[J].Journal of Power Sources,2011,196(20):8286-8292.
[17] ZHANG J M,ZHU F F,ZHANG K H,et al.Pt-Ru catalysts prepared by a modified polyol process for direct methanol fuel cells[J].Precious Metals,2012(s1):222-226.
[18] CAMARA G A,GIZ M J,PAGANIN V A,et al.Correlation of electrochemical and physical properties of PtRu alloy electrocatalysts for PEM fuel cells[J].Journal of Electroanalytical Chemistry,2002,537(1):21-29.
[19] LIU S B,MA Y H,WEI G Q,et al.Methanol electro-oxidation kinetics on Ni@Pt nanoparticles coated by amorphous metal(In Chinese)[J].Journal of Taiyuan University of Technology,2012,43(3):300-304.
[20] BECKER E D,FARRAR T C.Fourier transform spectroscopy[J].Science,1972,178(4059):361-368.
[21] MUTHUSWAMY N,DE LA Fuente J L G,TRAN D T,et al.Ru@Pt core-shell catalysts for methanol fuel cell catalyst:Control and effects of shell composition[J].International Journal of Hydrogen Energy,2013,38(36):16631-16641.
[22] WANG J J,LIU Y T,CHEN I L,et al.Near-monolayer platinum shell on core-shell nanocatalysts for high-performance direct methanol fuel cell[J].The Journal of Physical Chemistry C,2014,118(5):2253-2262.
[23] KRAUSA M,VIELSTICH W.Study of the electrocatalytic influence of Pt/Ru and Ru on the oxidation of residues of small organic molecules[J].Journal of Electroanalytical Chemistry,1994,379(1/2):307-314.
[24] LIN S D,HSIAO T C,CHANG J R,et al.Morphology of carbon supported Pt-Ru electrocatalyst and the CO tolerance of anodes for PEM fuel cells[J].The Journal of Physical Chemistry B,1999,103(1):97-103.
[25] WATANABE M,MOTOO S.Electrocatalysis by ad-atoms:Part III.Enhancement of the oxidation of carbon monoxide on platinum by ruthenium ad-atoms[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1975,60(3):275-283.
[26] HOLSTEIN W L,ROSENFELD H D.In-situ X-ray absorption spectroscopy study of Pt and Ru chemistry during methanol electrooxidation[J].The Journal of Physical Chemistry B,2005,109(6):2176-2186.
