血清TNF-α、IL-1 β、IL-6和IL-17表达水平在阿达木单抗治疗活动性类风湿关节炎中的疗效预测作用
2018-05-30范晓蕾刘中华岳涛何东仪
范晓蕾,刘中华,岳涛,何东仪
(1. 上海市光华中西医结合医院关节内科,上海 200052; 2. 复旦大学附属中山医院肾内科,上海 200032)
类风湿关节炎 (rheumatoid arthritis,RA) 是一种常见的慢性自身免疫性疾病,以滑膜炎症、关节炎症及软骨破坏为主要临床表现,发病后若未及时治疗,40%~70%的患者最终会发展为关节畸形、功能障碍,甚至残疾[1-2]。此外,RA患者还常并发间质性肺病、心血管疾病等关节外疾病,给患者和社会均带来沉重的疾病和经济负担[3-5]。阿达木单抗 (adalimumab,ADA) ,作为一种新的全人源肿瘤坏死因子(tumor necrosis factor,TNF) 单克隆抗体,可以快速缓解RA患者炎症和疾病活动度,并且在一定程度上抑制放射学进展[6-8]。尽管如此,依然约有20%~30%的RA患者对于ADA治疗应答不佳或难以承受其高昂的价格,因此积极探寻ADA治疗RA患者的新颖、可信的疾病监控和疗效预测标志物十分必要。TNF-α、白细胞介素1 β (interleukin,IL-1 β) 、IL-6和IL-17,作为重要的炎性细胞因子,在RA的疾病发生和发展中均起着至关重要的作用。本研究拟评估活动性RA患者血清TNF-α、IL-1 β、IL-6和IL-17表达水平在ADA治疗前后的变化及其疗效预测作用。
1 材料与方法
1.1 研究对象
本研究前瞻性队列研究,共连续纳入79例于2013年1月至2014年12月在上海市光华中西医结合医院就诊的活动性RA患者。纳入标准为: (1) 符合1987年美国风湿病学会 (american college of rheumatology,ACR)的RA分类标准或2010年ACR/欧洲抗风湿病联盟 (european league against rheumatism,EULAR) 的RA分类标准; (2) 年龄18~65周岁;(3) 同时符合以下内容中A、B以及C、D、E 3项中任一项的中高活动度RA患者,A,关节肿胀≥4个;B,关节压痛≥6个;C,晨僵持续时间≥45 min;D,血沉 (魏氏法) ≥28 mm/h;E,C反应蛋白 (C-reaction protein,CRP) >10 mg/L;(4) 准备使用ADA进行治疗。排除标准: (1) 6个月内接受过生物制剂的治疗; (2) 合并血液恶性疾病或其他恶性实体肿瘤; (3) 合并中度以上肝功能或肾功能不全; (4) 有严重感染史; (5) 难以正常随访。本研究获得了上海市光华中西医结合医院伦理委员会的批准,所有患者均签署了知情同意书。
1.2 治疗和信息采集
所有RA患者均按照意愿和临床实际需求接受ADA 40 mg/2周治疗,持续12周。基线期记录患者人口学和临床信息,包括:年龄、性别、病程、类风湿因子 (rheumatoid factor,RF) 、抗瓜氨酸化蛋白抗体 (anticitrullinated protein antibodie,ACPA) 、CRP、红细胞沉降率 (erythrocyte sedimentation rate,ESR)和28关节疾病活动评分 (disease activity score in 28 joints,DAS28) 。治疗12周后,再次记录患者CRP、ESR和DAS28评分。临床应答采用EULAR治疗应答标准进行评估,即DAS28下降值>1.2分。
1.3 血样采集和炎性细胞因子检测
于基线期和治疗12周后分别采集RA患者4 mL外周血,并立刻分离血清置于-80℃冰箱保存。采用酶联免疫吸附测定实验 (enzyme linked immunosorbent assay,ELISA) 试剂盒 (美国eBioscience公司)检测血清TNF-α、IL-1 β、IL-6和IL-17的表达水平。
1.4 统计学分析
采用SPSS 22.0软件进行统计分析。数据以x-±s、中位数 (25~75分位值) 或频数 (百分比) 表示。2组间比较采用t检验或Wilcoxon秩和检验,同组治疗前后比较采用Wilcoxon符号秩和检验。采用单因素逻辑回归模型分析ADA治疗RA患者临床应答的预测因素,所有单因素模型中P ≤ 0.1的因素进一步采用多因素逻辑回归模型进行分析。P < 0.05为差异有统计学意义。
2 结果
2.1 一般信息
79例入选RA患者中,7例患者未完成研究,其中4例失访,2例患者自愿退出,1例出现不良反应 (肝功能异常,予以停药和保肝处理) ,因此最终共72例患者纳入分析。72例患者平均年龄为 (48.3±12.4)岁,69%为女性,中位病程为71 (32~93) 个月,平均DAS28评分为5.8±1.4。55例 (76%) 患者为RF阳性,52例 (72%) 患者为ACPA阳性。见表1。
2.2 治疗疗效
ADA治疗12周后炎症水平显著降低,ESR由35.0 (27.5~46.2) mm/h下降至18.7 (12.5~26.8) mm/h(P < 0.001,图1A) ;CRP由28.7 (19.9~38.9) mg/L降低至14.6 (9.5~22.3) mg/L (P < 0.001,图1B) 。同时,ADA还显著降低了疾病活动度,DAS28评分由5.8±1.4下降至3.3±0.9 (P < 0.001,图1C) 。按照EULAR治疗应答定义,共有45例患者 (62.5%) 达到了临床应答,27例患者 (37.5%) 未达到临床应答。
2.3 治疗前后血清TNF-α、IL-1 β、IL-6和IL-17水平的变化
ADA治疗12周后,RA患者血清TNF-α (P < 0.001)、IL-1 β (P = 0.007) 、IL-6 (P < 0.001) 和IL-17 (P < 0.001)表达水平均较基线期显著降低 (表2) 。将患者分为应答组和未应答组评估时发现,应答组患者血清TNF-α(P < 0.001) 、IL-1 β (P < 0.001) 、IL-6 (P < 0.001) 和IL-17 (P < 0.001) 表达水平相对于基线显著下降,而未应答患者仅血清TNF-α (P = 0.036) 水平有所下降。

表1 RA患者基线期信息Tab.1 Baseline characteristics of RA patients
2.4 基线血清TNF-α、IL-1 β、IL-6和IL-17水平与临床应答的关联
基线期应答组患者血清IL-1 β (P = 0.088) 和IL-6(P = 0.092) 水平高于未应答组,但是差异无统计学意义。2组基线期TNF-α (P = 0.446) 和IL-17 (P =0.242) 水平未见差异,见图2。
2.5 预测临床应答基线期因素分析
单因素逻辑回归分析显示,基线期IL-1 β高表达(P = 0.091)、IL-6高表达 (P = 0.062) 和高CRP水平 (P =0.091) 可能在一定程度上可以预测ADA治疗RA患者12周后的临床应答。单因素回归中所有P≤0.1的因素进一步纳入多因素逻辑回归分析,结果显示,IL-1 β高表达 (P = 0.338)、IL-6高表达 (P = 0.067) 均不是临床应答的独立预测因素,仅高CRP水平可以独立预测临床应答 (P = 0.023) ,见表3。

图1 ADA治疗12周后ESR、CRP和DAS28评分显著下降Fig.1 EST,CRP,and DAS 28 scores markedly decreased after 12 weeks of treatment with ADA
3 讨论
ADA是目前全球使用最广泛的TNF抑制剂,越来越多的证据表明,ADA治疗活动性RA患者可以获得快速的疾病活动度下降以及炎症控制。KAVANAUGH等[9]纳入了大样本 (1 032例) 中高活动度早期RA患者,发现ADA治疗12周即可以快速降低患者CRP水平和DAS28评分,持续治疗至26周可获得高达44%的低疾病活动度缓解。ENG等[10]研究表明,针对长病程中高活动度RA患者,ADA治疗6个月降低了患者ESR水平、CRP水平和DAS28评分。与之前研究结果一致,本研究发现ADA治疗中高活动度RA患者,可以快速下调ESR和CRP水平,并且降低DAS28评分,这是由于ADA快速强效结合TNF-α,下调了炎症细胞和炎性因子水平,从而降低了炎症和疾病活动度。
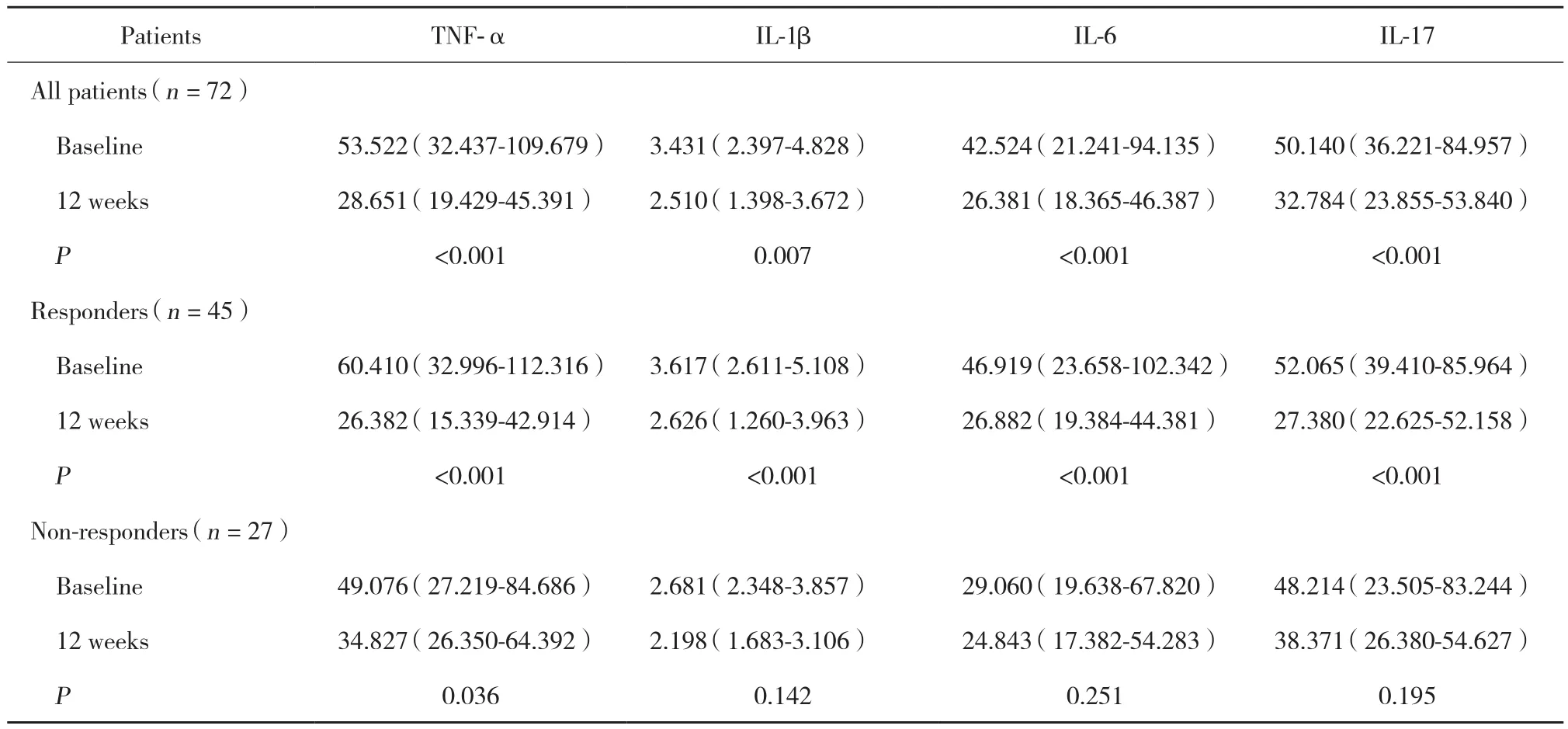
表2 治疗前后TNF-α、IL-1 β、IL-6和IL-17的变化(pg/mL)Tab.2 Changes in TNF-α,IL-1 β,IL-6,and IL-17 levels after treatment(pg/mL)
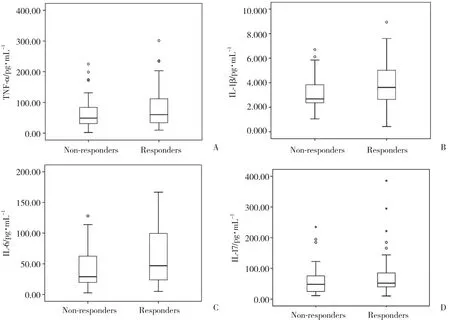
图2 应答组和未应答组TNF α、IL-1 β、IL-6和IL-17表达水平Fig.2 Levels of TNF α,IL-1 β,IL-6,and IL-17 in responders and non-responders
YUE 等[11]通过一项队列研究发现,ADA治疗RA患者12周显著下调了外周血CD4 (+) IL-17 (+) 细胞比例,并同时降低了血清IL-6和IL-17的表达水平。AERTS等[12]研究表明,ADA治疗RA患者显著降低了其外周血TNF-α和IL-1 β的表达水平。与上述研究一致,本研究发现,ADA治疗RA患者可以快速控制炎症,显著下调血清TNF-α、IL-1 β、IL-6和IL-17表达水平,这和ADA的强效抑炎作用有关。此外,本研究还发现ADA治疗后应答组患者TNF-α、IL-1 β、IL-6和IL-17表达水平均显著降低,而未应答组仅有TNF-α水平有所下降,其余IL-1 β、IL-6和IL-17表达水平相对于基线均未有显著变化,类似研究少见报道,这可能是由于未应答患者治疗后依然处在较高的疾病活动度 (DAS28改变<1.2分) ,因此炎症细胞和炎性因子依然较高水平表达。此外,本研究还发现IL-1 β和IL-6在一定程度上可以预测ADA治疗RA患者的临床应答。这可能是由于IL-1 β和IL-6高表达与基线期高度炎症相关,而临床应答是由指标相对于基线变化差值决定的,因此高度的炎症可能提供更大的炎症降低阈值空间,进而更可能达到临床应答。此外,IL-1 β和IL-6水平可能和抗抗体的产生相关,越高水平的炎性环境越少可能出现抗抗体,进而更可能实现应答。

表3 临床应答的预测因素分析Tab.3 Predictive analysis of clinical response
本研究尚存在一些缺陷: (1) 样本量较少,因此缺乏较高的统计效能;(2) 研究随访期过短 (12周) ,因此血清TNF-α、IL-1 β、IL-6和IL-17水平在ADA长期治疗中的应用未达到评估。
综上所述,ADA治疗RA患者可以显著改善其疾病活动度,下调血清TNF-α、IL-1 β、IL-6和IL-17表达水平,此外,治疗前血清IL-1 β和IL-6水平可能在一定程度上可以预测ADA治疗RA患者的临床应答。
[1] CATRINA AI,SVENSSON CI,MALMSTROM V,et al. Mechanisms leading from systemic autoimmunity to joint-specific disease in rheumatoid arthritis[ J]. Nat Rev Rheumatol,2017,13( 2) :79-86. DOI:10.1038/nrrheum.2016.200.
[2] SMOLEN JS,ALETAHA D,MCLNNES IB. Rheumatoid arthritis[ J].Lancet,2016,4( 3) :427-442. DOI:10.1016/S0140-6736( 16) 30173-8.
[3] RADNER H,LESPERANCE T,ACCORTT NA,et al. Incidence and prevalence of cardiovascular risk factors among patients with rheumatoid arthritis,psoriasis,or psoriatic arthritis[ J]. Arthritis Care Res(Hoboken) ,2016,69( 10) :1510-1518. DOI:10.1002/acr.23171.
[4] ZAMORA-LEGOFF JA,KRAUSE ML,CROWSON CS,et al. Patterns of interstitial lung disease and mortality in rheumatoid arthritis[J]. Rheumatology( Oxford) ,2016,56( 3) :344-350. DOI:10.1093/rheumatology/kew391.
[5] TAYLOR PC,MOORE A,VASILESCU R,et al. A structured literature review of the burden of illness and unmet needs in patients with rheumatoid arthritis:a current perspective[ J]. Rheumatol Int,2016,36( 5) :685-695. DOI:10.1007/s00296-015-3415-x.
[6] BURMESTER GR,MATUCCI-CERINIC M,MARIETTE X,et al.Safety and effectiveness of adalimumab in patients with rheumatoid arthritis over 5 years of therapy in a phase 3b and subsequent postmarketing observational study[ J]. Arthritis Res Ther,2014,16( 1) :R24. DOI:10.1186/ar4452.
[7] SMOLEN JS,EMERY P,FLEISCHMANN R,et al. Adjustment of therapy in rheumatoid arthritis on the basis of achievement of stable low disease activity with adalimumab plus methotrexate or methotrexate alone:the randomised controlled OPTIMA trial[ J]. Lancet,2014,383( 9914) :321-332. DOI:10.1016/S0140-6736( 13) 61751-1.
[8] TAKEUCHI T,YAMANAKA H,ISHIGURO N,et al. Adalimumab,a human anti-TNF monoclonal antibody,outcome study for the prevention of joint damage in Japanese patients with early rheumatoid arthritis:the HOPEFUL 1 study[ J]. Ann Rheum Dis,2014,73( 3) :536-543. DOI:10.1136/annrheumdis-2012-202433.
[9] KAVANAUGH A,FLEISCHMANN RM,EMERY P,et al. Clinical,functional and radiographic consequences of achieving stable low disease activity and remission with adalimumab plus methotrexate or methotrexate alone in early rheumatoid arthritis:26-week results from the randomised,controlled OPTIMA study[ J]. Ann Rheum Dis,2013,72( 1) :64-71. DOI:10.1136/annrheumdis-2011-201247.
[10] ENG GP,BOUCHELOUCHE P,BARTELS EM,et al. Anti-drug antibodies,drug levels,interleukin-6 and soluble tnf receptors in rheumatoid arthritis patients during the first 6 months of treatment with adalimumab or infliximab:a descriptive cohort study[ J]. PLoS One,2016,11( 9) :e0162316. DOI:10.1371/journal.pone.0162316.
[11] YUE C,YOU X,ZHAO L,et al. The effects of adalimumab and methotrexate treatment on peripheral Th17 cells and IL-17/IL-6 secretion in rheumatoid arthritis patients[ J]. Rheumatol Int,2010,30(12) :1553-1557. DOI:10.1007/s00296-009-1179-x.
[12] AERTS NE,EBO DG,BRIDTS CH,et al. Flow cytometric analysis of phospho-p38 mitogen-activated kinase( MAPK) :p38 MAPK does not mediate the effect of adalimumab on peripheral T cell cytokine production in rheumatoid arthritis[ J]. Cytokine,2009,47( 3) :178-184. DOI:10.1016/j.cyto.2009.06.008.
