数字PCR在病毒检测中的应用及发展趋势
2018-05-25邱方洲申辛欣冯志山马学军
邱方洲 申辛欣 冯志山 马学军
050011石家庄,河北医科大学研究生院(邱方洲);050030石家庄,河北省儿童医院(冯志山);102206北京,中国疾病预防控制中心病毒病预防控制所卫生部医学病毒和病毒病重点实验室(申辛欣、马学军)
自20世纪80年代至今的30多年里,PCR经历了3代技术的发展。第一代PCR分析技术采用凝胶电泳的方法对PCR产物进行分析,由于其操作繁琐易于污染不能对靶基因进行定量检测等缺点,第二代 PCR技术—实时荧光定量 PCR(real time fluorescence quantitative PCR,qPCR)应运而生。在核酸绝对定量、低丰度检测、稀有碱基突变检测和耐药突变检测等需求日益增大的应用背景下,第三代PCR技术—数字dPCR得到了突飞猛进的发展。
病毒感染性疾病是我国公共卫生事业的沉重负担,精确量化标本中的病毒载量能够有效的监测抗病毒治疗效果,提供精准的抗病毒治疗方案。尽管近几年 qPCR在核酸定量中已经成为了“金标准”[1],但是它在临床诊断上还是存在局限性。dPCR具有比qPCR更加出色的灵敏性、特异性、稳定性和精确性[2-3],它在检测极微量核酸样品中表现出的优势普遍被认可[4]。近几年来,dPCR的发展引起众多学者的关注,但很少人从病毒学领域对dPCR进行综述,因此本文将对dPCR发展史、dPCR的原理、dPCR和qPCR的比较进行简单的阐述,以及dPCR在病毒检测中近几年的应用及发展趋势做出详细综述。
1 d PCR发展史
1990年Ruano等[5]应用单分子稀释和泊松定律统计方法研究单倍体DNA。1992年Sykes等[6]描述了基于有限稀释量化初始样本、PCR和泊松统计,虽然当时这种方法没有被命名为数字PCR,但却建立了数字 PCR的基本流程。到1999年Vogelstin等[7]通过描述稀释分离单分子并通过PCR单独扩增,然后用荧光探针分析每个产物是否存在突变,并且通过检测大肠癌症患者粪便中的ras癌基因,证明了该方法的可行性,第一次提出了数字PCR的概念。2003年Dressman等[8]提出了一种基于微乳液和磁珠的固相数字PCR方法—BEAMing技术,该技术将模板与连接引物的磁珠以极低的浓度包裹在油水两相的液滴中,然后进行扩增,扩增产物吸附在磁珠表面,破乳收集进行检测。随着纳米技术和微流体技术的发展,数字PCR技术突破瓶颈,商业化数字PCR系统迅速发展(表1)。2006年Fluidigm公司推出了第一台基于芯片的商业化数字PCR系统。2011年Bio-Rad公司微滴式数字PCR仪QX100TM在市场上销售,2013年该公司又推出了升级型号QX200TM开始热卖。2012年,RainDance公司将二代测序文库制备平台技术平移到数字PCR技术平台推出RaindropTM数字PCR技术平台,该系统能将反应体系分成100万到1 000万个pl级别微滴的反应乳液,适用于更大浓度差别样品之间的定量。2013年Life technologies推出QuantStudio 3D数字PCR系统,在整个操作过程中样品之间保持完全隔离,有效的防止了交叉污染。迄今为止,数字PCR在众多领域蓬勃发展起来。
2 d PCR的原理
数字PCR实验过程中应用的引物和探针均可直接套用于qPCR,但是数字PCR的“单分子模板PCR扩增”技术使其灵敏性和准确性明显高于qPCR。数字PCR的过程至少要包括3个环节,即标本的离散、PCR扩增、荧光信号的收集以及数据分析。标本离散即将含有模板的PCR体系分散成数百个或是数百万个独立的反应体系,使每个反应体系中包含1个或是不包含或是包含多个核酸模板,进而对单独的反应体系进行PCR扩增,扩增结束后依次读取每个反应体系的荧光信号确定阴性还是阳性进而进行统计学分析,直接计算出原始标本中的模板拷贝数,如果单个反应体系包括2个或是更多的核酸模板,能够通过泊松分布进行校正。总而言之,数字PCR的原理非常简单,它无需依靠标准曲线就实现了标本的绝对定量检测,此外对数字PCR结果判读时不需要任何阈值仅判读为有或无两种状态。
3 d PCR和qPCR的比较
不依赖标准曲线能够实现对标本核酸的绝对定量是dPCR的最大优势[9],相对qPCR而言,必须依赖梯度稀释标准品建立标准曲线对核酸标本进行相对定量,构建标准曲线的标准品本身又缺乏统一的计量标准,所以同一份标本对不同操作者或是不同时间所得出的相对定量结果可能会有很大偏差[10]。dPCR可将反应体系分散成无数个独立的反应单元,不但实现了单分子模板扩增,而且有效的稀释了抑制反应扩增的物质,使其很少会影响PCR扩增效率,有研究表明或许可通过免提核酸的方法直接运用dPCR进行核酸的原始定量[11],而qPCR在一个反应体系内,由于受抑制物的影响反应效率往往会比实际值偏低。相对灵敏度而言,dPCR和qPCR似乎相差不大[12],然而dPCR在核酸精准定量和监测低病毒载量时似乎更加准确,此外dPCR在低丰度检测方面占有优势[10],见表2。
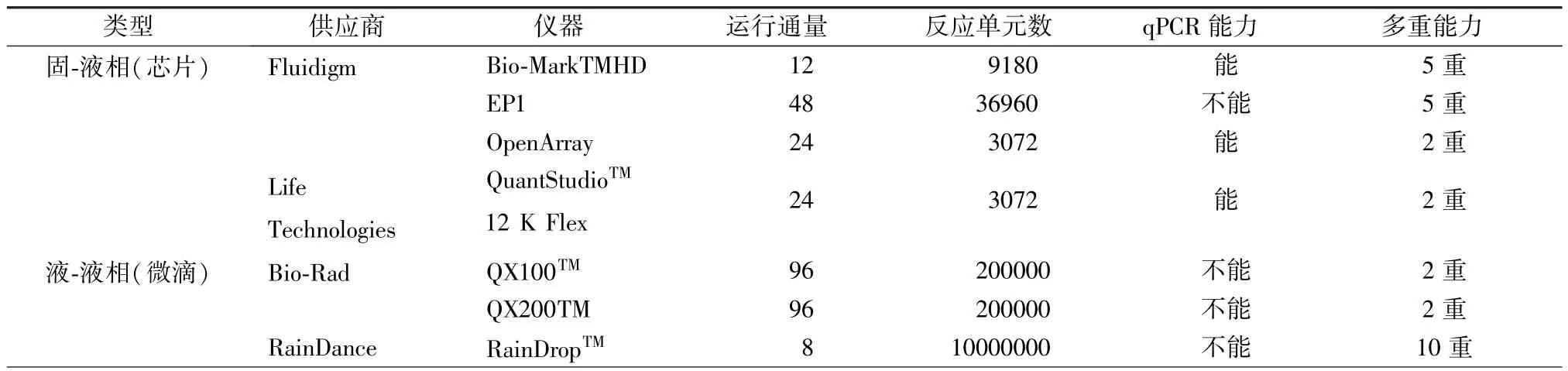
表1 商业化数字PCR平台概述Tab.1 An overview of the commercialized digital PCR platform
然而,dPCR和qPCR相比也有不足。许多研究证明了dPCR绝对定量DNA的准确性,但是很少报道其定量RNA,因为反转录步骤对于某些RNA靶标可能是不完整的,而样品中的所有模板不一定都会被测量[13]。在qPCR技术检测平台中大部分仪器可检测4个荧光通道,而dPCR一般只有两个荧光通道限制了在同一样本中对不同目标进行多重检测的能力。一般情况下,dPCR由于离散标本能力有限最多只能独立千万个反应体系,所以在检测高浓度标本时能力受限。此外,dPCR的耗材和试剂相对qPCR昂贵,在制备微滴时由于系统的开放性增加了污染的可能性[14],见表2。
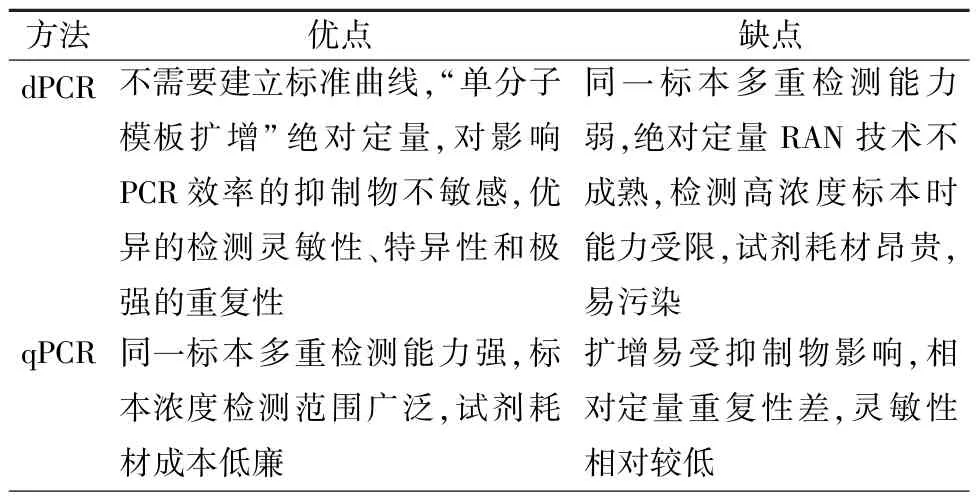
表2 dPCR和qPCR两种方法的比较Tab.2 The comparation of dPCR and qPCR
4 d PCR在病毒检测中的应用
自dPCR商业化以来,它在病毒检测方面的应用备受欢迎,并且已经用于量化许多病毒载量,已有文献报道的包括HIV病毒[15]、巨细胞病毒[12,24]、乙型肝炎病毒[16]、人乳头瘤病毒[17]、人鼻病毒[18]、疱疹病毒[19]、戊型肝炎病毒[20]、双埃可病毒3型[21]、甲型肝炎病毒和诺如病毒[22]以及日本脑炎病毒[23]。其中对于巨细胞病毒的研究表明,病毒载量的微小变化在临床上也具有明显的意义,Waggoner等[24]对22位巨细胞感染的患者进行病毒载量的监测,结果显示病毒载量从200拷贝/ml以下增长到200拷贝/ml以上时患者会出现明显的症状。Strain等[15]论证并分析了dPCR能够有效地监测HIV患者在接受抗逆转录治疗过程中病毒载量在患者体内的变化,并提出dPCR的高灵敏性和准确性有助于测量潜伏中的HIV病毒进而能够及时干预进而达到早期消除的目的。关于dPCR检测早期HPV相关浸润性癌患者血清中人乳头瘤病毒DNA的研究表明在HPV相关癌症患者中,可以使用这种高灵敏性的技术进行亚临床肿瘤肿块的生物学检测,例如对微小残留疾病或早期复发的肿瘤[17]的监测。同样有研究对107份HBV表面抗原阳性和24份HBV表面抗原阴性肝癌患者石蜡包埋组织用dPCR检测技术进行了病毒载量的评估,结果显示131分组织标本中均检测到HBV且病毒载量范围在1.1~175.5拷贝/μl之间,通过统计学计算进一步论证了HBV载量与肿瘤的淋巴结转移、临床分期以及血清胆碱酯酶呈正相关关系。此项研究不仅论证了dPCR方法在检测低浓度HBV标本的超高灵敏度,同样为HBV表面抗原阴性患者需及时接受治疗进一步提供理论基础[16],并且进一步充分说明了精确量化病毒载量在临床工作中的重要性。关于dPCR高灵敏性的研究,Sedlak等[18]通过RT-qPCR方法和RT-dPCR方法对人鼻病毒不同基因型进行检测比较,并提出RT-dPCR可能是未来人鼻病毒定量研究和定量具有高序列多样性的其他病毒的最佳分子检测方法。人类疱疹病毒6型(HHV-6)能够潜伏感染大多数成人。在大约1%的人群中,HHV-6能够整合在人类染色体上(CIHHV-6),并且存在于每一个体细胞和生殖细胞中,可以通过生殖系传播,在检测HHV-6病毒载量时 CIHHV-6经常被忽视,Sedlak等[19]运用dPCR建立了快速准确的实验室检测CIHHV-6方法。Nicot等[20]提出,实时荧光定量PCR技术对戊型肝炎病毒RNA的定量在技术上有很大差异,因此需要一个标准化工具对戊型肝炎进行病毒定量,同时他们应用qPCR技术与自己建立的dPCR检测方法同时检测戊型肝炎临床标本,并提出dPCR技术可作为各种类型标本中戊型肝炎RNA定量标准化的有效工具。甲型肝炎病毒、诺如病毒[22]以及日本脑炎病毒[23]的dPCR检测技术方法与qPCR检测技术方法的检测结果同样论证了dPCR检测技术在病毒学领域的优势,尤其是对低浓度样本的检测。综合以上研究表明,精确量化病毒载量对于临床治疗尤为重要,检测技术水平的精确度越高指导临床诊治的指标才会越可靠。dPCR检测技术在病毒检测领域应用前景非常广泛。
对于dPCR高灵敏性的特点,同样可应用于病毒耐药突变的检测,Whale等[25]通过dPCR对H1N1耐奥司他韦的研究表明在临床检测点突变dPCR要比qPCR法提高50倍,其次,提出了一种确定假阳性率(背景)信号的方法。最后,对比 dPCR和qPCR在检测临床标本的结果中显示dPCR可以通过早期(微量)检测罕见的耐药序列变异来进行临床研究和患者管理。同样有研究表明,dPCR的超高灵敏性可用于HCV的突变检测,Motokazu等[26]的研究结果显示在野生型是突变型20 000倍时检测上线为0.005%,证明dPCR在低丰度检测过程中独特的优势。因此dPCR技术不但可用于病毒耐药突变的相对和绝对定量还可应用于其他病毒基因组多态性的突变检测。
qPCR病毒定量结果在各实验室之间可比性较差,导致标准品没有统一的标准,目前制定标准品的标准是采用对不同实验室的结果取平均得到。最近美国国家标准与技术研究院采用dPCR对巨细胞病毒进行了绝对拷贝数的测量,这也是第一次采用dPCR进行病毒定标,所以dPCR同样在定量标准品中具有巨大潜在优势[27]。
5 发展趋势
在过去的几年中,dPCR的应用、仪器设备及其性能受到越来越多的关注,这导致对该技术优缺点的认识大幅增加。关于这些缺点的进一步研究是必要的,以允许广泛和常规使用dPCR作为诊断工具,其中包括消除假阳性结果(对于低分子水平量化标本尤其重要),设计实验时的缺陷,分析数据和增加数据分析程序的可用性。随着这些问题的解决,dPCR对比qPCR的优势会更加明显,以及该技术的推广会越来越广泛,才有可能实现dPCR最为常规诊断工具。虽然qPCR方法中的反应条件和反应体系可直接转移到dPCR平台。但是,在诊断测试推广前,应该进行大量前期临床验证。与qPCR相比,检测特异性、检测限和PCR抑制物质的不同影响可能导致dPCR的性能更好或更差。另外,在某些情况下,精确性和准确性的提高可能并不具有临床意义,因此目前的dPCR平台可能不具有成本效益。未来的平台能够以低成本实现高吞吐量,并且具有足够高的动态范围,可能会替代未来的许多qPCR应用。
dPCR作为一种新的核酸检测技术平台为病毒学研究领域提供了一种全新的技术思路和手段。由于成熟化商品可选择性不高,技术普及不完全和耗材成本远高于qPCR,所以dPCR很难在短时间内取代qPCR。但dPCR以其独特的优势以及与多种检测方法进行融合势必在病毒载量检测、病毒耐药点突变、稀有碱基突变等应用中发展越来越广泛,相信在不久的将来dPCR定能够在临床病毒检验诊断中占据一席之地。
从目前发展趋势来看,下一代测序方法已经成为生命科学领域研究工作中增长最快的一部分,将下一代测序方法与dPCR联合使用可被视为未来病毒学领域应用的发展趋势,前者的优势在于发现未知病原的核酸序列,dPCR主要负责对这些未知病原进行定量。所以不管是dPCR本身还是与其他技术联合,都必将成为病毒学领域的一场伟大革命,这一革命性技术的发展不仅能在科研领域得以应用,也定会在临床工作中发挥重要作用,更直接的服务医疗卫生系统。
利益冲突无
