ALDH2对大鼠心肌缺血/再灌注损伤与凋亡的影响及机制的研究
2018-05-24杨丽张俊峰杨文龙张田田
杨丽,张俊峰,杨文龙,张田田
心肌缺血/再灌注损伤(IRI)是指缺血心肌恢复血流再灌注后,反而加重其结构破坏,导致细胞死亡,梗死范围扩大,造成心功能进一步损害[1]。其损伤程度可影响缺血性心脏病的治疗和预后[2]。以往认为心肌缺血/再灌注损伤所致的心肌细胞死亡是坏死,近来研究提示尚有凋亡参与IRI的形成[3,4]。
目前关于缺血/再灌注损伤的机制尚不明确,多数学者支持氧化应激学说。乙醛脱氢酶2(ALDH2)是体内重要的酶。目前关于ALDH2激动剂预处理对心肌缺血/再灌注损伤细胞凋亡以及通路影响的研究较少。本研究旨在观察应用ALDH2激动剂促进ALDH2高表达后,大鼠心肌缺血/再灌注损伤中Bcl-2、Bax和细胞凋亡的变化,并探讨ALDH2是否通过JNK通路抑制凋亡。
1 材料与方法
1.1 实验动物与分组 健康雄性成年SD大鼠40只,体重(220±20)g,购自上海杰思捷实验动物有限公司。随机分为4组,每组10只,分别为:①假手术组:冠状动脉左前降支暴露后关闭切口;②激动剂(乙醇)+假手术组:术前3 h,腹腔注射5%乙醇(1 g/kg)之后,暴露冠状动脉左前降支,并关闭切口;③缺血/再灌注组:暴露冠状动脉左前降支,并结扎30 min模拟局部心肌缺血,而后松结扎线,并恢复灌流2 h;④激动剂(乙醇)+缺血/再灌注组:同缺血/再灌注组,但在术前3 h,腹腔注射5%乙醇(1 g/kg)。
1.2 主要试剂及仪器 羊抗ALDH2单克隆抗体、鼠抗Bcl-2、Bax单克隆抗体、鼠抗JNK、P-JNK单克隆抗体购自Santa公司,GAPDH购自Abcam公司。ALDH2兔抗羊二抗、Bcl-2、Bax兔抗鼠二抗、JNK、P-JNK兔抗鼠二抗购自Santa公司。TUNEL试剂盒购自Roche公司;蛋白酶K购自Roche公司;倒置荧光显微镜(Nikon Eclipse Ti-SR);电泳仪(型号EPS-600, 上海天能科技有限公司生产)。
1.3 动物模型制作 大鼠术前禁食8 h,然后经腹腔注射3%戊巴比妥钠溶液0.1 ml/100 g,麻醉后固定于手术台,颈、胸部备皮,应用碘伏消毒,颈部纵行切口,仔细分离皮下组织及肌肉,显露气管,行气管插管并连接呼吸机,调整呼吸频率和通气量。于胸骨左缘3 mm处剪开胸部皮肤约4 cm,钝性分离皮下组织、胸大肌与前锯肌,撑开肌肉,显露肋骨、肋间肌,于第三肋间隙逐步剪开,显露并撕破心包,可见心脏,探查确定左心耳,确定缝扎位置(肺动脉圆锥与左心耳交界处下方2 mm,前降支LAD近端位置),0号线结扎LAD,缺血30 min,松开结扎,复灌2 h。每组随机抽取5只用于心肌梗死面积测定,另外5只取左心室用于心肌组织苏木精-伊红(HE)染色,Western blot测定ALDH2、JNK、p-JNK、Bcl-2和Bax蛋白的表达,TUNEL检测细胞凋亡情况。
1.4 心肌梗死面积计算 将左心室切成厚度3~4 mm的薄片3片,置于避光的1% TTC染液中。置入37℃恒温箱20 min,使均匀染色,去离子水冲洗干净,非梗死区心肌染色呈深红色,心肌梗死区为灰白色。应用Image J软件测量并统计每块梗死心肌占全部左心室心肌面积的百分比。
1.5 HE染色镜检 将取下的部分心肌置于甲醛中依次固定、脱水、石蜡包埋,制成5 μm的切片,行HE染色,随机选取切片5张,应用显微镜观察心肌组织形态学改变。由1名不了解分组情况的观察者独立完成镜检并采集图片。
1.6 Western blot测心肌ALDH2、JNK、p-JNK、Bcl-2、Bax蛋白表达量 将各组心肌组织匀浆,高速离心后,测定并调整蛋白浓度,制备电泳样品,每孔上样20 μl。电泳、转膜,5%BSA室温封闭1 h。一抗稀释液4℃孵育过夜,TBST洗涤3次,每次5 min。随后根据用量,按照1:5000稀释HRP标记的二抗,与膜37℃孵育1 h。ECL发光液加在膜的正面暗室避光5 min。暗室中用X胶片感光、显影、定影。
1.7 TUNEL法检测细胞凋亡 组织切片、脱蜡后,加入2 μg/ml蛋白酶K,37℃孵育30 min;然后滴加破膜工作液,孵育20 min,PBS洗涤3次,每次5 min。按切片数量和组织大小取Tunel试剂盒内适量试剂1(TdT)和试剂2(dUTP)混合覆盖组织,37℃孵育2 h。每张切片滴加转化物POD(盖过组织即可),疏水膜覆盖,湿盒中恒温37℃反应30 min;取出后PBS液冲洗2 min,重复3次。每张切片滴加DAB应用液50 μl,室温染色10 min;取出后PBS液冲洗2 min,重复3次。每张切片滴加苏木素1滴,染色10 min,蒸馏水冲洗30 s;梯度酒精脱水、二甲苯透明、中性树脂封片,镜检。每个标本计数8个高倍镜(×400)视野内的所有阳性细胞个数和所有细胞数,求其比值。每张切片由2名观察者分别读片得出。计算公式:

1.8 统计学处理 采用SPSS 19.0统计学软件进行分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用方差分析,多重比较采用SNK检验,相关性分析应用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组心肌梗死比较 缺血/再灌注组和激动剂+缺血/再灌注组均可见心肌梗死区,缺血/再灌注组心肌梗死比例较激动剂+缺血/再灌注组明显增大,(52.51±7.12)%vs. (24.10±5.37)%,差异有统计学意义(P<0.05),(图1)。

图1 各组心肌组织TTC染色
2.2 各组心肌组织病理学改变 假手术组和激动剂+假手术组大鼠心肌纤维排列整齐,染色均匀,结构清晰,未见明显萎缩、肥大或坏死。心肌细胞形态完整,细胞核致密。缺血/再灌注组大鼠心肌纤维排列紊乱,间质水肿,组织间隙明显增宽,心肌细胞多处肿胀、溶解断裂,发生空泡样变性,细胞核肿胀,甚至消失;而激动剂+缺血/再灌注组的心肌损伤较轻,可见心肌纤维结构尚完整,轻度水肿,组织间隙轻度增宽,心肌细胞排列尚整齐,部分核染色呈深染改变(图2)。
2.3 各组心肌ALDH2、JNK、p-JNK、Bcl-2、Bax蛋白表达比较 缺血/再灌注组、激动剂+缺血/再灌注组、假手术组和激动剂+假手术组ALDH2表达分别为(25.28±3.92)、(37.42±7.27)、(100.0±0.00)、(116.83±5.61),前两组低于后两组,且缺血/再灌注组ALDH2表达低于激动剂+缺血/再灌注组,差异有统计学意义(P均<0.05)。缺血/再灌注组Bcl-2蛋白表达较激动剂+缺血/再灌注组降低[(22.24±3.20)vs. (32.04±4.86)],Bax表达较激动剂+缺血/再灌注组升高[(131.88±16.88)vs. (114.50±5.15)],差异有统计学意义(P均<0.05)。缺血/再灌注组Bcl-2/Bax比值较激动剂+缺血/再灌注组降低 [(0.17±0.04)vs. (0.28±0.05)],差异有统计学意义(P<0.05)。四组均可测得JNK、p-JNK蛋白表达,缺血/再灌注组JNK蛋白表达高于激动剂+缺血/再灌注组[(193.03±3.98)vs.(154.17±9.82)],p-JNK表达也高于激动剂+缺血/再灌注组[(229.16±11.17)vs. (165.57±9.30)],p-JNK/JNK比值高于激动剂+缺血/再灌注组[(1.20±0.05)vs. (1.10±0.04)],差异有统计学意义(P均<0.05)(图3)。

图2 各组心肌组织HE染色
2.4 各组心肌凋亡结果比较 四组均可观察到凋亡的细胞。缺血/再灌注组和激动剂+缺血/再灌注组细胞凋亡率均高于假手术组和激动剂+假手术组,[(38.36±9.08)%、(16.33±2.29)%vs.(4.76±1.41)%、(5.19±0.62)%],差异有统计学意义(P均<0.05)。缺血/再灌注组细胞凋亡率高于激动剂+缺血/再灌注组(图4)。

图3 各组心肌组织ALDH2、JNK、p-JNK、Bcl-2、Bax蛋白表达比较
2.5 心肌ALDH2、JNK表达量及凋亡率的相关性分析 四组大鼠左心室ALDH2表达量与凋亡率呈负相关(相关系数为-0.799,P<0.01);ALDH2表达量与p-JNK/JNK呈负相关(相关系数为-0.752,P<0.01)。
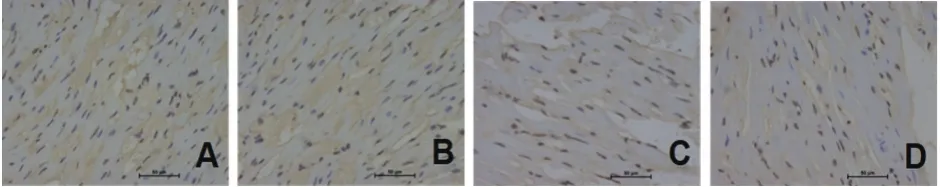
图4 各组心肌组织TUNEL染色
3 讨论
目前国内心血管疾病的发病人数逐年增加,随着经皮腔内冠状动脉成形术,冠状动脉内支架置入术、冠状动脉旁路移植术以及溶栓治疗等的广泛应用,缺血性心脏病的治疗取得了显著进展[5]。而心肌缺血/再灌注损伤可诱导心肌细胞凋亡,增加心肌梗死面积[6],这也成为缺血心肌从再灌注疗法中获得最佳疗效的首要难题[7]。
缺血/再灌注损伤病理机制比较复杂,大多数研究认为是多种因素、多种途径共同作用的结果。大多数学者支持氧化应激学说。氧化应激过程中,自由基的过度生成会导致组织内氧化/还原平衡紊乱,过多的自由基将使细胞DNA解链和脂质过氧化等,从而引起蛋白的失活等。氧化应激可破坏相关酶活性及破坏线粒体的结构,导致细胞的凋亡和死亡,加重组织损伤。
乙醛脱氢酶2(ALDH2)是体内乙醇代谢的重要醛类氧化酶,可阻止乙醛及其代谢产物对膜的脂质过氧化,ALDH2是体内重要的抗氧化应激的保护因子。ALDH2在心、脑、肝脏等组织中表达丰富,参与了各种内源性、外源性脂肪及芳香族醛类物质代谢或解毒过程,对氧化应激起到防护作用[7]。Chen等[8]研究发现,乙醛脱氢酶2可减轻缺血心肌的氧化应激。本实验观察到在大鼠心肌缺血/再灌注损伤前应用ALDH2激动剂乙醇,心肌梗死面积减少,病理改变减轻,心肌组织ALDH2增高,Bcl-2蛋白表达升高,Bax蛋白表达下降,Bcl-2/Bax比值升高,细胞凋亡降低。说明促进ALDH2高表达后,抑制细胞凋亡,缺血/再灌注损伤减轻。
c-Jun氨基末端激酶(JNK)信号通路是丝裂原活化蛋白激酶(MAPKs)家族中重要的通路之一,存在于多种生命活动过程中并且容易受多种细胞外应激因素激活并介导细胞凋亡[9]。JNK介导体内多种细胞的凋亡,并参与凋亡。目前认为JNK介导凋亡的机制主要有两种[10]:一是转录因子途径,是指通过转录方式调节下游调节因子的转录和凋亡蛋白的表达而介导死亡受体途径和线粒体途径的细胞凋亡。如活化的JNK由细胞质进入细胞核,激活相应转录因子AP-1蛋白、ATF-2等,诱导FasL、TNF等死亡配体的表达,启动死亡受体介导细胞凋亡[11],进入细胞核的活化JNK,激活相应转录因子后可诱导BH3-only蛋白的表达,然后活化Bax等促凋亡蛋白,进入线粒体,破坏线粒体膜的通透性,引起细胞凋亡;二为非转录因子途径。在JNK活化过程中,部分活化的JNK留在了细胞质中,未进入细胞核,这部分活化的JNK通过磷酸化作用直接作用于Bcl-2家族,调节它们活性而介导线粒体途径的细胞凋亡,此过程没有新基因的表达[12]。
Bcl-2是目前公认有抑制细胞凋亡作用的因子[13]。Bcl-2和Bax表达量对细胞凋亡起重要作用[14,15]。当Bcl-2表达增高时,可形成Bcl-2-Bax异源二聚体,抑制细胞凋亡;相反,当Bax表达增高时,可形成Bax/Bax同源二聚体,促进细胞凋亡。故Bcl-2和Bax的比值可反映细胞受刺激后是凋亡还是存活。结合本实验,在激动剂+缺血/再灌注组和缺血/再灌注组观察到的Bcl-2、Bax及Bcl-2/Bax比值变化,考虑JNK可能通过上述两种机制参与细胞凋亡发生。
本研究推测,高表达ALDH2可减轻心肌缺血/再灌注损伤,可能通过抑制JNK、p-JNK蛋白表达增加,减少心肌细胞凋亡的发生。为临床上心肌缺血/再灌注损伤预防和治疗提供新的思路。
参 考 文 献
[1]Zhu L,Wei T,Gao J,et al. The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J]. Apoptosis,2015,20(11):1433-43.
[2]Jennings RB. Historical perspective on the pathology of myo- cardial ischemia/reperfusion injury[J]. Circ Res,2013,113(4):428-38.
[3]Black SC,Huang JQ,Rezaiefar P,et al. Colocalization of the cysteine protease caspase-3 with apoptotic myocytes after in vivo myocardial ischemia and reperfusion in the rat[J]. J Mol Cell Cardiol,1998,30(4):733-42.
[4]吴强,李隆贵,耿昭华. 心梗肌梗死后心衰大鼠心肌细胞凋亡相关基因表达的变化[J]. 第三军医大学学报,2002,2(4):434-6.
[5]Prunier F,Angoulvant D,Saint EC,et al. The RIPOST-MI study,assessing remote ischemic perconditioning alone or in combination with local ischemic postconditioning in ST-segment elevation myocardial infarction[J]. Basic Res Cardiol,2014,109(2):400.
[6]Ostadal B. The past,the present and the future of experimental research on myocardial ischemia and protection[J]. Pharmacol Rep,2009,61(1):3-12.
[7]Murphy TC,Arntzen R,Sr M J P. Nitrate-based vasodilators inhibit multiple vascular aldehyde dehydrogenases[J]. Cardiovasc Toxicol,2005,5(3):321-32.
[8]Chen CH,Budas GR,Churchill EN,et al. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart[J]. Science,2008,321(5895):1493-5.
[9]Bogoyevitch MA,Ngoei KR,Zhao TT,et al. c-Jun N-terminal kinase(JNK) signaling: recent advances and challenges[J]. Biochim Biophys Acta,2010,1804(3):463-75.
[10]Bogoyevitch MA,Kobe B. Uses for JNK:the many and varied Substrates of the c-Jun N-terminal kinases[J]. Microbiol Mol Biol Rev,2006,70(4):1061-95.
[11]Pan J,Zhao YX,Wang ZQ,et al. Expression of FasL and its interaction with Fas are mediated by c-Jun N-terminal kinase (JNK) pathway in 6-OHDA-induced rat model of Parkinson disease[J]. Neurosci Lett,2007,428(2-3):82-7.
[12]Guan QH,Pei DS,Xu TL,et al. Brain ischemia/reperfusion-induced expression of DP5 and its interaction with Bcl-2, thus freeing Bax from Bcl-2/Bax dimmers are mediated by c-Jun N-terminal kinase(JNK) pathway[J]. Neurosci Lett,2006,393(2-3):226-30.
[13]Park S,Park CS,Hossain M,et al. Korean red ginseng extract induces apoptosis and decreases telomerase activity in human leukemia cells[J]. J Ethnopharmacol,2009,121(2):304-12.
[14]Martin LJ. Neuronal cell death in nervous system developme-Nt,disease,and injury(Review)[J]. Int J Mol Med,2001,7(5):455-78.
[15]黄冬冬,刘冬梅,王颖利,等. 大蒜素对全脑缺血再灌注损伤大鼠海马凋亡相关蛋白表达的影响[J]. 临床神经病学杂志,2015,28(3):210-3.
