CormⅡ对脓毒症血小板α颗粒释放的影响及作用机制
2018-05-23黄立方强
黄 立 方 强
(浙江大学医学院附属第一医院,浙江 杭州 310003)
脓毒症可发展为休克和多器官功能障碍综合征(MODS)。凝血功能紊乱在脓毒症发病过程中具有重要作用〔1,2〕。血小板是凝血系统的主要功能成分,脓毒症发病时产生的大量炎症介质会促进血小板活化,血小板α颗粒(PLT-α)释放出血小板衍生因子(PDGF)-bb、基质金属蛋白酶(MMP)-2等活性物质,可进一步加重凝血系统紊乱和炎症损伤〔3〕。外源性一氧化碳释放分子(Corm)Ⅱ可将携带的一氧化碳释放入组织气管中发挥作用〔4〕。相关研究发现,CormⅡ可明显抑制脓毒症时大鼠体内血小板的聚集、释放及体内炎症反应〔5〕。本研究旨在探讨CormⅡ对PLT-α释放的影响及作用机制。
1 材料与方法
1.1主要试剂 CormⅡ、脂多糖、兔抗人VAMP8单抗购于宝日医生物技术(北京)有限公司;鼠抗人FITC-CD41单抗、血小板P选择素单抗、MUNC18a单抗均于上海科华生物工程股份有限公司;兔抗人p-PPKCδ单抗、p-PMUNC18a单抗购于上海捷瑞生物工程有限公司;PDGF-bb、MMP-2试剂盒购于南京森贝伽生物科技有限公司;PKCδ抑制剂LY317615购于美国MCE公司。
1.2模型建立与分组 采集健康供血者空腹外周静脉血30 ml,抗凝处理后1 500 r/min离心20 min,取上层富含血小板的血浆,随机分为5组:空白对照组(不作处理)、脂多糖组(10 μmol/L脂多糖诱导)、无活性CormⅡ组(脂多糖和30 μmol/L无活性CormⅡ诱导)、10 μmol/L和30 μmol/L CormⅡ组(10 μmol/L脂多糖诱导的同时给予不同浓度CormⅡ诱导);各组均放入37℃ 5% CO2培养箱中孵育2 h。
1.3检测方法
1.3.1酶联免疫吸附法(ELISA)检测PDGF-bb、MMP-2含量 取各组上清液用ELISA检测PDGF-bb、MMP-2含量,严格按试剂盒说明书操作;读取酶标仪492 nm波长处吸光度值,计算其浓度。
1.3.2流式细胞术检测血小板P选择素表达 取样品放入流式细胞仪试管中,在终浓度为10%的甲醛溶液固定20 min。向各组中分别加入FITC-CD41、血小板P选择素单抗,室温下暗室中反应20 min,流式细胞仪通过单抗免疫标记检测呈阳性的血小板比例。
1.3.3免疫荧光法检测PLT-α分布情况 取各组细胞悬液放入2 ml离心管中,4℃ 2 000 r/min离心10 min,弃去上清,下层沉淀为血小板,室温下10%的低聚甲醛固定30 min。磷酸缓冲液洗涤,标本放于冰上用0.5%曲拉通X-100通透30 min,室温下用1%牛血清白蛋白(BSA)封闭3 h。滴加兔抗人VAMP8单抗,4℃反应过夜,次日滴加二抗,室温下暗室中匀速摇晃60 min,磷酸缓冲液洗涤,4℃ 2 000 r/min离心10 min,弃去上清,重悬后在倒置显微镜下观察PLT-α分布。
1.3.4Western印迹法检测p-PKCδ、p-MUNC18a蛋白表达情况 为进一步探讨CormⅡ影响PLT-α释放的作用机制,增加LY317615组(10 μmol/L脂多糖+100 nmol/L LY317615)、CormⅡ+LY317615组(10 μmol/L脂多糖+30 μmol/L CormⅡ+ 100 nmol/L LY317615)。采集30 ml外周静脉血,分离得到上层富含血小板的血浆,随机分为6组,每组含2.5 ml富含血小板的血浆,按上述处理:37℃ 5%CO2培养箱中孵育30 min。收集各组样品,4℃ 2 000 r/min离心10 min,获取血小板,加300 μl含磷酸酶、蛋白酶抑制剂的裂解液,冰上裂解40 min。4℃ 10 000 r/min离心10 min,弃去不溶物,测定蛋白浓度。加上样缓冲液,煮沸10 min,冷藏保存。十二烷基硫酶钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳、转膜后室温下封闭3 h,滴加兔抗人p-PKCδ单抗、p-PMUNC18a单抗,4℃孵育过夜,滴加辣根过氧化物酶(HRP)标记的二抗,室温下孵育3 h。洗涤后电化学发光(ECL)显色,测定条带灰度值。
1.4统计学分析 使用SPSS21.0软件行t检验。
2 结 果
2.1CormⅡ对脂多糖诱导后PLT-α内容物释放的影响 脂多糖诱导后PLT-α释放的PDGF-bb、MMP-2及血小板P选择素表达水平均明显高于空白对照组,差异有统计学意义(P<0.05);无活性CormⅡ组PLT-α内容物释放及血小板P选择素表达水平与脂多糖组差异无统计学意义(P>0.05);CormⅡ诱导后,PLT-α释放的PDGF-bb、MMP-2明显减少,血小板P选择素表达水平明显降低且呈剂量依赖性。见表1。

表1 CormⅡ对脂多糖诱导后PLT-α内容物释放的影响
与对照组相比:1)P<0.05;与脂多糖组相比:2)P<0.05
2.2CormⅡ对脂多糖诱导后PLT-α分布的影响 VAMP8单抗标记的PLT-α免疫荧光检测显示,脂多糖诱导后中央区的PLT-α逐渐向血小板磷脂膜区转移,与磷脂膜融合后释放到血小板外;无活性CormⅡ组与脂多糖组PLT-α分布情况相似;CormⅡ诱导后PLT-α向血小板膜汇聚明显减少。见图1。
2.3CormⅡ对血小板PKCδ活性的影响 脂多糖诱导后血小板PKCδ磷酸化(p-PKCδ)相对表达量为1.12±0.45,明显高于对照组的0.55±0.17,差异有统计学意义(P<0.05);无活性CormⅡ组p-PKCδ相对表达量为1.15±0.31,与脂多糖组之间比较差异无统计学意义(P>0.05);LY317615组、CormⅡ组、CormⅡ+LY317615组p-PKCδ相对表达量分别为0.62±0.10、0.67±0.24、0.64±0.05,与脂多糖组和无活性CormⅡ组相比明显降低,差异有统计学意义(P<0.05)。见图2。
2.4CormⅡ对血小板MUNC18a活性的影响 脂多糖诱导后血小板MUNC18a磷酸化(p-MUNC18a)相对表达量为2.41±0.28,明显高于对照组的1.33±0.45,差异有统计学意义(P<0.05);无活性CormⅡ组p-MUNC18a相对表达量为2.48±0.56,与脂多糖组之间差异无统计学意义(P>0.05);LY317615组、CormⅡ组、CormⅡ+LY317615组p-MUNC18a相对表达量分别为1.62±0.49、1.59±0.17、1.40±0.13,与脂多糖组和无活性CormⅡ组相比明显降低,差异有统计学意义(P<0.05)。见图3。

图1 VAMP8单抗标记的各组PLT-α
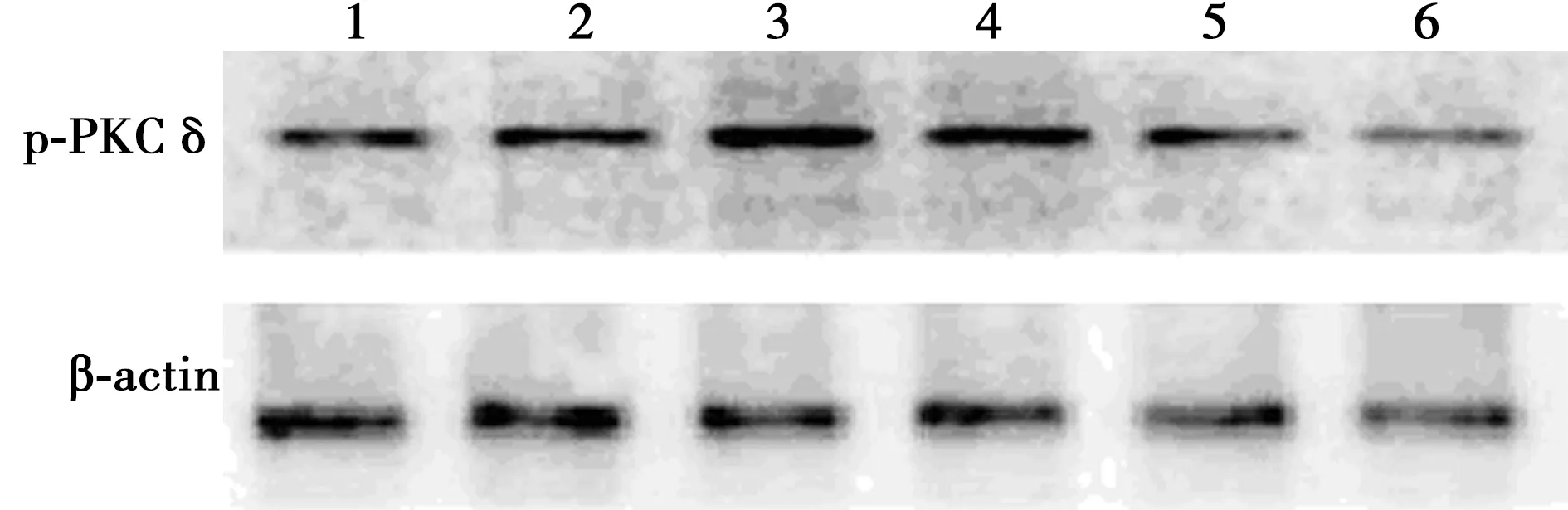
1:对照组;2:LY317615组;3:脂多糖组;4:无活性CormⅡ组;5:CormⅡ组;6:CormⅡ+LY317615组;同下图图2 CormⅡ对血小板PKCδ活性的影响

图3 CormⅡ对血小板MUNC18a活性的影响
3 讨 论
脓毒症发病过程中血小板异常活化具有重要作用,活化过程中还可刺激PLT-α释放出PDGF-bb、MMP-2、P-选择素等大量功能性蛋白分子。多种类型的活化分子在加速血小板活化的同时也加重了脓毒症的炎性损伤〔6〕。动物试验证实,CormⅡ分泌的一氧化碳可降低脂多糖诱导的血小板聚集、颗粒释放等异常活化,而单纯CormⅡ对血小板生理功能无明显影响。本实验结果显示,PLT-α内容物在脂多糖诱导后释放水平明显提升,而CormⅡ干预可明显降低内容物的释放量;进一步通过免疫荧光观察显示,脂多糖诱导后中央区的PLT-α逐渐向血小板磷脂膜区转移,与磷脂膜融合后释放到血小板外,CormⅡ干预可有效缓解上述趋势。
PKC家族是一种在哺乳动物体内广泛分布的蛋白激酶,目前共发现10种亚型,血小板中含有α、β、δ 3种亚型。相关研究发现,PKCα、PKCβ是在血小板正常生理功能中发挥正向调节作用,将其敲除后会明显降低血小板的分泌功能〔7〕;PKCδ主要调控血小板中致密颗粒的释放,在PLT-α释放中发挥作用〔8〕。SM蛋白是一系列亲水性蛋白分子家族,可参与PLT-α释放,已发现的释放相关SM蛋白包括MUNC18a、MUNC18b。其中人和小鼠的血小板中均含有MUNC18a,其参与血小板复合物形成的调控〔9〕。相关基础研究显示,MUNC18a是PKCδ主要的下游信号分子,当其活化后能够将MUNC18a第207位丝氨酸磷酸化,促进PLT-α的释放〔10〕。本次研究显示,脂多糖诱导后血小板PKCδ和MUNC18a磷酸化水平均增强,当给予PKCδ特异性抑制剂LY317615和CormⅡ干预后,磷酸化水平受到明显抑制。提示脓毒症发病时脂多糖诱导血小板活化,引发血小板中PKCδ磷酸化,其活性增加可进一步磷酸化下游MUNC18a,活化的MUNC18a可促进PLT-α释放。
综上,脓毒症发病时机体中血小板PKCδ/MUNC18a信号通路被激活,诱导PLT-α释放量增加;通过CormⅡ释放一氧化碳进行干预,可行PKCδ/MUNC18a通路活化,降低PLT-α释放,减弱脓毒症损伤。
4 参考文献
1樊楚明,杨欣悦,任靖宇,等.老年脓毒症患者APACHEⅡ评分与降钙素原及C-反应蛋白的相关性〔J〕.中国老年学杂志,2016;36(2):426-7.
3康秋香.脓毒症急性肺损伤时HSPA12B对肺血管通透性的影响及其机制〔D〕.上海:第二军医大学,2015.
4Campos IA,Ximenes EA,CarvalhoJúnior CHR,etal.Zymomonas mobilis culture protects against sepsis by modulating the inflammatory response,alleviating bacterial burden and suppressing splenocyte apoptosis〔J〕.Eur J Pharmaceuti Sci,2013;48(1/2):1-8.
5李 欣.右美托咪定对脓毒症大鼠炎症反应作用及其机制的研究〔D〕.长沙:中南大学,2013.
6Rascher D,Geerlof A,Kremmer F,etal.Total internal reflection (TIRF)-based quantification of procalcitonin for sepsis diagnosis--a point-of-care testing application〔J〕.Biosens Bioelectronics,2014;59:251-8.
7张 旭.脓毒症肺损伤时对HSPA12B有调控作用的miRNA筛选及其意义〔D〕.上海:第二军医大学,2015.
8谢克亮.氢气对脓毒症的保护效应及机制研究〔D〕.天津:天津医科大学,2013.
9孙改霞,刘圣君,赵自刚,等.血管通透性增高发生机制研究进展〔J〕.中国老年学杂志,2016;36(2):487-9.
10陈良宏,戢新平.脓毒性脑病危险因素分析及早期治疗〔J〕.北华大学学报:自然科学版,2012;13(6):668-71.
