施用生物炭和AM真菌对镉胁迫下玉米生长和生理生化指标的影响
2018-05-22李继伟悦飞雪王艳芳张亚梅倪瑞景王发园付国占刘领
李继伟,悦飞雪,王艳芳,张亚梅,倪瑞景,王发园,付国占,刘领
(河南科技大学农学院,河南 洛阳 471023)
镉(cadmium,Cd)是对植物毒性很强的土壤重金属污染元素之一[1],土壤中的镉一旦过量就很难将其从土壤中排除,其被植物吸收后会破坏植物叶绿体结构和功能,从而导致植物光合作用受到抑制和抗氧化系统的损伤[2-3]。另外,土壤重金属镉过量会导致农作物生长缓慢、产量和品质下降,并可通过食物链富集给人类健康带来巨大的危害[4]。近年来,由于人类含镉工业活动增加,过度施肥、污水灌溉等导致农田土壤中重金属镉污染日趋严重[5]。因此,如何修复重金属镉污染土壤是需要迫切解决的重要环境问题。
土壤微生物是修复重金属污染土壤的重要途径之一,其中丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一种能够和80%的植物根系互惠共生的根系微生物,不仅能够为宿主植物提供更多的营养和水分,还能够提高宿主植物对重金属镉的耐性[6-7]。另外,AM真菌不仅能够通过侵染宿主植物形成根外菌丝和分泌球囊霉素等直接固定重金属镉,还能改善宿主植物根际土壤微生物群落结构和物理、化学性质从而降低重金属的有效性,减轻重金属镉胁迫[8]。研究表明不同的AM真菌种类、土壤环境和污染程度也会导致AM真菌的作用效果差异巨大[9]。生物炭是以作物秸秆等为材料在低温厌氧条件下炭化产生的一种含碳量高、性质稳定的有机物质[10]。生物炭具有有机碳高、多孔结构、大的表面积和碱性的性质,不仅能够改善土壤质量,保水保肥,提高作物产量,还能够吸附和固定重金属,减轻植物重金属胁迫[11-12]。另外,由于生物炭孔隙能够贮存水分和养分,为微生物栖息生活提供优越的天然微环境,因此生物炭施入土壤能够显著增加土壤微生物的数量与活性,改善土壤微生物群落结构[12-13]。
研究表明生物炭[14-15]和AM真菌[16]单独施用均能够改善土壤性质,促进植物生长,但同时施用生物炭和接种AM真菌对促进植物生长,提高重金属的耐性的效果还鲜有报道。有研究表明,施用生物炭可以促进AM真菌孢子萌发和菌丝的分支、增长[17-18],玉米(Zeamays)是我国广泛种植的重要粮食作物之一,其易被AM真菌侵染,且对重金属有一定的耐性[19-20]。那么施用生物炭和接种AM真菌复合处理是否依然能够促进玉米生长,提高玉米对重金属镉的耐性。本研究以玉米为宿主植物,施加生物炭和接种AM真菌,比较不同镉污染水平下玉米生长,光合特性、抗氧化酶活性及土壤根际pH的变化规律,为评价重金属污染土壤中生物炭对AM真菌的菌根效应以及其复合应用对植物生长的影响提供理论依据,也为土壤重金属污染修复提供新的思路。
1 材料与方法
1.1 供试材料
试验土壤取自河南科技大学周山校区农场小麦田0~20 cm耕层,质地为粘壤土;土壤过2 mm筛后风干备用。供试土壤pH 7.6,有机质12.62 g·kg-1,总氮0.54 g·kg-1,碱解氮46.66 mg·kg-1,有效磷17.13 mg·kg-1,有效钾106.50 mg·kg-1,总镉0.072 mg·kg-1。供试玉米,品种为“弘单897”。
试验菌剂由河南科技大学环境监测实验室惠赠的AM真菌(GlomusintraradicesBEG 141)。菌根菌剂使用前以苏丹草(Sorghumsudanese)为宿主扩繁,基质为河沙。供试生物炭材料为购买于河南商丘三利新能源有限公司的小麦秸秆生物炭(于450 ℃条件下小麦秸秆限氧热解制成),基本理化性质为:pH值10.4,比表面积为8.92 m2·g-1, 有机碳为52.2%,全氮为5.9 g·kg-1,全磷为0.89 g·kg-1,全钾为23.2 g·kg-1。
1.2 试验设计
设置3个镉胁迫水平:0,3,6 mg Cd·kg-1。设计4个处理:对照(CK),添加生物炭(B),接种AM真菌(M),添加生物炭和接种AM真菌(BM),共计12个处理,每个处理4个重复,共48盆。
试验于2016年5-9月在河南科技大学周山校区隔雨棚中进行。将经生物炭或AM真菌处理的土壤混合均匀装入塑料桶中(盆口直径22 cm,高24 cm),每盆净重5 kg,生物炭、菌剂添加量均为20 g·kg-1,对照、生物炭和AM真菌处理分别添加相应质量的灭菌土壤,保持各处理每盆重量一致。镉添加以CdSO4水溶液的形式与土壤充分混合。土壤经吸附沉淀2个月左右后,于2016年5月10日播种玉米种子,每盆预先播种2粒,待出苗后每盆定苗1株,玉米植株定期定量以去离子水平衡水分,期间不进行肥料投入。玉米播种后60 d选择各处理中的4个重复,测定镉胁迫下玉米叶片的叶绿素含量、光合特性和生理指标。100 d收获前测定株高。玉米植株收获后植物样品地上部和根系分开取样,洗净,擦干。玉米须根用于测定菌根侵染率。采集植物根际的土壤样品0.5 kg,自然风干、过筛,用于测定土壤pH。
1.3 测定项目和方法
株高和生物量测定:玉米株高于收获前用刻度尺测定。植物样品地上部和根系洗净后用滤纸吸干, 称取整株鲜重,然后放入烘箱中,先在105 ℃杀青30 min,再在80 ℃烘干48 h至样品恒重,分别称取干物质生物量,计算干重。
光合色素含量的测定:玉米叶光合色素含量测定采用80%丙酮浸提法,参照文献[21]测定提取液叶绿素a、叶绿素b和类胡萝卜素含量。
光合指标测定:于晴天上午9: 00-11: 00采用LI-6400XT便携式光合测定系统(LI-COR,美国),选取功能盛期叶片测定光合指标, 包括净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)和胞间CO2浓度(intercellular CO2concentration,Ci)。每张叶片测定10次,取其平均值。测定光照强度为1200 μmol·m-2·s-1。
丙二醛(malondiadehyde,MDA)和抗氧化酶活性的测定:取0.5 g叶片组织, 加液氮充分研磨后, 用2 mL 10%三氯乙酸溶液提取丙二醛。加入2 mL含1%聚乙烯吡咯烷酮,(polyvinyl pyrrolidone, PVP)的0.1 mol·mL-1磷酸缓冲液(pH 5.5~8.8),于4 ℃下13000 r·min-1离心20 min,所得上清液即为酶粗提液[22]。
MDA含量测定采用硫代巴比妥酸(TBA)法[21],超氧化物歧化酶(superoxide dismutase,SOD)测定采用氮蓝四唑还原法[23],过氧化物酶(peroxidase,POD)测定采用愈创木酚法[24],过氧化氢酶(catalase,CAT)活性测定参照陈建勋等[25]的方法,采用紫外吸收法测定。
菌根侵染率测定:取新鲜须根,剪成1 cm 根段,使用10% KOH消煮后用酸性品红染色,在显微镜(100×)下观察丛枝菌根侵染状况,用方格十字交叉法计算菌根侵染率[26]。
pH值测定:采用pH计(上海精密科学仪器有限公司,雷磁pHS-3C)进行测定,水土比为5∶1。
1.4 数据处理和分析
采用Excel 2007 软件进行数据处理,SPSS 19.0软件进行方差分析。选择LSD 法进行多重比较,作图采用Origin 9.0。
2 结果与分析
2.1 生物炭和AM真菌对Cd胁迫下玉米株高和生物量的影响
由图1可知,随着镉水平的升高,各处理的玉米株高和生物量逐渐下降,尤其是在6 mg Cd·kg-1水平下,对照处理的株高和生物量比0 mg Cd·kg-1水平下分别降低20.96% 和 21.50%;在所有Cd水平下,B、M、BM处理均显著促进玉米生长(P<0.05),表现为:BM>M>B>CK,平均株高分别比对照提高10%,24%,31%(图1A),平均生物量分别比对照增加28%,52%,70%(图1B)。施用生物炭和接种AM真菌复合处理对玉米生长的促进效应最佳,0 mg Cd·kg-1水平下,施用生物炭和接种AM真菌对玉米生长的效应无显著性差异(P>0.05),在其他镉水平下接种AM真菌处理促生效果显著高于施用生物炭(P<0.05),在6 mg Cd·kg-1水平下施用生物炭和接种AM真菌对玉米生长和菌根侵染情况如图2所示。
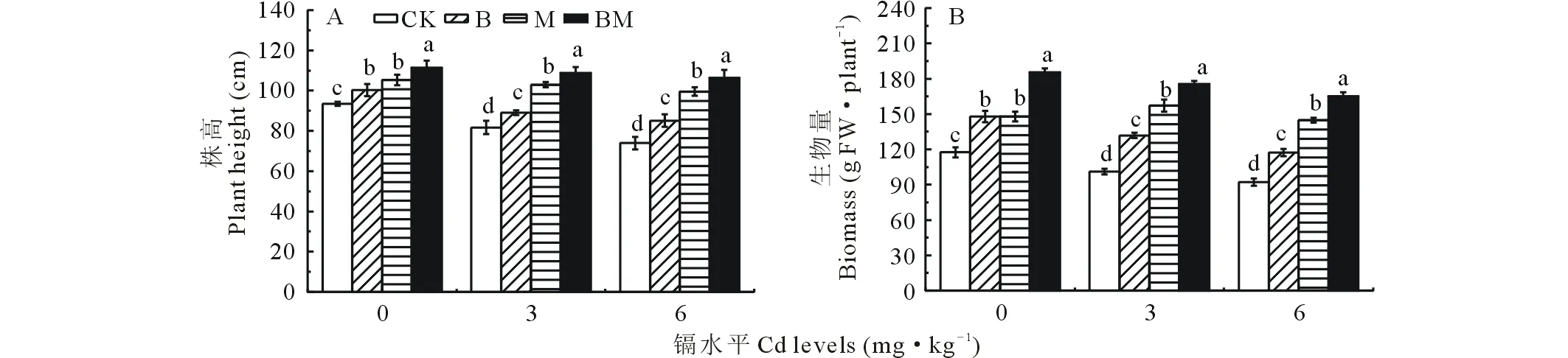
图1 生物炭和AM真菌对Cd胁迫下玉米株高和生物量的影响Fig.1 Effects of biochar and AM fungi on plant height and biomass of maize under Cd stress

图2 施用生物炭和AM真菌对Cd(6 mg·kg-1)胁迫下玉米生长和菌根侵染情况Fig.2 Effects of biochar and AM fungi on maize growth and AM colonization in maize root under Cd (6 mg·kg-1) stress
2.2 生物炭和AM真菌对Cd胁迫下玉米叶片中光合色素含量的影响
由表1可知,随着镉水平的升高,各处理的玉米叶绿素a、叶绿素b和类胡萝卜素含量均逐渐下降,尤其是在6 mg Cd·kg-1水平下,对照处理的叶绿素a、叶绿素b和类胡萝卜素比0 mg Cd·kg-1水平下分别降低29.8%,61.4%和44.6%,说明Cd胁迫下玉米叶片光合色素含量下降,抑制光合作用的正常进行。在所有Cd水平下,B、M、BM处理均显著提高玉米叶片叶绿素a、叶绿素b和类胡萝卜素含量(P<0.05),平均叶绿素a含量分别比对照提高5.6%,8.5%,12.9%,平均叶绿素b含量分别比对照增加11.01%,19.02%,31.48%,平均类胡萝卜素含量分别比对照增加12.95%,15.22%,21.65%。在所有Cd水平下,B和M处理对类胡萝卜素含量的增加没有显著性差异(P>0.05),总体看,接种AM真菌处理(M)对叶绿素a和叶绿素b含量增加优于施加生物炭处理(B),说明施用生物炭和接种AM真菌均能不同程度促进Cd胁迫下玉米叶片光合色素合成,提高玉米叶片光合色素含量,施用生物炭和接种AM真菌复合处理(BM)对玉米Cd胁迫下玉米叶片中光合色素含量增加效果最佳。
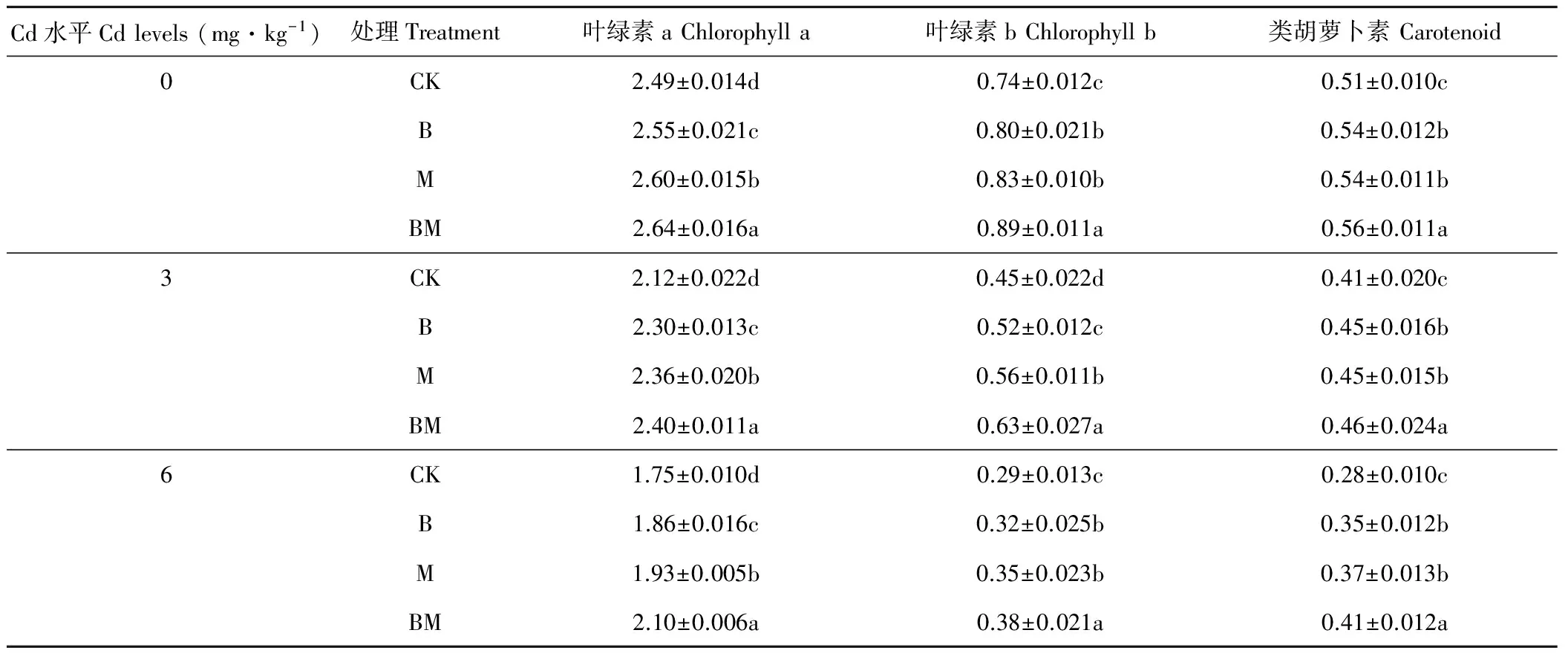
表1 生物炭和AM真菌对Cd胁迫下玉米叶片中光合色素含量的影响Table 1 Effects of biochar and AM fungi on photosynthetic pigment contents of maize leaves under Cd stress (mg·kg-1 FW)
2.3 生物炭和AM真菌对Cd胁迫下玉米叶片光合气体交换参数的影响
由图3可知,随着镉水平的升高,各处理的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)均逐渐下降,胞间CO2浓度(Ci)逐渐上升。尤其是在6 mg Cd·kg-1水平下,对照处理的Pn、Tr、Gs比0 mg Cd·kg-1水平下分别降低44.65%,53.38%和48.20%,Ci升高109.82%。表明Cd胁迫下,植物光合作用降低,CO2作用被抑制,导致CO2大量积累。在所有Cd水平下,施用生物炭、接种AM真菌、复合处理对玉米的光合特性有显著影响,B、M、BM处理均显著提高玉米叶片Pn、Tr、Gs(P<0.05),显著降低Ci(P<0.05),平均Pn分别比对照提高9.82%,15.33%,23.94%(图3A),平均Tr分别比对照提高13.68%,22.74%,31.98%(图3B),平均Gs分别比对照提高8.85%,18.15%,28.30%(图3C),平均Ci分别比对照降低7.93%,13.12%,23.46%(图3D)。总体看,在所有Cd水平下, B、M、BM处理对光合作用和CO2的同化均有不同程度的恢复作用,以施用生物炭和接种AM真菌复合处理(BM)效应最佳,接种AM真菌(M)处理对光合作用和CO2的同化恢复能力优于施加生物炭处理(B)。
2.4 生物炭和AM真菌对Cd胁迫下玉米叶片中MDA含量和抗氧化酶活性的影响
由图4可知,随着镉水平的升高,MDA含量逐渐上升,而各处理的SOD、POD、CAT含量均先升高后降低,但均高于对照,说明镉胁迫下细胞膜损伤,MDA含量大量积累,SOD、POD、CAT活性增加来清除叶片细胞的活性氧。在所有Cd水平下,B,M,BM处理明显影响玉米叶片中MDA含量和抗氧化酶活性,B、M、BM处理均显著降低MDA含量(P<0.05),提高玉米叶片SOD、POD、CAT活性(P<0.05),平均MDA含量分别比对照降低32.8%,49.9%和69.1%(图4A),平均SOD活性分别比对照提高19.8%,37.0%和54.3%(图4B),平均POD活性分别比对照提高32.4%,43.1%和83.4%(图4C),平均CAT活性分别比对照提高22.9%,29.4%和52.0%(图4D)。总体看,在所有Cd水平下,B、M、BM处理均提高Cd胁迫下玉米叶片的抗氧化酶活性,以施用生物炭和接种AM真菌复合处理(BM)效应最佳,接种AM真菌(M)处理对Cd胁迫下抗氧化酶活性的提高效果优于施加生物炭处理(B)。
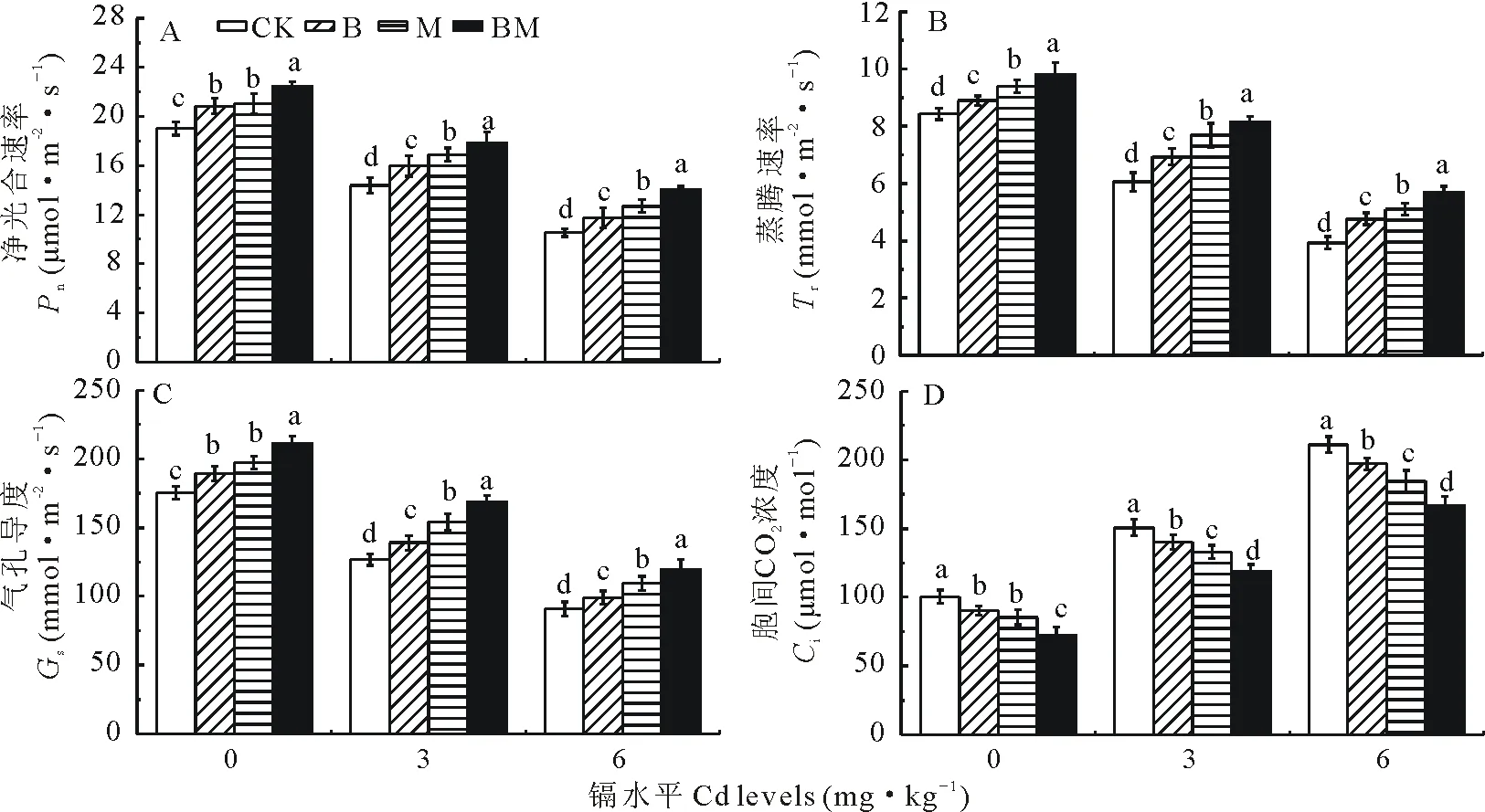
图3 生物炭和AM真菌对Cd胁迫下玉米叶片光合气体交换参数的影响Fig.3 Effects of biochar and AM fungi on photosynthetic gas exchange parameter of maize leaves under Cd stress

图4 生物炭和AM真菌对Cd胁迫下玉米叶片MDA含量和抗氧化酶活性的影响Fig.4 Effects of biochar and AM fungi on MDA concent and autioxidant enzyme activity of maize leaves under Cd stress
2.5 生物炭和AM真菌对Cd胁迫下玉米菌根侵染率和根际土壤pH的影响
由图5可知,随着镉水平的升高,各处理的菌根侵染率和根际土壤pH均逐渐下降,但根际土壤pH下降不明显。对玉米菌根侵染率而言,在6 mg Cd·kg-1水平下,对照处理玉米的菌根侵染率比0 mg Cd·kg-1水平下降低26.89%。在所有Cd水平下,M、BM处理均显著提高菌根侵染率(P<0.05),平均菌根侵染率分别提高121%和150%,B处理与对照无显著性差异(P>0.05)(图5A)。在所有Cd水平下,B、BM处理均显著提高玉米根际土壤pH(P<0.05),平均根际土壤pH值分别比对照提高8%和6%,M处理与对照无显著性差异(P>0.05)(图5B)。表明生物炭不仅能够提高土壤pH,而且能够促进菌根侵染玉米根系,AM真菌对改变土壤pH效果不明显。
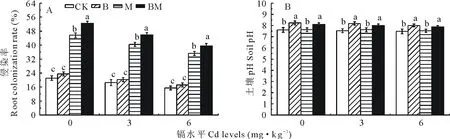
图5 生物炭和AM真菌对Cd胁迫下玉米菌根侵染率和根际pH的影响Fig.5 Effects of biochar and AM fungi on colonization rate and soil pH of maize root under Cd stress
3 讨论
Cd胁迫对玉米的生理和生化特性变化有很大影响。有研究表明AM真菌[27-28]或生物炭[29-30]单独施用均能促进Cd胁迫下玉米的生长。本研究也表明在所有Cd胁迫下,施用生物炭和接种AM真菌均促进玉米生长,有助于光合作用,但生物炭和接种AM真菌复合处理对玉米株高、生物量、光合色素和光合特性的提高效果优于单独施用生物炭或AM真菌。而株高、生物量是玉米生长的表观特征,叶片光合色素的含量与组成直接影响着植株的光合能力,光合作用是植物有机物合成的主要途径,是影响玉米生长的关键因素之一[31]。Cd胁迫诱导植物产生大量的活性氧(reactive oxygen species,ROS),导致植物叶片细胞过氧化,从而引起叶绿体亚显微结构发生破坏,光合色素合成受到影响,阻碍电子传递,影响类囊体的蛋白质合成和参与Calvin循环的酶活性,从而导致玉米叶片气孔导度下降、CO2进入气孔受阻,导致叶片蒸腾速率和光合速率下降,使光合作用等生理过程发生紊乱,从而降低植物器官的株高和生物量,抑制植株的生长[19,32]。施用生物炭和接种AM真菌复合处理对促进Cd胁迫下玉米生长和光合特性的提高效应最佳,这可能是因为生物炭的多孔结构和富有的矿质营养不仅能够为玉米保水保肥,提供良好的土壤环境[33],还能够促进AM真菌繁殖[18],而且AM真菌能够改善土壤环境,吸收植物可吸收利用的矿质营养(特别是磷,P)转移到植物体内,缓解叶绿素的分解[34]。本研究表明生物炭与AM真菌在植物生长和光合特性方面具有协同效应,这与Hu等[35]的研究中生物炭和AM真菌促进Cd胁迫下空心菜(Ipomoeaaquatica)和东南景天(Sedumalfredii)间作系统中植物生长,刘先良等[36]的研究中生物炭和AM真菌促进烤烟(Nicotiana)生长研究结果一致。
Cd胁迫下植物体内自由基的增多造成细胞膜系统的损伤而造成氧化胁迫,MDA作为细胞膜脂过氧化的主要产物,其含量多少常用作评价细胞膜损伤程度的标准[3,22]。植物在逆境下会产生一系列的应对机制,SOD、POD和CAT是植物体内ROS清除系统的保护酶,它们协同作用可以防御活性氧自由基对细胞膜的伤害,抑制膜脂过氧化,减轻胁迫对植物细胞造成的伤害[37]。本研究表明,随着Cd水平的升高,MDA含量逐渐升高,SOD、POD和CAT活性先升高后降低,但均高于0 Cd mg·kg-1水平下。这与王芳等[3]的研究在镉胁迫下玉米抗氧化酶活性低于对照的研究结果不同,可能是因为施加的Cd浓度水平不同,本研究中Cd浓度较低,玉米受到胁迫后,植物体的应激反应导致抗氧化酶活性升高来清除活性氧保持一个较低水平,随着Cd胁迫的增加,抗氧化酶活性会降低。施用生物炭和接种AM真菌均能缓解Cd胁迫,降低MDA含量,提高SOD、POD和CAT活性,但施用生物炭和接种AM真菌复合处理对提高玉米的抗氧化能力效果优于单独施用生物炭或AM真菌。这可能是因为AM真菌的根外菌丝、孢子,根内菌丝、囊泡结构[38]和生物炭的碱化作用、阳离子交换能力、多孔结构[39]都能够降低重金属的有效性,提高植物的抗性,而生物炭的多孔结构还能够为AM真菌定植提供良好的条件,改善AM真菌的群落结构,而AM真菌又可能促进生物炭固持的养分释放[40]。生物炭能够促进AM真菌生长,可能是因为生物炭改善土壤物理特性来促进AM真菌生长,同时促进微生物(如P增溶细菌)与AM真菌相互作用,诱导植物与真菌之间的化合物信号反应,从而影响孢子萌发和菌丝的分支[41-42]。因此,在Cd胁迫下同时施加AM真菌和生物炭能够使植物生长和抵抗重金属胁迫效果最佳。
本研究中施用生物炭和接种AM真菌对玉米生长、光合特性和抗氧化性的影响效应不同。总体来看,AM真菌对促进植物的生长和提高抗氧化能力的效果优于生物炭,这可能是因为生物炭本身的矿质营养较少,而主要通过碱化土壤降低重金属活性和其特殊结构吸附重金属Cd,改善土壤理化性质,从而提高植物的生长和抗氧化能力[43],而AM真菌不仅能够固持重金属,提高植物的耐性,减少植物对重金属的吸收,还能够促进植物对营养元素的吸收,产生“稀释”效应,降低Cd浓度[34,44]。另外,AM真菌分泌物,多磷酸,有机酸和球囊霉素等不仅能够在植物-菌丝界面与Cd离子结合来固定重金属,而且球囊霉素能够提高土壤团聚体稳定性,改善土壤理化性质,从而促进植物生长[38,45]。本研究也发现施加生物炭能够提高土壤pH,接种AM真菌能够显著提高玉米根侵染率(图5),进一步证明了生物炭能够改变土壤pH来降低重金属活性,AM真菌能够提高植物耐性,促进植物生长。而施用生物炭和接种AM真菌结合对植物抵抗重金属胁迫具有协同作用,对植物生长、光合特性和抗氧化活性的提高效应最佳。
4 结论
综上所述,Cd胁迫使玉米的株高、生物量、光合色素、净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)降低,胞间CO2浓度(Ci)、MDA含量增加,而抗氧化酶活性先升高后降低,表明Cd胁迫干扰玉米的正常发育。施用生物炭和AM真菌均能提高玉米的株高、生物量、光合色素、净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、抗氧化酶活性,降低胞间CO2浓度(Ci)、MDA含量。施用生物炭和接种AM真菌结合能够对植物生长、光合特性、抗氧化酶活性和菌根侵染率、土壤pH的提高效应最佳。然而,施用生物炭和接种AM真菌对玉米植株Cd含量效应及其机理和在田间生产修复的效应,仍需要进一步探究。
参考文献References:
[1] Yi Y J,Yang Z F, Zhang S H. Ecological risk assessment of heavy metals in sediment and human health risk assessment of heavy metals in fishes in the middle and lower reaches of the Yangtze River basin. Environmental Pollution, 2011, 159(10): 2575-2585.
[2] Liu L, Hu L L, Tang J J,etal. Food safety assessment of planting patterns of four vegetable-type crops grown in soil contaminated by electronic waste activities. Journal of Environmental Management, 2012, 93(1): 22-30.
[3] Wang F, Chang P P, Chen Y P,etal. Effect of exogenous nitric oxide on seedling growth and physiological characteristics of maize seedlings under cadmium stress. Acta Prataculturae Sinica, 2013, 22(2): 178-186.
王芳, 常盼盼, 陈永平, 等. 外源NO对镉胁迫下玉米幼苗生长和生理特性的影响. 草业学报, 2013, 22(2): 178-186.
[4] Liu L, Zhang Q, Hu L L,etal. Legumes can increase cadmium contamination in neighboring crops. Plos One, 2012, 7(8): e42944.
[5] Fu F L, Wang Q. Removal of heavy metal ions from wastewaters: a review. Journal of Environmental Management, 2011, 92(3): 407-418.
[6] Solísdomínguez F A, Valentínvargas A, Chorover J,etal. Effect of arbuscular mycorrhizal fungi on plant biomass and the rhizosphere microbial community structure of mesquite grown in acidic lead/zinc mine tailings. Science of the Total Environment, 2011, 409(6): 1009-1016.
[7] Wu Q S, Yuan F Y, Fei Y J,etal. Effects of arbuscular mycorrhizal fungi on aggregate stability, GRSP and carbohydrates of white clover. Acta Prataculturae Sinica, 2014, 23(4): 269-275.
吴强盛, 袁芳英, 费永俊, 等. 菌根真菌对白三叶根际团聚体稳定性、球囊霉素相关土壤蛋白和糖类物质的影响. 草业学报, 2014, 23(4): 269-275.
[8] Ogar A, Sobczyk, Turnau K. Effect of combined microbes on plant tolerance to Zn-Pb contaminations. Environmental Science & Pollution Research, 2015, 22(23): 19142-19156.
[9] Yang Y R, Liang Y, Ghosh A,etal. Assessment of arbuscular mycorrhizal fungi status and heavy metal accumulation characteristics of tree species in a lead-zinc mine area: potential applications for phytoremediation. Environmental Science & Pollution Research, 2015, 22(17): 13179-13193.
[10] Nguyen B T, Lehmann J, Kinyangi J,etal. Long-term black carbon dynamics in cultivated soil. Biogeochemistry, 2008, 89(3): 295-308.
[11] Ahmad M, Rajapaksha A U, Lim J E,etal. Biochar as a sorbent for contaminant management in soil and water: a review. Chemosphere, 2014, 99(3): 19-33.
[12] Hossain M K, Strezov V, Chan K Y,etal. Agronomic properties of wastewater sludge biochar and bioavailability of metals in production of cherry tomato (Lycopersiconesculentum). Chemosphere, 2010, 78(9): 1167-1171.
[13] Zhang X H, Li Z L, Li Y,etal. Effect of biochar amendment on purple and yellow soil. Acta Prataculturae Sinica, 2017, 26(4): 63-72.
张旭辉, 李治玲, 李勇, 等. 施用生物炭对西南地区紫色土和黄壤的作用效果. 草业学报, 2017, 26(4): 63-72.
[14] Liu L, Wang Y F, Song J Y,etal. Effects of biochar addition combined with reducing nitrogen application rate on growth of flue-cured tobacco and soil enzyme activities. Journal of Henan Agricultural Sciences, 2016, 45(2): 62-66.
刘领, 王艳芳, 宋久洋, 等. 生物炭与氮肥减量配施对烤烟生长及土壤酶活性的影响. 河南农业科学, 2016, 45(2): 62-66.
[15] Atkinson C J, Fitzgerald J D, Hipps N A. Potential mechanisms for achieving agricultural benefits from biochar application to temperate soils: a review. Plant & Soil, 2010, 337(1/2): 1-18.
[16] Kim K, Yim W, Trivedi P,etal. Synergistic effects of inoculating arbuscular mycorrhizal fungi and Methylobacterium oryzae strains on growth and nutrient uptake of red pepper (CapsicumannuumL.). Plant & Soil, 2010, 327(1/2): 429-440.
[17] Hammer E C, Balogh-Brunstad Z, Jakobsen I,etal. A mycorrhizal fungus grows on biochar and captures phosphorus from its surfaces. Soil Biology & Biochemistry, 2014, 77(7): 252-260.
[18] Hammer E C, Forstreuter M, Rillig M C,etal. Biochar increases arbuscular mycorrhizal plant growth enhancement and ameliorates salinity stress. Applied Soil Ecology, 2015, 96(3): 114-121.
[19] Wang Y P, Chang H, Li C,etal. Effects of exogenous Ca2+on growth, photosynthetic characteristics and photosystem II function of maize seedlings under cadmium stress. Acta Prataculturae Sinica, 2016, 25(5): 40-48.
王玉萍, 常宏, 李成, 等. Ca2+对镉胁迫下玉米幼苗生长、光合特征和PSⅡ功能的影响. 草业学报, 2016, 25(5): 40-48.
[20] Cao J L, Feng Y Z, He S Y,etal. Silver nanoparticles deteriorate the mutual interaction between maize (ZeamaysL.) and arbuscular mycorrhizal fungi: a soil microcosm study. Applied Soil Ecology, 2017, 119: 307-316.
[21] Zhang S Q, Li Y. Plant physiology experiment technology tutorials. Beijing: Science Press, 2011.
张蜀秋, 李云. 植物生理学实验技术教程. 北京: 科学出版社, 2011.
[22] Liu L, Li J W, Chang Q Q,etal. Effects ofBrassicaextracts on occurrence of black shank disease and physiological characteristics of flue-cured tobacco. Plant Physiology Journal, 2017, 53(6): 997-1006.
刘领, 李继伟, 常茜茜, 等. 芸薹属植物提取液对烤烟黑胫病发生及烟株生理特性的影响. 植物生理学报, 2017, 53(6): 997-1006.
[23] Rao K V M, Sresty T V S. Antioxidative parameters in the seedlings of pigeonpea (Cajanuscajan(L.) Millspaugh) in response to Zn and Ni stresses. Plant Science, 2000, 157(1): 113-128.
[24] Ghosh M, Singh S P. A comparative study of cadmium phytoextraction by accumulator and weed species. Environmental Pollution, 2005, 133(2): 365-371.
[25] Chen J X, Wang X F. Experimental guide of physiology of plant. 2nd. Guangzhou: South China Science and Technology University Press, 2006.
陈建勋, 王晓峰. 植物生理学实验指导. 第2版. 广州: 华南理工大学出版社, 2006.
[26] Giovannetti M, Mosse B. Evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist, 1980, 84(3): 489-500.
[27] Liu L Z, Gong Z Q, Zhang Y L,etal. Growth, cadmium uptake and accumulation of maize (ZeamaysL.) under the effects of arbuscular mycorrhizal fungi. Ecotoxicology, 2014, 23(10): 1979-1986.
[28] Malekzadeh E, Alikhani H A, Savaghebi-Firoozabadi G R,etal. Influence of arbuscular mycorrhizal fungi and an improving growth bacterium on Cd uptake and maize growth in Cd-polluted soils. Spanish Journal of Agricultural Research, 2011, 9(4): 1213-1223.
[29] Sujana I P, Lanya I, Subadiyasa I N N,etal. The effect of dose biochar and organic matters on soil characteristic and corn plants growth on the land degraded by garment liquid waste. Journal of Biology Agriculture & Healthcare, 2014, 4(5): 77-78.
[30] Zhang H W, Zhen H Y, Yue S Z,etal. Bioavailability of Cd in contaminated soil after short-term application of rice straw biochar. Ecology and Environment Sciences, 2017, 26(6): 1068-1074.
张华纬, 甄华杨, 岳士忠, 等. 水稻秸秆生物炭对污染土壤中镉生物有效性的影响. 生态环境学报, 2017, 26(6): 1068-1074.
[31] Zhang X N, Zhao X Q, Wang Z Q,etal. Protective effects of hydrogen-rich water on the photosynthetic apparatus of maize seedlings (ZeamaysL.) as a result of an increase in antioxidant enzyme activities under high light stress. Plant Growth Regulation, 2015, 77(1): 43-56.
[32] Bhaduri A M, Fulekar M H. Antioxidant enzyme responses of plants to heavy metal stress. Reviews in Environmental Science & Bio/technology, 2012, 11(1): 55-69.
[33] Manyà J J. Pyrolysis for biochar purposes: a review to establish current knowledge gaps and research needs. Environmental Science & Technology, 2012, 46(15): 7939-7954.
[34] Wang F Y, Shi Z Y, Xu X F,etal. Contribution of AM inoculation and cattle manure to lead and cadmium phytoremediation by tobacco plants. Environmental Science Processes & Impacts, 2013, 15(4): 794-801.
[35] Hu J, Wu F, Wu S,etal.Biochar andGlomuscaledoniuminfluence Cd accumulation of upland kangkong (IpomoeaaquaticaForsk.) intercropped with Alfred stonecrop (SedumalfrediiHance). Scientific Reports, 2014, 4(4): 4671.
[36] Liu X L, Zhang C, Deng M,etal. Effects of biochar and AM fungi on root morphology, physiological characteristics and chemical constituents of flue-cured tobacco. Tobacco Science & Technology, 2017, 50(8): 30-36.
刘先良, 张春, 邓茂, 等. 施用生物炭和AM真菌对烤烟根系形态、生理特性及化学成分的影响. 烟草科技, 2017, 50(8): 30-36.
[37] Pereira P, Ibáez S G, Agostini E,etal. Effects of maize inoculation withFusariumverticillioidesand with two bacterial biocontrol agents on seedlings growth and antioxidative enzymatic activities. Applied Soil Ecology, 2011, 51(6): 52-59.
[38] Wang F Y, Liu X Q, Shi Z Y,etal. Arbuscular mycorrhizae alleviate negative effects of zinc oxide nanoparticle and zinc accumulation in maize plants—A soil microcosm experiment. Chemosphere, 2016, 147: 88-97.
[39] Xu X Y, Cao X D, Zhao L. Comparison of rice husk- and dairy manure-derived biochars for simultaneously removing heavy metals from aqueous solutions: Role of mineral components in biochars. Chemosphere, 2013, 92(8): 955-961.
[40] Zwetsloot M J, Lehmann J, Bauerle T,etal. Phosphorus availability from bone char in a P-fixing soil influenced by root-mycorrhizae-biochar interactions. Plant & Soil, 2016, 408(1/2): 1-11.
[41] Liu L, Wang Y F, Yan X W,etal. Biochar amendments increase the yield advantage of legume-based intercropping systems over monoculture. Agriculture Ecosystems & Environment, 2017, 237: 16-23.
[42] Vanek S J, Lehmann J. Phosphorus availability to beans via interactions between mycorrhizas and biochar. Plant & Soil, 2015, 395(1/2): 105-123.
[43] Woolf D, Amonette J E, Street-Perrott F A,etal. Sustainable biochar to mitigate global climate change. Nature Communications, 2010, 1(5): 56.
[44] Wang F Y, Lin X G, Yin R. Heavy metal uptake by arbuscular mycorrhizas ofElsholtziasplendensand the potential for phytoremediation of contaminated soil. Plant & Soil, 2005, 269(1/2): 225-232.
[45] Alguacil M M, Torrecillas E, Caravaca F,etal. The application of an organic amendment modifies the arbuscular mycorrhizal fungal communities colonizing native seedlings grown in a heavy-metal-polluted soil. Soil Biology & Biochemistry, 2011, 43(7): 1498-1508.
