农大7号欧李叶片愈伤组织的诱导和增殖
2018-05-18武莎莎杜俊杰王鹏飞张建成穆霄鹏傅鸿博
武莎莎,张 彬,杜俊杰,王鹏飞,张建成,穆霄鹏,傅鸿博
(山西农业大学园艺学院,山西太谷030801)
欧李(Cerasus humilisBge.)又名钙果,为蔷薇科樱桃属[1],是我国特有的一种优良灌木果树,分布于我国的黑龙江、辽宁、内蒙古、河北、山东、山西等省区,多生长在向阳山坡或沙丘边缘,资源相当丰富[2]。其耐寒、耐旱、耐瘠薄,固土保水作用强,山西省已将其列为经济林木树种[3]。欧李果实含有糖、蛋白质、维生素和各种矿质元素及抗氧化等人体营养和保健活性物质[4]。随着果树转基因研究的不断深入,其基因功能的验证要求能在大多数的木本果树本身或类似的果树上进行,但多数木本果树结果晚、体积大、验证时间长、成本高。
欧李具有结果早、树体小的特点,作为木本果树的基因功能验证模式植物优势明显。农大7号品种是新选育的一个鲜食欧李品种,其外观漂亮、香味浓郁、酸甜适口,且结果早、丰产性强[5],但若要作为转基因功能验证的模式品种,必须首先建立其高效再生体系。尽管近年来欧李再生体系的研究已有报道[6-9],但再生体系因品种其差异较大。
本研究以欧李农大7号为材料,探讨其愈伤组织建立的技术,旨在为欧李高效再生体系的建立提供理论基础。
1 材料和方法
1.1 试验材料
供试材料取自山西农业大学欧李资源圃农大7号品种当年生枝条中上部平展无病害叶片。
1.2 试验方法
1.2.1 外植体处理 将剪下的叶片放在流动水下冲洗30 min,用洗洁精清洗3~5 min,之后用清水冲洗至无泡沫为止。在无菌条件下,将材料用0.1%升汞消毒9 min,再用75%酒精消毒15 s,然后用灭好菌的无菌蒸馏水冲洗3~5次,最后用无菌滤纸擦干。将叶片去掉叶边缘及叶柄,剪成长宽为1 cm大小方块,近轴端接触培养基。
1.2.2 单因素 NAA,2,4-D对愈伤组织的诱导试验
生长素 NAA 设 0.5,0.8,1.2 mg/L 等 3 个质量浓度,2,4-D 设 0.5,0.8,1.0,1.2,1.5 mg/L 等 5 个质量浓度,在MS培养基中进行培养。
1.2.3 多因素NAA,6-BA在不同培养基中对愈伤组织的诱导试验 选MS,1/2 MS和改良MS这3种培养基作为基本培养基,其中,改良MS培养基为在MS培养基基础上钙盐、铁盐含量各增加了25%,生长素 NAA 质量浓度设为 0.4,0.8,1.2 mg/L,6-BA设0.5,1.0,1.5 mg/L,按正交试验L9(33)进行处理设计。
1.2.4 多因素NAA,TDZ在MS培养基中对愈伤组织的诱导试验 生长素 NAA 设 0.2,0.5,0.8 mg/L等 3 个质量浓度,分裂素 TDZ设 1.5,3.5,5.5 mg/L等3个质量浓度进行完全交叉试验,在MS培养基中进行培养。
1.2.5 愈伤组织增殖试验 将培养25~30 d、大小为0.3~0.5 cm3的愈伤组织分别转接到单因素培养基和多因素培养基上进行增殖试验。其中,单因素为 MS+2,4-D,2,4-D质量浓度设为 0.6,0.8,1.0,1.2 mg/L;多因素为 MS+2,4-D+6-BA,其中,2,4-D 质量浓度设为 0.6,0.8,1.0,1.2 mg/L,6-BA质量浓度设为 0.2,0.5mg/L,进行交叉试验。培养 30d后观察愈伤增殖情况。
培养基 pH 值为 5.8~6.0、蔗糖 30 g/L、琼脂6.5 g/L。外植体接种后先暗培养10 d,后再在光下培养,30 d后观察统计结果。培养条件(25±1)℃,光暗周期18 h/6 h,光照强度2 000~3 000 lx。

1.3 数据分析
采用SAS统计分析软件包对试验观测到的数据进行方差分析、多重比较。
2 结果与分析
2.1 单因素NAA,2,4-D对愈伤组织诱导的影响
从表1可以看出,单因素NAA,2,4-D均有较高诱导率,2,4-D的诱导率整体上高于 NAA;2,4-D诱导的愈伤组织时间快,颜色呈黄白状,质量浓度0.8 mg/L相对较好(图1);NAA诱导的愈伤组织呈绿色,质地疏松,质量浓度0.5 mg/L相对较好。整体得出,单因素诱导愈伤组织试验中,以MS+0.8 mg/L 效果最好。
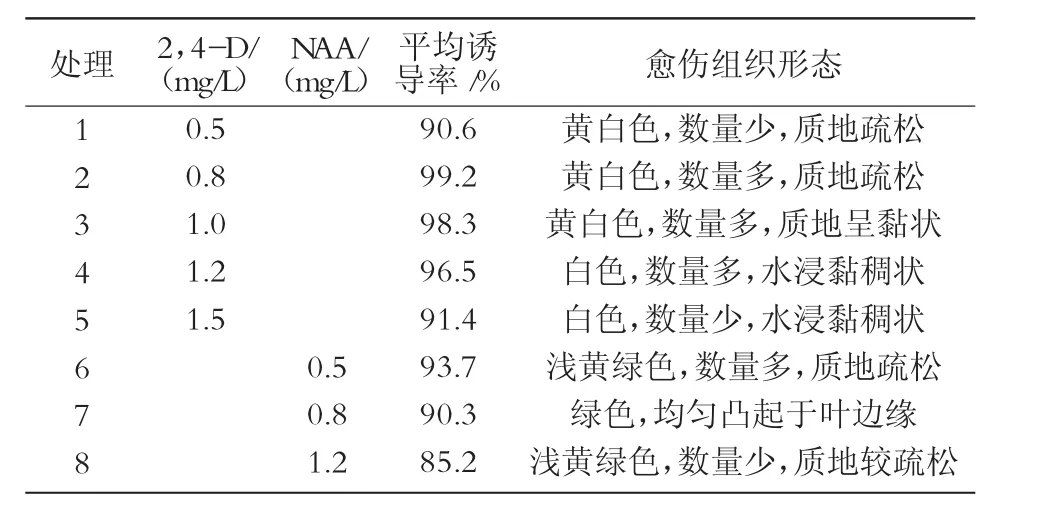
表1 单因素对愈伤组织的诱导

2.2 多因素NAA,6-BA在不同培养基中对愈伤组织诱导的影响
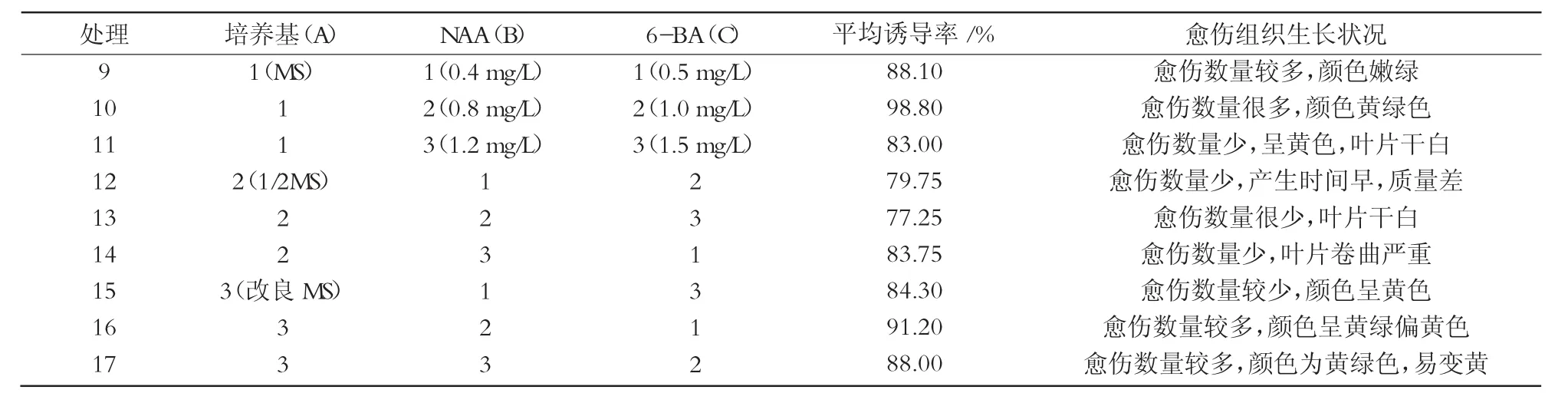
表2 多因素NAA,6-BA在不同培养基中对愈伤组织的诱导
叶片接种3 d后开始微微隆起,7 d左右主叶 脉伤口处膨大,10 d左右有小颗粒状愈伤组织出现,20~30 d有大量愈伤组织产生。1/2 MS培养基中产生愈伤时间最早,其次依次为MS和改良MS,但是1/2 MS诱导的愈伤疏松,易老化。MS、改良MS产生的愈伤呈黄绿、嫩绿色,质地紧密。30 d统计愈伤组织诱导率,结果列于表2。对数据进行方差分析和差异性显著比较,结果如表3,4所示。

表3 方差分析结果

表4 单因素多重比较 %
由表3,4可知,农大7号欧李品种在叶片愈伤组织诱导时,B因素NAA对愈伤组织诱导率的影响达显著水平,A因素(培养基)和C因素(6-BA)对愈伤组织诱导率的影响均达到极显著水平,说明3个因素均有重要作用,同时各因素的主次关系为A>C>B。对A因素进行多重比较表明,A1极显著高于A2和A3,因此,A1即MS培养基对欧李叶片愈伤组织诱导效果最好;生长素B2极显著高于B3和B1,即NAA质量浓度0.8 mg/L效果最好;C2和C1极显著高于C3,且C2又显著高于C1,因此,C2即6-BA 1.0 mg/L的效果最好。通过分析以及表型观察得出,农大7号叶片愈伤组织诱导以MS+NAA 0.8 mg/L+6-BA 1.0 mg/L 组合最好(图 2)。


表5 多因素NAA,TDZ在MS培养基中对愈伤组织的诱导

从表5可以看出,NAA和TDZ诱导的愈伤组织整体呈绿色,质地偏硬、脆,最适培养基为NAA 0.5 mg/L+TDZ3.5 mg/L,诱导率达到 98.3%(图 3)。
2.4 MS培养基下不同生长调节剂对愈伤组织增殖的影响
从表6可以看出,单一添加2,4-D增殖愈伤组织中以质量浓度0.8 mg/L效果最好,过高或过低都不利于增殖和质地的优化。同时添加2,4-D和6-BA增殖愈伤组织中,高质量浓度2,4-D和低质量浓度6-BA下增殖的愈伤组织偏黄、质地疏松,而在低质量浓度2,4-D和高质量浓度6-BA下增殖的愈伤组织偏绿且质地紧密。本试验中,MS+6-BA0.2mg/L+ 2,4-D0.6 mg/L为最佳愈伤组织增殖培养基。

表6 欧李农大7号愈伤组织增殖情况
3 讨论
愈伤组织具有高度再分化的能力,经过长期继代保存而不丧失其胚性并且具有旺盛的自我增殖能力,可用于建立大规模的愈伤组织无性系,通过愈伤组织的再分化建立高频率植株再生体系,进而为通过遗传转化改良品种奠定基础[10]。愈伤组织的形成过程受植物基因型、外植体类型及理化状态、培养基成分、光照条件、糖源浓度等诸多因素相互作用的影响[11]。培养基种类以及生长调节剂又是主导因素[12]。因此,本试验通过不同培养基、不同生长调节剂和浓度来筛选农大7号愈伤组织的最适培养条件,为以后欧李分子机制、遗传转化和种质资源保存奠定基础。
愈伤组织的诱导和培养是内源激素和外源激素共同作用的结果,通过附加外源激素可以调节总的激素水平,从而完成由外植体脱分化形成愈伤组织的过程[13]。植物愈伤组织培养过程中,植物基因型、培养基及激素配比等为主要因素[14]。植物组织培养中,不同植物的遗传特性、生物学特性都不同,因而,适宜物种组织生长的营养条件也会有所不同,甚至同一植物的不同部位、同一部位的不同生长时期对营养的要求也会有所变化[15]。因此,在组培过程中首先需要选择一个最适培养基。
刘琳[16]用 MS,N6,B5,WPM这 4 种培养基进行对比试验,结果表明,MS和B5都可作为钙果微体快繁的培养基,但使用B5培养基,试管苗易出现黄化现象,故基本培养基用MS。本试验进一步证明,叶片诱导愈伤组织质量最好的为MS培养基。杜研[17]研究发现,在愈伤组织诱导中,MS+KT0.3 mg/L+NAA 0.5 mg/L培养基中,农大3号叶片愈伤组织的诱导率达到97.8%。本试验中,单因素 2,4-D0.8mg/L诱导产生的愈伤组织时间早、数量多;多因素MS+NAA 0.8 mg/L+6-BA 1.0 mg/L 诱导的愈伤组织效果好,但是当2,4-D质量浓度高于1.0 mg/L时,愈伤组织数量少,形态呈水渍黏状。在只添加2,4-D的诱导培养基上生长的愈伤组织比较松软,呈黏液化和泡状,一般不易分化,且再生频率很低[18],本试验虽然证明了单用2,4-D也能产生较好的愈伤组织,但在欧李树种上应进一步进行验证。本试验添加6-BA的培养基诱导出的愈伤组织呈黄绿色、质地疏松,但是高质量浓度的6-BA(超过2.0 mg/L)会抑止愈伤组织增殖,愈伤组织在后期会发生严重褐化,是否褐化作为植物组培能否成功的关键因子之一[19],在试验中应避免材料发生褐化。本试验中,褐化原因可能是由于欧李作为一种灌木果树,本身分生能力较强,因此,欧李不需要高浓度分裂素。TDZ分裂能力较强,在添加TDZ的培养基诱导出的愈伤组织颜色偏深绿,质地较硬。姚婷等[8]研究表明,离体叶片不定芽再生的最适植物生长调节剂组合为改良 MS+TDZ4.0 mg/L+IBA 0.2 mg/L,再生率达到63.1%,且超过20 d时就可产生不定芽,本试验也曾使用了该配比,但未得到不定芽,可能是由材料的不同所引起的。
在愈伤组织诱导增殖过程中,生长素和分裂素种类及浓度都起着举足轻重的作用。在合适的浓度下,使用2,4-D诱导增殖愈伤组织数量多、速度快、质地稳定,因此,可用于材料的保存;6-BA和生长素NAA或2,4-D结合的愈伤组织质地颜色可以进一步用于不定芽的再生。TDZ分裂能力最强,但是没有6-BA稳定。
参考文献:
[1]俞德浚.中国果树分类学[M].北京:农业出版社,1982:63-77.
[2]丁伟,杜俊杰,王鹏飞,等.黄土丘陵沟壑区不同立地类型欧李生长差异分析[J].山西农业科学,2017,45(5):764-768.
[3]陈赫男.砂石山区优良水土保持先锋树种欧李引种及其效益研究[D].泰安:山东农业大学,2007.
[4]朱华.欧李果酒的初步研究[J].酿酒科技,2004(4):97-98.
[5]王鹏飞,曹琴,杜俊杰,等.鲜食欧李新品种‘农大7号’[J].园艺学报,2013,40(1):181-182.
[6]肖远志,黄国林,张平.新技术在观赏植物组织培养中的应用[J].湖南农业科学,2013(15):20-22.
[7] WANG R F,HUANG F L,ZHANG J,et al.Establishment of a high-frequency regeneration system in Cerasus humilis,an important economic shrub[J].Forest Research,2016,21(5):244-250.
[8]姚婷,张开春,闫国华,等.欧李离体叶片再生体系的建立[J].果树学报,2012,29(4):589-592,713.
[9]李劲,蒋泽平,梁珍海.优系欧李茎叶愈伤组织诱导与植株再生[J].江苏林业科技,2006(1):12-15.
[10]郭晓博,张晓丽,李俊华,等.山药愈伤组织研究进展[J].北方园艺,2014(24):183-186.
[11]崔凯荣,戴若兰.植物体细胞胚发生的分子生物学[M].北京:科学出版社,2000:329-397.
[12]张海龙,刘艳军,黄俊轩,等.影响冰灯玉露组培苗形态建成因子的研究[J].天津农业科学,2017,23(7):17-20.
[13]高兵.“嘎拉”苹果叶片愈伤组织的诱导 [J].北方园艺,2017(9):88-92.
[14]孙瑞芬,李天然,李堃,等.草莓组培快繁及叶片诱导植株再生的研究[J].华北农学报,2002,17(4):49-53.
[15]GELLA R,ERREA P.Application of in vitro therapy for ilarvirus elimination in three Prunus species[J].Journal of Phtopathology,1998,146(8):445-449.
[16]刘琳.钙果初代组织培养技术研究[J].安徽农业科学,2005,33(2):247.
[17]杜研.钙果组织培养关键技术的研究 [D].兰州:甘肃农业大学,2007.
[18]李代丽,康向阳.植物愈伤组织培养中内外源激素效应的研究现状与展望[J].生物技术通讯,2007(3):546-548.
[19]刘艺平,王政,牛佳佳,等.不同糖源及蔗糖质量浓度对牡丹愈伤组织褐化的影响[J].河南农业科学,2013,42(3):103-106.
