谷子种子DNA快速提取新方法
2018-05-18王艳梅郝建平王陆军王创云李培良邓艳芳李志敏董永军张婷婷裴成成牛学谦
庞 冰 ,王艳梅 ,郝建平 ,,王陆军 ,王创云 ,李培良 ,邓艳芳,周 琼,李志敏,董永军,张婷婷,裴成成,牛学谦
(1.山西大学生命科学学院,山西太原030006;2.山西省农业科学院作物科学研究所,山西太原030031;3.山西省玉米工程技术研究中心,山西太原030031;4.山西省农业科学院农业科技信息研究所,山西太原030031)
DNA作为分子试验的基础,其质量的好坏决定着试验的成功与否[1]。随着SSR,SNP和基因测序等高通量生物技术的发展,农作物研究需要检测的样本量显著增加,所以,能够在短时间内快速地提取大量高质量样本的DNA,是提高分子试验效率的有效手段[2-4]。
当前,谷子DNA提取的主要方法包括SDS(十二烷基磺酸钠)法、CTAB(十六烷基三乙基溴化铵)法和高盐提取法等[5-7]。但这几种提取方法均以植物幼叶为材料,需经过3~7 d的发芽期,需要进行液氮研磨,水浴、异丙醇沉淀耗时较长,批量核酸提取工作量繁重[8-10]。
本试验旨在探究直接以谷子种子为材料提取DNA的方法,简化操作流程,缩短提取周期,为谷子高通量分子检测奠定基础。
1 材料和方法
1.1 材料
山西省主要谷子种质资源及常规品种如表1所示。

表1 10份材料名称及地理来源
1.2 试剂及主要仪器设备
2%的CTAB分离缓冲液;0.5 mol/L的EDTA;1 mol/L的 Tris-HCl;β-巯基乙醇;TE 缓冲液;氯仿 /异戊醇(24∶1);异丙醇;琼脂糖;TAE 缓冲液;乙醇(70%);GelStain。
高速冷冻离心机(Eppendorf 5810R);PCR仪(eppendorf);微量紫外分光光度计(北京凯奥5600);电泳仪(北京君意东方JUNYI3000E)。
1.3 试验方法
1.3.1 谷子基因组DNA提取 取种子0.1 g或幼叶50 mg,机械粉碎;加入 800 μL CTAB 提取液,65 ℃水浴15 min,期间不定期摇匀;加入等体积氯仿/异戊醇,混匀3 min,以12 000 r/min离心5 min,取上清,重复2次;加入0.8倍体积的异丙醇(-20℃预冷),置于-20℃放置5 min;取出后12 000 r/min离心1 min,弃上清;加入500 μL的70%乙醇,摇匀;小心将酒精倒出,自然风干后加入50 μL含RNase的TE缓冲液,保存备用。
1.3.2 DNA质量检测 采用0.8%琼脂糖进行电泳检测;采用紫外分光光度计测定A260/280值及其质量浓度。
1.3.3 SSR-PCR检测 引物名称为 SiGMS462,正向序列:AGGCCCAGTTTAAATGCAAG;反向序列CTAGGAAGCATCATCCTCCG。反应体系(20 μL):DNA模板60ng;10×Buffer(含MgCl2)2μL;2.5mmol/L dNTPs 1 μL;10 mmol/L 引物各 0.5 μL;2.5 U/μL Taq酶 0.1 μL;ddH2O12.9 μL。反应条件:94 ℃ 5 min;94℃30 s,52℃40 s,72℃ 1 min,循环 35次;72℃延伸10 min。采用0.8%琼脂糖进行电泳检测,120 V电泳45 min。
2 结果与分析
2.1 谷子基因组DNA的纯度与质量浓度分析
采用新方法提取的幼叶DNA质量浓度比种子高,但个体差异较大,最高可达 4 671.88 ng/μL,最低为 2 530.51 ng/μL,总体趋势不稳定;新方法提取的种子DNA总体趋势相对稳定,基本都在2 000~3 000 ng/μL(图1、表2)。采用新方法提取的种子和幼叶的核酸,A260/280值均处于 1.8~2.0(图 2);经过琼脂糖电泳检测,结果显示,所得条带清晰,一致度高,无拖尾现象,DNA完整性较好(图3)。说明使用新方法提取的种子DNA质量与幼叶一致,无明显差异。
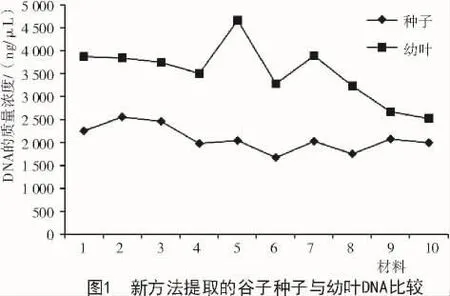
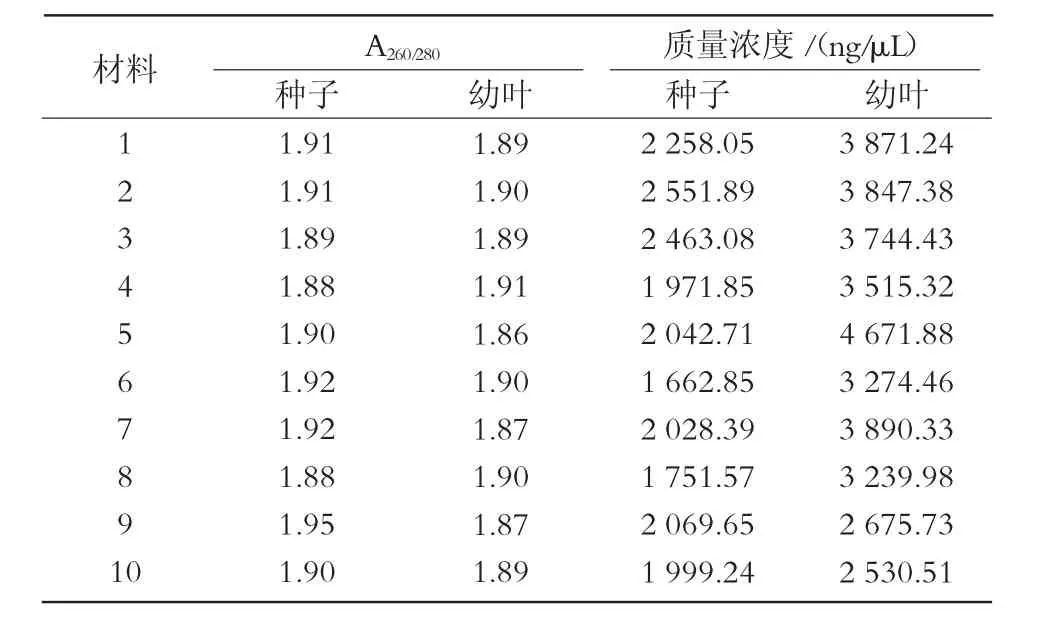
表2 谷子种子与幼叶基因组DNA紫外分光光度计检测结果

2.2SSR-PCR 验证效果
为验证新方法提取的DNA能否用于SSR分子标记试验,采用SSR引物SiGMS462对所提取的谷子核酸进行扩增。从图4可以看出,扩增产物的电泳条带清晰,多态性显著。表明新方法提取的DNA能够满足SSR等分子标记检测对DNA质量与数量的要求。
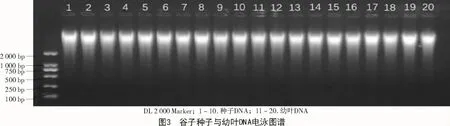
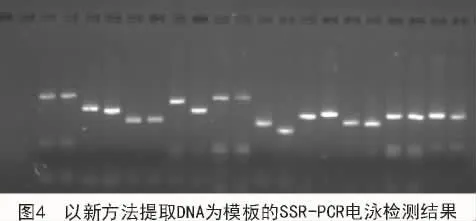
3 讨论与结论
随着谷子基因组测序的完成,谷子分子标记开发与检测成为当前的研究热点。作为谷子分子标记检测的第1步,核酸提取的结果直接影响下游试验,因此,找到一套简便、高效的DNA提取方法很有必要[11-13]。近年来,人们对于谷子基因组DNA提取方法进行了大量的研究,如碱处理法[14]、高温水煮法[15]、SDS 一步法[16]、TE 研磨法[17]等,这些提取方法速度快、成本低,避免使用液氮研磨、苯酚等有毒化学试剂,甚至将破碎后的提取液直接作为模板,但都存在所得DNA质量不稳定,无法保证后续分子检测的准确性[18-20]。并且所用材料多为谷子的幼叶,需要加入β-巯基乙醇等防止氧化,对人体以及环境会造成一定程度的危害[21-22]。
本试验直接以谷子干种子为材料进行DNA提取,无需经过3~7 d的发苗期,无需液氮研磨,直接通过机械研磨破碎细胞壁,减少了核酸在异丙醇中的沉淀时间,提取过程简便、高效。同时无需加入苯酚、β-巯基乙醇等对人体有害的试剂,所获DNA能够满足SSR等分子检测试验的需求,为实现谷子高通量分子检测奠定了基础。
参考文献:
[1]周晶,曾庆涛,刘铨义,等.一种适用于棉花种子的DNA快速提取方法[J].作物杂志,2014(2):31-33.
[2]魏琦超,畅丽萍,周岩,等.利用改良CTAB法提取小麦干种子总 DNA[J].山西农业科学,2009,37(6):30-32.
[3]王惠,郭峰,关超,等.适用于SSR分析的半粒水稻干种子DNA快速提取[J].科技导报,2013(25):58-60.
[4]田丽波,谷幸幸,商桑,等.苦瓜基因组DNA的提取及ISSR扩增体系的优化[J].中国农学通报,2013,29(4):88-93.
[5]韩玉杰,贾炜珑,王自霞,等.几种提取植物DNA方法的比较[J].山西农业科学,2008,36(7):17-19.
[6]凌莉,李志勇,黄韵,等.食品中植物基因组DNA提取纯化方法研究进展[J].食品科技,2012(5):6-10,15.
[7]张换样,李静,南芝润,等.甘薯DNA的小量快速提取[J].山西农业科学,2009,37(1):12-14.
[8]戴剑,洪德林,张大栋,等.一种快速高效的DNA提取方法研究[J].麦类作物学报,2011(3):437-442.
[9]龚双军,杨立军,刘辉,等.1种小麦白粉病菌DNA基因组的微量简捷提取方法[J].微生物学杂志,2011(1):24-27.
[10]颜松.药用植物基因组DNA提取及铁皮石斛RAPD反应体系的优化[D].重庆:西南交通大学,2009.
[11]张晓祥,王玲,寿路路.一种快速提取小麦基因组DNA的改良CTAB 方法[J].中国农学通报,2012,28(36):46-49.
[12]许明,程祖锌,黄志伟,等.一种适于转基因水稻PCR检测的微量 DNA 快速提取法[J].生物技术通报,2010(3):128-130.
[13]王兰,龙云铭,刘耀光.一种用于PCR的植物基因组DNA快速制备方法[J].分子植物育种,2009,7(2):425-428.
[14]楼巧君,陈亮,罗利军.三种水稻基因组DNA快速提取方法的比较[J].分子植物育种,2005(5):749-752.
[15]任海龙.药用植物大黄种子基因组DNA的提取方法研究[J].山西农业科学,2018,46(3):325-327,349.
[16]刘风路,张金丽,李靖,等.西南地区榧树属植物3种不同总DNA 提取方法的比较分析 [J].天津农业科学,2018,24(3):1-4.
[17]文静,谢培,孙琛,等.珠子参新鲜和干燥块茎DNA提取方法的比较研究[J].陕西农业科学,2018,64(2):1-3,11.
[18]盛鸥,张玉娥,邓贵明,等.香蕉不同组织的基因组DNA制备方法的比较[J].分子植物育种,2017,15(12):5052-5059.
[19]董永军,王陆军,郝建平,等.玉米干种子基因组DNA提取方法的改进[J].山西农业科学,2017,45(12):1903-1906.
[20]王瑞云,刘笑瑜,王海岗,等.用高基元微卫星标记分析中国糜子遗传多样性[J].中国农业科学,2017,50(20):3848-3870.
[21]闫玖英,马长青,常博,等.改良CTAB法用于苹果果实基因组DNA 的提取[J].分子植物育种,2017,15(9):3610-3615.
[22]曾巧英,凌秋平,胡斐,等.5种提取方法对甘蔗汁中DNA提取的效果[J].安徽农业科学,2017,45(25):136-138,152.
