聚谷氨酸生物的合成及其在修复和改良土壤中的应用
2018-05-17张宸
张 宸
(1.陕西省土地工程建设集团有限责任公司, 陕西 西安 710075;2. 陕西地建土地工程技术研究院有限责任公司, 陕西 西安 710075; 3.国土资源部 退化及未利用土地整治重点实验室, 陕西 西安 710075; 4.陕西省土地整治工程技术研究中心, 陕西 西安 710075)
随着社会发展,生物高分子材料由于对环境污染小,同时符合可持续发展战略的要求,已逐渐替代石化高分子材料被广泛应用于农业、食品、化妆品及医药领域[1]。γ-聚谷氨酸(poly-γ-glutamic acid, γ-PGA)是一种可由多种微生物合成的,具有生物降解性的水溶性生物高分子材料,具有良好的持水性、吸附性、生物降解性和生物相容性。1937年Ivanovics等[2]首次在一种致病的革兰氏阳性菌——炭疽芽孢杆菌(Bacillusanthracis)的细胞荚膜中分离得到了了这种物质。
近年来,已有多篇文献报道了利用各类新材料对土壤进行改良和修复的研究成果。尽管各类土壤修复技术对污损土壤的修复做出了贡献,但也存在如修复成本高、周期长,特别是二次污染严重等诸多问题[3-5]。因而,筛选高效低成本、环境友好型土壤改良剂,是土壤改良和修复研究中的重中之重。因其独特的理化和生物学特性,近年来γ-PGA已在土壤环境改良、污损土地整治研究领域崭露头角。
1 γ-PGA的分子结构和性质
γ-PGA是一种阴离子高聚物,由L-谷氨酸或D-谷氨酸单体的γ-羧基与α-氨基以酰胺键连接而成。与普通蛋白分子相比,γ-PGA不依靠核糖体合成,因此不会被普通的蛋白酶(protease)所降解。由于γ-PGA分子侧链上具有大量的游离羧基,使其具有强烈的吸水性,水溶液粘度很高[6]。不同微生物合成的γ-PGA结构上的差异主要在于D-谷氨酸,L-谷氨酸单体的组成比例及其分子量差别,分子量一般介于100~1 000 kD,相当于50~5 000个左右的谷氨酸单体[7-8]。近年来,人们不断开发γ-PGA在水凝胶、保湿剂、增稠剂、成膜剂、分散剂、基因载体、药物控释载体、烟草、化妆品、植物种子保护、肥料增效剂及食品添加剂等方面的应用[9]。随着γ-PGA在新领域中的应用拓展,其相关研究越来越受到人们的关注[10]。
2 γ-PGA的生物合成
2.1 γ-PGA生产菌
γ-PGA的合成主要通过微生物发酵法。γ-PGA生产菌根据发酵基质过程中是否必需添加谷氨酸底物分为两类:一类是需要谷氨酸作为底物来生产γ-PGA的菌株,即谷氨酸依赖型菌(Ⅰ型),而另一类是不需要添加谷氨酸作为底物来生产γ-PGA的菌株,即非谷氨酸依赖型菌(Ⅱ型)[11]。常见的γ-PGA生产菌概况详见表1。
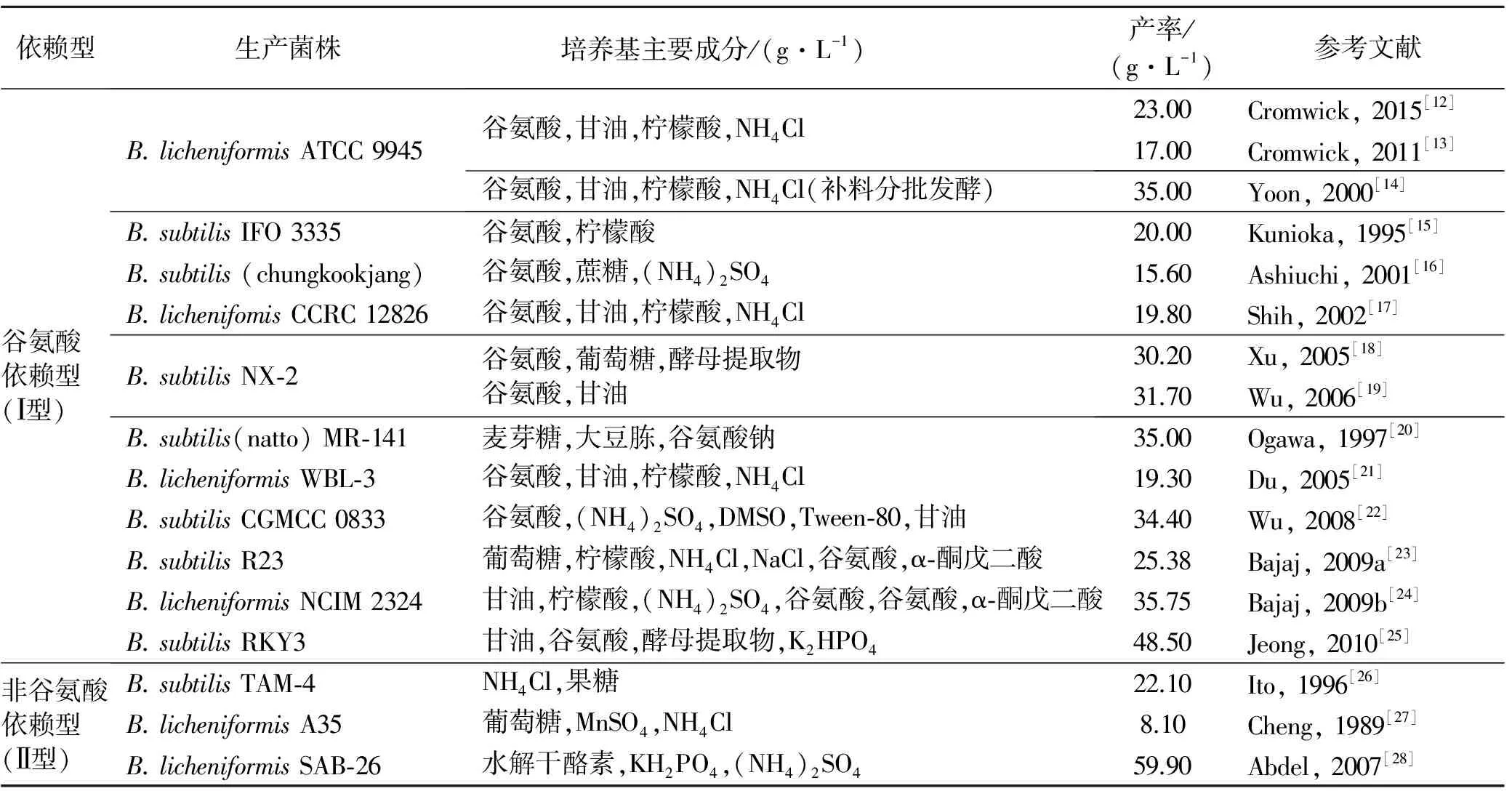
表1 常见γ-PGA生产菌概况
2.2 γ-PGA生物合成机制
2.2.1 γ-PGA中碳骨架的来源 γ-PGA中的碳骨架构成可能来源于谷氨酸(Glu)或葡萄糖(glucose),不同发酵菌株其来源不尽相同。
Wu Q等[19]对B. subtilis NX-2发酵基质中的葡萄糖进行了13C标记,同位素跟踪分析结果发现葡萄糖作为碳源主要作用于能量代谢和菌体合成,只有少部分参与了γ-PGA的合成,外源谷氨酸则是γ-PGA中碳的主要供体;而在B.subtilis(natto) MR-141[20]的发酵过程中,约6%的14C-葡萄糖参与了γ-PGA的合成,还有约35%的外源14C-Glu也被整合进入γ-PGA的分子结构中。由上可知,γ-PGA碳骨架来源具有菌株种属特异性。
2.2.2 γ-PGA链中谷氨酸的来源 γ-PGA中的谷氨酸单体由D-Glu和L-Glu构成。
对于谷氨酸依赖型菌(Ⅰ型),L-Glu的来源可分为内源-Glu和外源-Glu。一般而言,内源-Glu由谷氨酸合酶—谷氨酰胺合成酶(GOGAT-GS)途径合成[29]。此外,谷氨酸族的L-Pro和L-Arg均可经异化作用生成L-Glu[30]。而绝大多数γ-PGA生产菌株能够直接利用外源-Glu合成γ-PGA。Cromwick等[13]对B.licheniformisATCC 9945发酵培养基中添加的谷氨酸进行了13C标记,发现γ-PGA中的谷氨酸单体来自于外源-Glu。
γ-PGA链中的D-Glu单体,一般是L-Glu经D-氨基酸转氨酶(D-transaminase)途径转化而来。Ashiuchi等[31]从B. subtilis IFO 3335中分离得谷氨酸消旋酶(glutamate racease),为γ-PGA聚合链中D-Glu的来源提供了答案。
2.2.3 γ-PGA微生物合成机制 目前报道的γ-PGA最为可能的合成机理首先是ATP被谷氨酸依赖的ATP水解酶水解为ADP和Pi,然后磷酸基团结合到小分子γ-PGA的C末端,最后L-或D-谷氨酸的氨基端与小分子γ-PGA被磷酸化了C端的发生亲核攻击,同时生成Pi并延伸γ-PGA链[6,31-32]。
3 γ-PGA在土壤修复和改良中的应用
3.1 γ-PGA对旱区土壤的改良作用
长期以来,干旱成为制约农业可持续发展的重要因素之一。由于土壤水分缺乏所导致的土壤干旱和沙化,严重制约着我国农业的发展。土壤保水剂是近年发展迅速的一系列抗旱保水材料。γ-PGA分子中含有1 000多个超强的亲水基团(-COOH),具有极佳的吸水能力,有助于维持土壤中水分,改善黏质土壤的膨松度及空隙度,改善砂质土壤的持水持肥能力。因此,γ-PGA在提高农田抗旱保水能力方面具巨大的应用潜力。例如,王传海等[33]研究发现γ-PGA的最大自然吸水率可达1 108.4倍,土壤水分吸收率可达30~80倍,显著优于目前常见的聚丙烯酸盐类吸水树脂。
γ-PGA水浸液的土壤保水能力和水分缓释效果也十分显著,具有明显的抗旱促苗效应。史文娟等[34]利用土壤水分渗透模型实验,在土壤中施加4%的γ-PGA后水分累积入渗量、入渗率和湿润锋分别减小了57.95%,53.89%和59.58%,土壤饱和含水率明显提高。同时γ-PGA还能改变土壤剖面中水分分布形态,使水分更多地集中在作物的根层区域,从而有利于提高作物的水分利用效率。张新民等[35]在干土中直接施用γ-PGA水浸液,相比浇水试验能够缩短小麦出苗期,增加苗高,加深根系的最大深度。随着γ-PGA水浸液用量的增加,对小麦生长的促进效果也越明显。上述研究成果表明了γ-PGA具有较好的土壤保水和吸水性能,能够提高作物对水分的有效利用率,为其在农田抗旱保水、旱区土壤改良领域的应用提供了可能。
同时,利用γ-PGA生产菌直接对土壤进行保水的研究已见报道。河海大学[36]通过一株能够合成谷氨酸的与一株能够合成γ-PGA的功能微生物复合菌株,发明了一种能够适应干旱贫瘠土壤环境的农田土壤微生物保水制剂。该制剂用于粉砂质土壤中可以显著提高油菜株高和产量,增加土壤导水率及饱和含水量。
3.2 γ-PGA对盐碱土壤的改良
土壤盐碱化是一个世界性难题。全世界盐碱土面积已达1.0×109hm2,且每年以(1.0×106~1.5×106hm2的速度增长。自20世纪60年代起,中国传统农业生产中由于不合理灌概,土壤中大量盐分随水分蒸发向上运动而聚集在土表,造成土壤板结和盐碱化等环境问题,导致农产品的产量和质量下降,目前中国已有近1/5耕地发生盐碱化。
世界各地相继开展了多种农业和化学方法对盐碱地进行改良。农业改良只能局部减轻土壤盐碱化程度,对大面积盐碱地的改良,仍存在困难;化学改良一般用于重度盐碱地的修复,见效快,却因易引进新离子而造成土壤二次污染。因此,寻找一种高效、可降解、无污染的新型盐碱土壤改良剂成为目前亟待解决的问题。
侯亚玲等[37]研究了枯草芽孢杆菌对盐碱土壤水分运动及土壤水稳定团聚体的影响,表明枯草芽孢杆菌产生的γ-PGA可以显著降低土壤入渗能力,增强土壤持水能力,改善土壤团粒结构,进而达到对盐碱土壤进行改良的效果。西南大学[38]研究了γ-PGA与耐盐植物对盐渍土壤联合修复的效果,与单一γ-PGA及耐盐植物去除盐离子效果相比,联合修复的盐离子去除率显著提高,实验获得修复Ca2+,Mg2+,NO3-型次生盐渍化土壤的最佳组合为1 000 mg/L γ-PGA和景天三七(J3),总盐分的最终去除率可达到74.72%。Chen Lihua等[39]利用γ-PGA对沿海地区的盐渍土壤进行改良,与对照组相比,γ-PGA处理的土壤含盐量降低了39.93%,总氮流失率降低了65.37%,水土抗侵蚀系数显著提高,土壤团聚体得以改善,结果表明γ-PGA可以有效维持海水浸侵土壤的总氮含量并对沿海盐渍土壤进行改良。
3.3 γ-PGA对重金属污染土壤的修复
土壤重金属污染的修复研究己成为国内外土壤环境科学领域的热点课题之一。近年来,中国某些地区土壤重金属污染程度逐步加剧,被重金属污染的耕地面积达1.33×106hm2,尤其在一些有色金属矿区。位于城市和工业污水集中排放区的农田重金属含量严重超标,土壤污染正逐步动摇着我国粮食安全的根基,对全球生态环境构成极大威胁。目前,对重金属污染土壤的修复主要有:物理修复、生物修复、工程措施修复、化学钝化修复等技术。γ-PGA具有超强的吸附性能,可高效、快速的对Pb,Cr,Cd,Al,As等土壤重金属进行螯合,使其不被作物所吸收,从而达到生产安全农产品的目的。
Zonghan Yang等[40]在重金属污染的土壤中应用γ-PGA,使用200 mM的γ-PGA在pH=6,液固比为10∶1的条件下浸提土壤30 min后,对土壤中Cr,Ni,Cu,Zn的去除率分别可达30%,27%,45%和43%。Zhu Jun等[41]将使用γ-PGA活化后的磷矿粉应用于被重金属污染的农田,随着γ-PGA活化浓度由0~20 g/L梯度增加,活化后的Baokang磷矿粉和Nanzhang磷矿粉对土壤残渣态铅的去除效果分别增加了200%和150%。在铅污染土壤中使用γ-PGA活化的两种磷矿粉后,小白菜产量均显著增加,同时小白菜根、叶中的铅含量也明显减少。因此,使用γ-PGA活化的磷矿粉一定程度上可以起到土壤铅的固化作用,减少铅在土壤中的移动性,同时能够阻止植物对铅的吸收。由此能够推断,γ-PGA在修复重金属污染土壤的过程中具有重要作用。
3.4 γ-PGA对土壤肥力的改良
随着经济的飞速发展和人口的迅猛增长,耕地肥力和耕地质量问题越来越受到人们的关注。目前,中国人口和非农占地面积的逐年上升,人均耕地逐年减少,对于中国这样一个人口大国,这是极其严重的问题。因此,如何保持和提高土壤肥力,提高耕地质量,提高单位面积生产能力,应引起全国人民的高度重视。
徐宗奇等[42]利用盆栽实验研究了γ-PGA对小青菜产量及土壤中铵态氮的影响。γ-PGA在肥料缺乏时对小青菜的增产效果尤为明显。同时γ-PGA处理能显著降低小青菜中硝酸盐的含量,增加维生素C的含量,提高小青菜的品质。γ-PGA还有助于土壤中铵态氮的积累,提高土壤肥力。而蔡志坚[43]对γ-PGA活化磷矿粉进行了研究,发现γ-PGA能促进磷矿粉的释磷作用,具有活化磷矿粉的效果,并且随着γ-PGA的活化浓度由0~20.0 g/L不断升高,磷矿粉中水溶性磷的释放量成逐渐增加的趋势。与此同时,研究还发现施用γ-PGA活化磷矿粉比单施磷矿粉对小白菜产量具有更大的增效,最大增幅可达23.6%。Zhang Lei等[44]将13C-15N标记的γ-PGA施用与小白菜生长的土壤中,γ-PGA不仅可以提高小白菜根的养分吸收能力,提高小白菜产量,同时可以作为N源为植物的生长提供营养,具有植物环保氮肥研究前景。
3.5 γ-PGA对土壤酸碱性的平衡
γ-PGA具有极佳的缓冲能力,可有效平衡土壤酸碱值,缓解因长期使用化学肥料引起的土壤酸化及土壤板结[45]。
以胶东半岛为例,众多苹果果园存在土壤酸化的情况。在每1 hm2施用γ-PGA发酵液约15 L后,过段时间观察,γ-PGA可明显提高酸性土壤的pH值1~2个单位,改善因酸化造成的果树苦痘等病害,同时改善果实的品质。另外,γ-PGA对于使用过量化学肥料造成的次生酸化也有很好的调节作用[46]。
4 γ-PGA对土壤环境的影响
在利用γ-PGA对土壤进行改良或修复时,我们还应充分考虑到γ-PGA的土壤环境的影响作用。在γ-PGA的土壤应用研究中,已有学者对其进行了报道。
Zhang Lei等[47]在砂质黏壤土中应用γ-PGA,研究了其土壤碳氮累计损失量及CO2排放量的变化。结果表明,当γ-PGA浓度为0.1 g/kg时,土壤无机铵及硝酸盐累计损失减少了29.31%和52.42%;浓度为0.2~0.8 g/kg时,可溶性氮累计损失减少了7.16%~40.10%,可溶性有机碳几乎没有变化,而CO2排放量却显著增加了26.87%~180.70%。土壤总氮及有机碳含量随着γ-PGA浓度的变化而改变。Xu Zongqi等[48]使用γ-PGA作为氮肥增效剂时,发现土壤中微生物数量及微生物多样性都显著增加。这与Chen Lihua等[39]的研究成果相一致。
5 研究展望
作为环境友好型生物材料,γ-PGA在土壤修复和改良领域巨大的开发潜力是毋庸置疑的。为增强γ-PGA在土壤整治领域的应用能力,在今后的研究中应重点开展以下4个方面的工作:
(1) 选育优良菌种,提高γ-PGA发酵产率;加大科研力度,开发γ-PGA工业产业化生产工艺,让这种环境友好型生物材料真正服务于社会。
(2) 直接利用γ-PGA菌种发酵液进行土壤修复和改良实验,探索实验成果转化技术,达到应用过程简化,提高资源利用率。
(3) 选育适应各类型土壤的γ-PGA高活性菌株,通过基质复配或菌种复配等手段,制备得到直接施用于土壤的生物菌种型土壤修复剂或改良剂。
(4) 应加强γ-PGA与不同类型土壤物质之间相互作用的机理研究,从而扩大其在土壤整治领域的应用范围和应用效果,为其应用推广奠定基础。
[参考文献]
[1] Buescher J M, Margaritis A. Microbial biosynthesis of poly glutamic acid biopolymer and applications in the biopharmaceutical, biomedical and food industries[J]. Critical Reviews in Biotechnology, 2001,27(1):1-19.
[2] Ivánovics G, Bruckner V. Chemical and immuno-logical studies on the mechanism of infection and immunity in anthrax: The chemical structure of the capsular substance ofB.anthracisand of the sero-logieally identical substance inB.mesentericus.[J]. Zeitschrift Fur Immunitatsfor Schung und Experimentelle Therapie, 1937,90:304-318.
[3] 卢晓霞,李秀利,马杰,等.焦化厂多环芳烃污染土壤的强化微生物修复研究[J].环境科学,2011,32(3):864-869.
[4] 李玉双,胡晓钧,孙铁琦,等.污染土壤淋洗修复技术研究进展[J].生态学杂志,2011,30(3)3:596-602.
[5] Ruling S G, Pivetz B E. In-situ Chemical Oxidation[R]. Washington D C: USEPA, 2006.
[6] 张宸.纳豆芽孢杆菌发酵聚谷氨酸过程中谷氨酸脱氢酶钙调节机制研究[D].陕西 西安:陕西师范大学, 2014.
[7] Buescher J M, Margaritis A. Microbial biosynthesis of polyglutamic acid biopolymer and applications in the biopharmaceutical, biomedical and food industries[J]. Critical Reviews in Biotechnology, 2007,27(1):1-19.
[8] Shih I, Van Y, Yeh L, et al. Production of a biopolymer flocculant fromBacilluslicheniformisand its flocculation properties[J]. Bioresour Technology, 2001,78(3):267-272.
[9] 王萌, 许孝瑞. γ-聚谷氨酸在农业应用中的研究进展[J]. 黑龙江农业科学, 2014(10):161-163.
[10] 梁金丰, 徐虹, 姚俊, 等. γ-聚谷氨酸提取的发酵液预处理及分离纯化工艺[J]. 食品与发酵工业, 2009,35(3):6-11.
[11] 任媛媛.钙调节聚谷氨酸合成通路中α-酮戊二酸代谢节点和聚谷氨酸合成酶的机制及Bacillus subtilis HSF1410基因组信息[D]. 陕西 西安:陕西师范大学, 2015.
[12] Cromwick A M, Birrer G A, Gross R A. Effects of pH and aeration on γ-poly (glutamic acid) formation byBacilluslicheniformisin controlled batch fermentor cultures[J]. Biotechnology and Bioengineering, 2015,50(2):222-227.
[13] Cromwick A M, Gross R A. Investigation by NMR of metabolic routes to bacterial γ-poly(glutamic acid) using13C-labeled citrate and glutamate as media carbon sources[J]. Canadian Journal of Microbiology, 2011,41(10):902-909.
[14] Yoon S H, Do J H, Lee S Y, et al. Production of poly-γ-glutamic acid by fed-batch culture ofBacilluslicheniformis[J]. Biotechnology Letters, 2000, 22(7):55-588.
[15] Kunioka M, Goto A. Biosynthesis of poly(γ-glutamic acid) from L-glutamic acid, citric acid, and ammonium sulfate inBacillussubtilisIFO3335[J]. Applied Microbiology and Biotechnology, 1995,44(3/4):501-506.
[16] Ashiuchi M, Kamei T, Baek D H, et al. Isolation ofBacillussubtilis(chungkook-jang), a poly-γ-glutamate producer with high genetic competence[J]. Applied Microbiology and Biotechnology, 2001,57(5/6):764-769.
[17] Shih I L, Van Y T, Chang Y N. Application of statistical experimental methods to optimize production of poly (γ-glutamic acid) byBacilluslicheniformisCCRC 12826[J]. Enzyme and Microbial Technology, 2002,31(3):213-220.
[18] Xu Hong, Jiang Min, Li Hin, et al. Efficient production of poly (γ-glutamic acid) by newly isolatedBacillussubtilisNX-2[J]. Process Biochemistry, 2005,40(2):519-523.
[19] Wu Qun, Xu Hong, Xu Lin, et al. Biosynthesis of poly (γ-glutamic acid) in Bacillus subtilis NX-2: Regulation of stereochemical composition of poly-γ-glutamic acid[J]. Process Biochemistry, 2006,41(7):1650-1655.
[20] Ogawa Y, Yamacuchi T F, Yuasa K, et al. Efficient production of γ-poly-glutamic Acid by Bacillus subtilis (natto) in jar fermenters[J]. Bioscience Biotechnology Biochemistry, 1997,61(10):1684-1687.
[21] Du G, Yang G, Qu Y, et al. Effects of glycerol on the production of poly(γ-glutamic acid) by Bacillus licheniformis[J]. Process Biochemistry, 2005,40(6):2143-2147.
[22] Wu Q, Xu H, Shi N, et al. Improvement of poly(γ-glutamic acid) biosynthesis and redistribution of metabolic flux with the presence of different additives inBacillussubtilisCGMCC 0833[J]. Applied Microbiology and Biotechnology, 2008,79(4):527- 535.
[23] Bajaj I B, Singhal R S. Sequential optimization approach for enhanced production of poly(γ-glutamic acid) from newly IsolatedBacillussubtilis[J]. Food Technology and Biotechnology, 2009,47(3):313-322.
[24] Bajaj I B, Singhal R S. Enhanced production of poly(γ-glutamic acid) from Bacillus licheniformis NCIM 2324 by using metabolic precursors[J]. Applied Biochemistry and Biotechnology, 2009, 159(1):133-141.
[25] Jeong J H, Kim J N, Wee Y J, et al. The statistically optimized production of poly (γ-glutamic acid) by batch fermentation of a newly isolatedBacillussubtilisRKY3[J]. Bioresource Technology, 2010,101(12):4533-4539.
[26] Ito Y, Tanaka T, Ohmachi T, et al. Glutamic acid independent production of poly(γ-glutamic acid) byBacillussubtilisTAM-4[J]. Journal of the Agricultural Chemial Society of Japan, 1996,60(8):1239-1242.
[27] Cheng C, Asada Y, Aaida T. Production of γ-polyglutamic acid byBacillussubtilisA35 under denitrifying conditions[J]. Agricultural Biological Chemistry, 1989,53:2369-2375.
[28] Abdel-Fattah Y R, Soliman N A, Berekaa M M. Application of box-behnken design for optimization of poly-γ-glutamic acid production byBacilluslicheniformisSAB-26[J]. Research Journal of Microbiology, 2007,2(9):664-670.
[29] Candela T, Fouet A. Poly-gamma-glutamate in bacteria[J]. Molecular Microbiology, 2006,60(5):1091-1098.
[30] Bajaj I B. Singhal R S. Poly(glutamic acid): An emerging biopolymer of commercial interest[J]. Bioresource Technolology, 2011, 102(10):5551-5561.
[31] Ashiuchi M, Nawa C, Kamei T, et al. Physiological and biochemical characteristics of poly γ-glutamate synthetase complex ofBacillussubtilis[J]. European Journal of Biochemistry, 2001,268(20):5321-5328.
[32] Stanley N R, Lazazzera B A. Defining the genetic differences between wild and domestic strains ofBacillussubtilisthat affect poly-γ-DL-glutamic acid production and biofilm formation[J]. Molecular Microbiology, 2005,57(4):1143-1158.
[33] 王传海,何都良,郑有飞,等.保水剂新材料γ-聚谷氨酸的吸水性能和生物学效应的初步研究[J].中国农业气象,2004,25(2):19-22.
[34] 史文娟,梁嘉平,陶汪海,等.添加γ-聚谷氨酸减少土壤水分深层渗漏提高持水能力[J].农业工程学报,2015,31(23):94-100.
[35] 张新民,姚克敏,徐虹.新型高效吸水材料(γ-PGA)的农业应用研究初报[J].大气科学学报,2004,27(2):224-229.
[36] 陈立华,邵孝侯,程晋,等.一种农田土壤微生物保水制品及其制备方法.CN103805204A[P].2014.
[37] 侯亚玲,周蓓蓓,王全九,等.枯草芽孢杆菌对盐碱土水分运动和水稳性团聚体的影响[J].水土保持学报,2017,31(04):105-111.
[38] 唐冬. γ-聚谷氨酸和耐盐植物联合修复设施栽培盐渍化土壤[D].重庆:西南大学, 2015.
[39] Chen Lihua, Xu Xianghong, Zhang Huan, et al. Effects of poly-γ-glutamic acid biopreparation(PGAB) on nitrogen conservation in the coastal saline soil[C]. EGU General Assembly Conference. EGU General Assembly Conference Abstracts, 2017.
[40] Yang Zonghan, Dong Chengdi, Chen Chiwen, et al. Using poly-glutamic acid as soil-washing agent to remediate heavy metal-contaminated soils[J]. Environmental Science & Pollution Research International, 2017:2661-2667.
[41] Zhu J, Cai Z, Su X, et al. Immobilization and phytotoxicity of Pb in contaminated soil amended with γ-polyglutamic acid, phosphate rock, and γ-polyglutamic acid-activated phosphate rock[J]. Environmental Science & Pollution Research International, 2015, 22(4):1-7.
[42] 许宗奇,万传宝,许仙菊,等.肥料增效剂γ-聚谷氨酸对小青菜产量和品质的影响[J].生物加工过程,2012,10(1):58-62.
[43] 蔡志坚. γ-聚谷氨酸活化磷矿粉对Pb污染土壤铅形态及小白菜生长的影响[D]. 湖北 武汉:华中农业大学, 2010.
[44] Zhang Lei, Yang Xueming, Gao Decai, et al. Effects of poly-γ-glutamic acid (γ-PGA) on plant growth and its distribution in a controlled plant-soil system[J]. Scientific Reports, 2017,7(1):6090.
[45] 汪家铭. 聚γ-谷氨酸增效复合肥的发展与应用[J].泸天化科技, 2010(2):20-24.
[46] 王美华.味丹聚谷氨酸及其在农业中的应用[J]. 中国农资,2015(4):25-25.
[47] Zhang Lei, Gao Decai, Li Jie, et al. Effects of poly-γ-glutamic acid (γ-PGA) on soil nitrogen and carbon leaching and CO2fluxes in a sandy clay loam soil[J]. Canadian Journal of Soil Science.
[48] Xu Zongqi, Lei Peng, Feng Xiaohai, et al. Effect of poly (γ-glutamic acid) on microbial community and nitrogen pools of soil[J]. Acta Agriculturae Scandinavica, Section B-Soil & Plant Science, 2013,63(8):657-668.
[49] Chen Lihua, Xu Xianghong, Zhang Huan, et al. Effects of poly-γ-glutamic acid biopreparation (PGAB) on nitrogen conservation in the coastal saline soil[C]. EGU General Assembly Conference. EGU General Assembly Conference Abstracts, 2017.
