Th1/Th2细胞及细胞因子和结核性胸膜炎粘连的相关性
2018-05-17刘凌舒敬奎武江海冯家钢成会荣
刘凌 舒敬奎 武江海 冯家钢 成会荣
1昆明医科大学第一附属医院呼吸内二科(昆明 650032);2云南省疾病预防控制中心(昆明 650022)
结核性胸膜炎即使经过正规的抗结核治疗,仍有20%~50%的结核性胸膜炎发生胸膜增厚,已被广泛使用的皮质类固醇收效并不理想[1]。结核性胸膜炎胸膜增厚粘连的机制目前尚未明确,鉴于结核性胸膜炎以CD4+T淋巴细胞介导为主的免疫反应引起,许多研究从Th1/Th2角度出发,认为胸膜局部Th1细胞免疫增强可能导致免疫损伤[2]而发生胸膜粘连。本研究拟结合内科胸腔镜下具体的胸膜表现,测定不同胸膜粘连程度的Th1、Th2细胞比例及相关细胞因子的水平,明确胸膜粘连和胸膜局部炎症免疫状态的相关性。
1 对象与方法
1.1 研究对象 入选我院2014年8月至2016年12月住院的66例行内科胸腔镜检查确诊为结核性胸膜炎的患者,男39例,女27例,年龄17~78岁,平均(43.8±15.2)岁。入选患者必须符合下列两条之一:(1)内科胸腔镜下取胸膜结节直接印片找到抗酸杆菌,和(或)胸腔内纤维条索直接涂片找到抗酸杆菌;(2)内科胸腔镜下取胸膜活组织检查病理有典型的结核性肉芽肿改变。排除标准:(1)同时合并肺部良性疾病(如肺炎、肺脓肿、肺栓塞、支气管扩张等);(2)胸膜肿瘤,肺部或其他系统恶性肿瘤转移至胸膜引起胸腔积液;(3)合并风湿性结缔组织病、糖尿病、血液系统疾病等;(4)患者及其家属拒绝接受、患者身体状况无法耐受检查或其他原因中断检查者;(5)血清抗人类获得性免疫缺陷病毒(HIV)抗体阳性者。
根据内科胸腔镜下所见按照不同的胸膜粘连程度将入选患者分组。胸膜粘连严重程度分级参照ONCEL等[3]的动物实验分级和张艳等[4]的内科胸腔镜下分级,具体判断方法如下:0级,胸膜可见充血肿胀,散在结节,但胸膜腔内各处均无胸膜粘连;1级,整个胸膜腔内可见1~3条经牵拉即可分离的疏松薄的胸膜粘连带;2级,胸膜腔的一个区域有3条及以上粘连带,钝性即可分离的胸膜粘连,整个胸膜腔可以显露;3级,胸膜腔的每个区域均有散在的粘连带,部分胸膜腔粘连而不能显露,分离胸膜粘连时可出现胸膜出血或损伤;4级,大部分胸膜腔由于粘连而闭合,仅能显露小部分胸膜腔,分离胸膜粘连时可出现胸膜出血或损伤。0级为无胸膜粘连,1~2级判定为轻度胸膜粘连,3~4级为重度胸膜粘连。
1.2 方法
1.2.1 主要试剂与仪器 测定细胞因子的ELISA试剂盒购自广州RayBio公司。1640培养基和PBS缓冲液购自美国Hyclone公司,胎牛血清(FBS)购自美国Gibco公司。Th1和Th2细胞分型试剂盒购自美国BD公司。EPI⁃CS XL型流式细胞仪(美国Beckman Coulter公司)。
1.2.2 标本采集 患者在内科胸腔镜下肉眼判断为结核性胸膜炎可能即于手术时遵循严格无菌操作采集胸水标本2份,一份不抗凝,10 mL,离心后取上清液于-80℃冰箱冻存,待测细胞因子。一份抗凝,50 mL,进行Th1和Th2细胞比例测定。同时于手术中采集1份静脉血,不抗凝,3 mL,离心后取血清于-80℃冰箱冻存,待测细胞因子。观察并记录胸膜腔粘连程度。
1.2.3 细胞因子测定 采用双抗体夹心ELISA法测定胸水和血清中 INF⁃γ、TNF⁃α、IL⁃2、IL⁃4的含量。
1.2.4 Th1和Th2细胞测定 胸水取样后2 h内进行处理。采用Ficoll密度梯度离心法分离胸水中单个核细胞(PBMC)。将获取的PBMC用RPMI 1640完全培养基重悬,调整细胞浓度为2×106个/mL。取2 mL细胞悬液转移到12孔板中,加入佛波酯(50 ng/mL)、离子霉素(1 μg/mL)和高尔基蛋白转运抑制剂刺激培养,在37℃5%CO2培养箱中培养5 h。按照BD试剂盒说明书进行流式抗体染色标记。收集刺激后PBMC,250g离心10 min,用1 mL预冷的BD CytofixTMFixation Buffer固定细胞15 min,250g离心10 min后用stain buffer洗涤两次。用1 mL Perm/Wash Buffer重悬细胞,室温孵育15 min进行膜通透打孔。细胞离心后用50 μL Perm/Wash Buffer重悬,加入20 μL混合抗体进行标记染色,室温避光孵育30 min。1 mL Perm/Wash Buffer洗涤两次后用stain Buffer重悬细胞,流式细胞仪上机检测(BD FACSCantoⅡ)。
1.3 统计学方法 采用SPSS 17.0统计学软件进行分析,数据采用均数±标准差表示,各组间组内均数差异统计采用配对资料的t检验,组间均数差异统计采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 内科胸腔镜下患者胸膜粘连程度的判定 根据胸膜粘连的判定标准,无胸膜粘连9例;轻度胸膜粘连32例,判定为1级的14例,2级的18例;重度胸膜粘连25例,判定为3级的14例,4级的11例(图1~5)。
2.2 3组血液和胸液细胞因子水平的检测结果结核性胸膜炎患者4种细胞因子含量在血清和胸腔积液中不同,每组胸液中4种细胞因子均较血清中含量升高,差异有显著性(P<0.05)。3组患者血清中4种细胞因子含量比较差异无显著性。胸水中INF⁃γ、TNF⁃α的平均浓度随胸膜粘连程度加重而逐渐升高,重度胸膜粘连组INF⁃γ、TNF⁃α水平明显高于另外两组,其中无胸膜粘连组和轻度胸膜粘连组INF⁃γ、TNF⁃α含量比较差异无显著性,而无胸膜粘连组和轻度胸膜粘连组分别与重度胸膜粘连组比较差异均有显著性(P<0.05)。IL⁃2、IL⁃4含量在3组患者胸液中的比较差异无显著性。见表1。
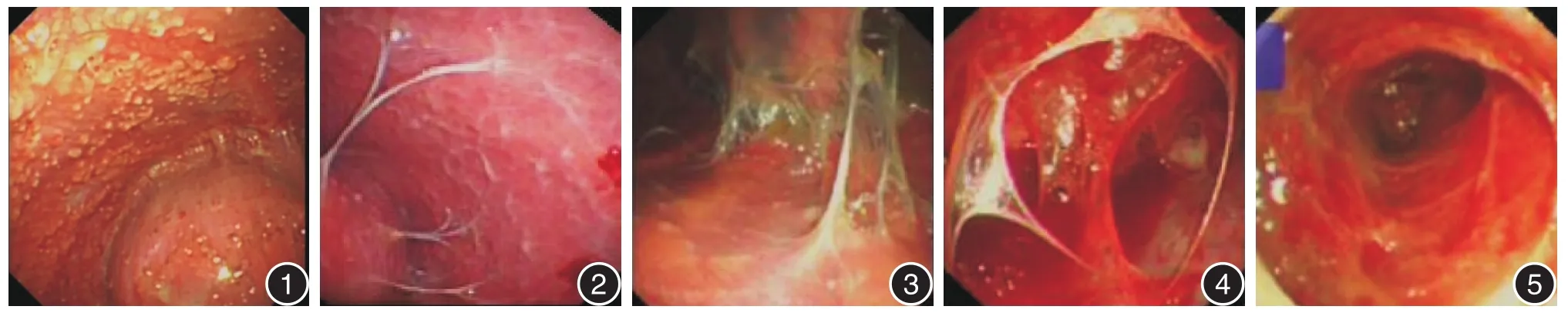
图1 无胸膜粘连0级 图2 胸膜粘连1级 图3 胸膜粘连2级 图4 胸膜粘连3级 图5 胸膜粘连4级Fig.1 No pleural adhesion 0 level Fig.2 Pleural adhesion 1 level Fig.3 Pleural adhesion 2 level Fig.4 Pleural adhesion 3 level Fig.5 Pleural adhesion 4 level
表1 3组血清和胸腔积液细胞因子检测结果Tab.1 Cytokines levels of pleural fluid and serum in three groups ±s,pg/mL
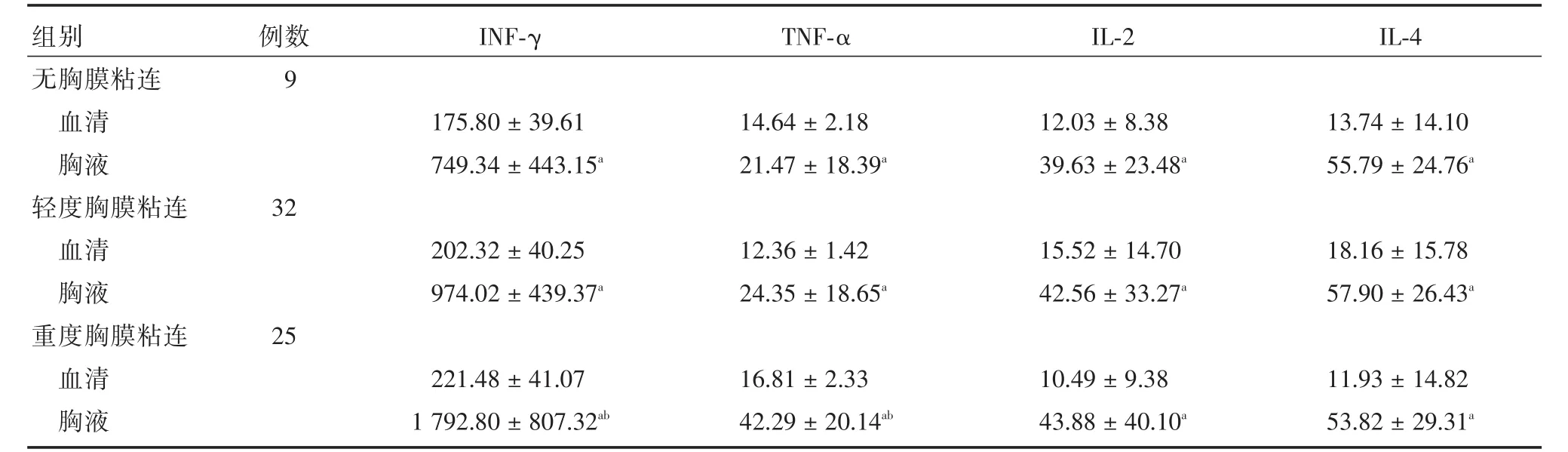
表1 3组血清和胸腔积液细胞因子检测结果Tab.1 Cytokines levels of pleural fluid and serum in three groups ±s,pg/mL
注:与同组血清比较,aP<0.05;与无胸膜粘连及轻度胸膜粘连组比较,bP<0.05
INF⁃γTNF⁃αIL⁃2IL⁃4组别无胸膜粘连血清胸液轻度胸膜粘连血清胸液重度胸膜粘连血清胸液例数9 175.80±39.61 749.34±443.15a 14.64±2.18 21.47±18.39a 12.03±8.38 39.63±23.48a 13.74±14.10 55.79±24.76a 32 202.32±40.25 974.02±439.37a 12.36±1.42 24.35±18.65a 15.52±14.70 42.56±33.27a 18.16±15.78 57.90±26.43a 25 221.48±41.07 1 792.80±807.32ab 16.81±2.33 42.29±20.14ab 10.49±9.38 43.88±40.10a 11.93±14.82 53.82±29.31a
2.3 3组间胸液Th1和Th2细胞比例 随胸膜粘连程度逐渐加重,Th1细胞比例也逐渐增加,重度胸膜粘连组的Th1细胞比例明显高于其他两组,差异有显著性(P<0.05),轻度胸膜粘连组Th1细胞比例稍高于无胸膜粘连组,差异无显著性(P>0.05)。Th2细胞比例在3组间比较差异无显著性。重度胸膜粘连组Th1/Th2细胞比值明显高于其他两组,差异有显著性(P<0.05),见表2、图6。
表2 3组胸腔积液T淋巴细胞亚群检测结果Tab.2 The proportion of Th cells in pleural fluid of three groups ±s

表2 3组胸腔积液T淋巴细胞亚群检测结果Tab.2 The proportion of Th cells in pleural fluid of three groups ±s
注:与无胸膜粘连及轻度胸膜粘连组比较,aP<0.05
组别无胸膜粘连轻度胸膜粘连重度胸膜粘连例数9 32 25 CD4+T细胞(%)51.42±13.46 55.61±11.90 70.48±14.53 Th1细胞(%)24.28±6.35 29.55±5.28 40.49±10.76a Th2细胞(%)2.07±0.38 2.69±0.51 2.36±0.44 Th1/Th2比值11.45±3.05 11.27±2.34 18.60±3.49a
3 讨论
有研究证实抗结核治疗前胸液的包裹粘连是抗结核治疗后胸膜增厚的重要预测因子[5]。胸膜增厚粘连的判断早期通过胸部CT扫描来进行,近来有学者用超声来判断,但敏感性均较低,且不直接,易受仪器和主观判断干扰。内科胸腔镜手术操作简单、安全、损伤小、并发症少,由呼吸科医师独立完成,可获得病理诊断[6],同时在内镜直视下探查整个胸膜腔,准确地判断胸膜粘连程度,使结果更加可靠。另外,有经验的医师能够直接根据镜下的胸膜表现判断为结核性胸膜炎,与病理高度符合[7]。本研究发现在胸部CT和B超检查发现胸膜粘连包裹前,即有相当患者存在胸膜粘连,内科胸腔镜下86.4%的患者有胸膜粘连,其中重度粘连占37.9%。笔者结合以往的研究改进了胸腔镜下胸膜粘连的分级方法,分为五级归于无、轻度、重度胸膜粘连3组,有利于统计学分析。
CD4+T淋巴细胞是人类拮抗结核分枝杆菌感染的主要免疫调节细胞[8],主要分为Th1(以分泌INF⁃γ、IL⁃2为主)与Th2(以分泌IL⁃4、IL⁃10为主)两类。Th1细胞介导的免疫应答对于结核的控制发挥最为关键的保护作用。Th2细胞亚群主要拮抗Th1型免疫反应,抑制巨噬细胞活化,阻断INF⁃γ活化巨噬细胞后的效应,Th1/Th2的平衡状态决定了结核性胸膜炎的发展趋势。
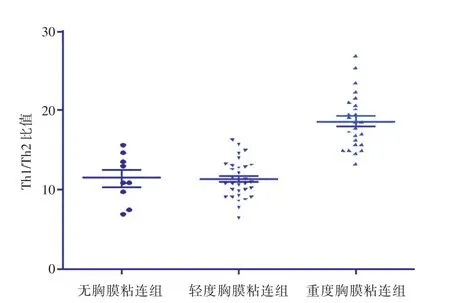
图6 不同胸膜粘连程度的胸液Th1/Th2细胞比值Fig.6 Ratio of Th1/Th2 in pleural effusion with different pleural adhesion
肖玲等[9]研究显示结核性胸液的INF⁃γ浓度明显升高,并且1个月内的包裹性胸液的INF⁃γ浓度显著高于游离性胸液者,认为结核性胸膜炎局部Th1型免疫增强,且过强的Th1免疫易导致胸膜粘连。戈启萍等[10]研究结核性胸腔积液中单个核细胞经抗原刺激后,Th1和Th2细胞亚群及Th1/Th2比值显著升高,且Th1呈高水平升高,Th2则低水平升高,推测结核性胸膜炎患者胸腔局部强化的Th1应答受到同样增强的Th2应答的负调节。本研究显示随着内科胸腔镜下胸膜粘连程度的逐渐加重,Th1细胞占CD4+T细胞的比例也逐渐升高,而Th2细胞的比例在不同胸膜粘连组中无明显变化,Th1/Th2的比值亦呈现升高趋势,Th1/Th2的平衡明显偏移,说明Th1型免疫反应增强,证实增强的Th1型免疫和胸膜粘连有关。
有研究指出MTB感染、结核病发生将引发众多细胞因子分泌变化,如INF⁃γ、IL⁃2、IL⁃4、IL⁃10、IL⁃8、IL⁃12、IL⁃17、TNF⁃α、TGF⁃β等升高[11-14]。结核性胸膜炎存在胸腔局部和全身Th1、Th2应答的差别,结核性胸液中Th1、Th2数目及其细胞因子INF⁃γ、TNF⁃α、IL⁃2、IL⁃4 明显较外周血升高[15]。本研究结果与之一致,INF⁃γ、IL⁃2、TNF⁃α、IL⁃4均明显高于外周血,说明胸膜腔局部的Th1和Th2免疫应答明显较全身免疫应答增强。
LI等[16]研究了ESAT⁃6混合多肽刺激结核性胸膜炎患者胸液细胞后的Th1细胞亚群,发现Th1细胞可分为7个亚群,其中TNF⁃α单阳性细胞的比例最高,其次为多功能性Th1细胞(INF⁃γ+IL⁃2+TNF⁃α+)。INF⁃γ可以增强胸腔局部的细胞免疫应答,利于病原体的清除,但同时作为致炎因子,能加剧炎症反应损伤胸膜组织,胸液中高浓度的INF⁃γ刺激活化的巨噬细胞、CD4+T细胞,甚至间皮细胞都分泌TNF⁃α,这样结核性胸液呈现高水平TNF⁃α[17-18]。高水平的TNF⁃α能够引起胸膜局部剧烈的炎症反应。张艳等[4]的研究证实结核性胸膜炎的胸膜粘连和胸液中TNF⁃α升高有关。本研究显示随着内科胸腔镜下胸膜粘连程度的逐渐加重,INF⁃γ、TNF⁃α水平也逐渐增加,证实胸膜局部剧烈的炎症反应可导致胸膜粘连,和胸液中INF⁃γ、TNF⁃α含量增加相关。本研究中IL⁃4水平在胸液中明显高于血清,说明Th2免疫应答在结核性胸膜炎的胸腔局部也增强,但Th2细胞比例和IL⁃4水平在不同胸膜粘连程度组中无明显差异,提示Th2免疫应答在结核性胸膜炎的胸腔局部仅一定程度的增强,负向调节Th1免疫应答,调节程度有限,剧烈的Th1免疫应答发生将导致Th1/Th2的失衡,Th2免疫应答和胸膜粘连无明显相关。反之,无胸膜粘连的Th1免疫应答无明显增强,Th1/Th2无明显失衡,推测胸水中Th1细胞亚群不同,或者受到其他Th细胞或细胞因子的调节,有待进一步研究。
综上所述,本研究结果显示,内科胸腔镜下判断胸膜粘连程度直接和准确。在结核性胸液中Th1和Th2细胞比例及其细胞因子水平都有增高,其中Th1细胞比例及INF⁃γ、TNF⁃α含量增加更为明显,并且水平越高,胸膜的粘连程度越明显,证实过度强烈的Th1型细胞免疫反应能够对胸膜组织造成病理性免疫损伤,与胸膜粘连严重程度相关,为结核性胸膜炎患者的免疫治疗提供了思路。
参考文献
[1]PABLO A,VILLENA V,EEHAVE S J,et al.Are pleueal flu⁃id parameters related to the development of residual pleural thickening in tuberculous?[J].Chest,1997,112(5):1293⁃1297.
[2]YUAN M I,TONG Z H,JIN X G,et al.Regulation of CD4+T cells by pleural mesothelial cells via adhesion molecule⁃depen⁃dent mechanisms in tuberculous pleurisy[J].PLoS One,2013,8(9):e74624.
[3]ONCEL M,REMZI F H,SENAGORE A J,et al.Comparison of a novel liquid(Adcon⁃P) and a sodium hyaluronate and carboxymethylcellulose membrane(Seprafilm)in postsurgical adhesion formation in a murine model[J].Diseases Colon&Rectum ,2003,46(2):187⁃191.
[4]张艳,郑建,黄捷晖,等.胸腔镜下结核性胸膜炎胸膜粘连程度的判定及相关因素分析[J].南京医科大学学报(自然科学版),2012,32(10):1422⁃1425.
[5]KWON J S,CHA S I,JEON K N,et al.Factors influencing re⁃sidual pleural opacity in tuberculous pleural effusion[J].J Ko⁃rean Med Sci,2008,23(4):616⁃620.
[6]WANG Z,XU L L,WU Y B,et al.Diagnostic value and safety of medical thoracoscopy in tuberculous pleural effusion[J].Re⁃spiratory Medicine,2015,109(9):1188⁃1192.
[7]吴欢欢,李玉萍,官岚.结核性胸膜炎患者内科胸腔镜表现[J].实用医学杂志,2012,28(8):1310⁃1312.
[8]KAUFMANN S H,COLE S T,MIZRAHI V,et al.Mycobacte⁃rium tuberculosis and the host response[J].J Exp Med,2005,201(11):1693⁃1697.
[9]肖玲,温武金,辜海文,等.Th细胞免疫与结核性胸膜炎胸膜粘连关系的研究[J].中国实用内科杂志,2008,28(2):116⁃118.
[10] 戈启萍,贺正一,高微微,等.流式细胞术检测特异性刺激后淋巴细胞亚群变化对结核性胸腔积液的诊断价值[J].中华结核和呼吸杂志,2013,36(6):406⁃410.
[11] BEHAR S M,SASSETTI C M.Immunology:fix the odds against tuberculosis[J].Nature,2014,511(7507):39⁃40.
[12] 吴文奇,谢永平,彭彩红,等.联合检测ADA和PCT在结核性胸膜炎诊断及鉴别诊断中的应用[J].现代医院,2017,17(3):456⁃457,460.
[13] XIONG W J,DONG H P,WANG J J,et al.Analysis of plasma cytokine and chemokine profile in patients with and without tu⁃berculosis by liquid array⁃based multiplexed immunoassays[J].PLoS One,2016,11(2):e0148885.
[14] 孙勇.电子纤支镜在胸腔积液诊治中的临床价值分析[J].现代医院,2016,16(1):57⁃59.
[15] TONG Z H,SHI H Z.Subpopulations of helper T lymphocytes in tuberculous pleurisy[J].Tuberculosis,2013,93(3):279⁃284.
[16] LI L,QIAO D,LI Q,et al.Distinct polyfunctional CD4+T cell responses to BCG,ESAT⁃6 and CFP⁃10 in tuberculous pleurisy[J].Tuberculosis,2012,92(1):63⁃71.
[17] KIROPOUIOS T S,KOSTIKAS K,OIKONOMIDI S,et al.Acute phase markers for the differentiation of infectious and ma⁃lignant pleural effusions[J].Respir Med,2007,101(5):910⁃918.
[18] SEISCENTO M,VAEGAS F S,ACENCIO M M,et al.Pleural fluid eytokines correlate with tissue inflammatory expression in tuberculosis[J].Int J Tuberc Lung Dis,2010,14(9):1153⁃1158.
