C5a⁃C5aR在棕榈酸诱导的小胶质细胞炎症中的作用及机制
2018-05-17刘艳徐三清龙文君卢慧玲
刘艳 徐三清 龙文君 卢慧玲
华中科技大学同济医学院附属同济医院儿科(武汉 430030)
近年来,母亲长期高饱和脂肪酸饮食与子代神经系统发育异常之间的关系受到广大学者的重视。母亲摄入的饱和脂肪酸均可通过胎盘和母乳传递给胎儿及新生儿[1-2]。此外,血液中的脂肪酸能以游离形式弥散通过血脑屏障。研究[3-4]表明高脂饮食诱导的肥胖小鼠,脂肪组织C5a及C5aR表达明显升高。C5a是补体C5的活化片段。高脂饮食可诱导补体系统激活,补体活化产物C5a通过与其受体C5aR结合,参与异常代谢信号诱发的炎症反应[4]。但C5a⁃C5aR信号在暴露于母亲高饱和脂肪酸饮食的子代脑组织炎性损伤中的作用及机制,还很少有研究涉及。研究表明,在原代培养的星形胶质细胞中给予饱和脂肪酸——棕榈酸(palmitic acid,PA)干预后显著增加星形胶质细胞炎性细胞因子 TNF⁃α、IL⁃6的释放,给予 p44/42 MAPK(ERK1/2)抑制剂后,能阻止PA诱导的星形胶质细胞炎性因子的释放[5]。表明饱和脂肪酸可能通过激活MAPK信号途径中的ERK通路介导脑组织炎症反应。但高脂诱发的C5a⁃C5aR激活是否也是通过ERK通路从而诱发小胶质细胞炎症反应尚不清楚。
PA是饱和脂肪酸家族的重要成员之一。本实验拟通过PA及C5aR拮抗剂干预原代培养的小胶质细胞,观察ERK mRNA及蛋白、小胶质细胞炎性因子表达情况,旨在探讨脂肪酸对小胶质细胞炎症的影响及C5a⁃C5aR在此过程中的作用及可能机制。
1 材料与方法
1.1 一般材料 出生后1 d的小鼠,由华中科技大学同济医学院实验动物中心提供,动物许可证号为SCXK(鄂)2010⁃0009。荧光定量PCR试剂(Western Biotechnology),SYBR Green I(上海开放科技,中国),一抗:Iba1、ERK1/2、p⁃ERK1/2(Ab⁃cam),内参一抗(sigma,美国),二抗:羊抗兔IgG、羊抗小鼠 IgG(sigma,美国),TNF⁃α ELISA 试剂盒。荧光定量PCR仪 FTC2000(Canada),垂直板电泳转移装置(Bio⁃Rad,美国),图像分析系统(LabworksTM Analysis Softwar,美国),电泳仪(Bio⁃Rad,美国),酶标仪(美国宝特Bio⁃Tek),酶联免疫检测仪(美国宝特Bio⁃Tek)。
1.2 小鼠小胶质细胞原代培养 新生24 h内清洁级小鼠,购于华中科技大学同济医学院实验动物中心。75%酒精消毒新生小鼠,在无菌条件下断头,剪开头皮及颅骨,取出脑组织,置于盛冷的pH 7.2无钙、镁的D⁃Hank′s液的平皿中。无菌剥离脑组织,除去小脑、海马、大脑髓质,分离大脑皮层。用虹膜剪将组织剪切成1 mm3左右的组织块,0.125%胰蛋白酶消化,37℃作用20 min。弃去上清液,加入完全接种液终止消化,漂洗2次。吸管轻轻吹打至肉眼观察无明显的脑组织团块,静置2 min。悬液收集于新的离心管,离心(1 000 r/min,10 min,4℃),弃去上清液。加入完全培养液重悬,200目不锈钢网过滤。置37℃、5%CO2培养箱培养24 h后更换一次培养基,以后每3天换一次液。
细胞培养14~16 d左右,在倒置相差显微镜下可观察到混和胶质细胞培养物中出现细胞分层现象。用0.05%胰酶2~3 mL消化,待贴附在星形胶质细胞上的小胶质细胞脱离下来,将含漂浮的小胶质细胞的消化液转入10 mL离心管,1 000 r/min,离心5 min,弃上清;加定量完全培养再次吹打成细胞悬液,接种于预先包被的置有盖玻片的24孔培养板,置于CO2恒温细胞培养箱培养。生长24 h后吸掉培养液,以去除未贴壁的少突胶质细胞,加完全培养液继续培养。
1.3 免疫组化检测小胶质细胞Iba1表达 细胞用消化液消化后,用完全培养基重悬调整细胞密度至2×104/mL。在无菌的12孔板中铺上细胞爬片。取细胞悬液分别滴到圆片上,让细胞贴片30 min。在培养皿中补加完全培养液,37℃,5%CO2培养箱中培养。取出培养皿,用PBS漂洗2次;4%多聚甲醛固定20 min;PBS漂洗;1%Triton X⁃100 处理15 min;PBS漂洗;3%H2O2处理15 min;PBS漂洗。
山羊血清室温封闭60 min;取出甩干封闭液;一抗孵育(稀释比1∶200)4℃过夜。阴性对照用PBS液代替一抗;PBS清洗标本3次;生物素标记二抗工作液孵育37℃30 min;PBS清洗标本;碱性磷酸酶标记的链霉卵白素工作液37℃30 min;PBS清洗标本;DAB显色(避光,镜下观察至棕色)10 min;蒸馏水洗2次;苏木素复染5 min;自来水洗返蓝;梯度酒精脱水75%、85%、95%、100%各3 min;二甲苯透明2次;中性树胶封片。
1.4 QT⁃PCR检测ERK1/2的mRNA表达 试验共分 3组:对照组、PA(200 μmol/L)处理组、PA(200 μmol/L)+PMX53(100 nmol/L)处理组[5-6]。采用荧光定量PCR SYBR green I法进行检测,引物见表1所示(mactin作为内参)。采用TRIzol试剂法提取细胞内总RNA,反转录mRNA为cDNA,采用20 μL体系进行逆转录,条件为:25 ℃ 10 min;42 ℃50 min;85 ℃ 5 min。荧光定量PCR采用50 μL体系进行扩增,扩增条件为:94℃4 min;94℃ 20 s、60℃30 s、72℃30 s循环35次,72℃检测信号。

表1 荧光定量PCR引物列表Tab.1 Fluorescence quantitative PCR primer list
1.5 Western blot检测Iba1、ERK1/2和p⁃ERK1/2蛋白表达 试验分组同上。采用Western blot检测Iba1、ERK1/2和p⁃ERK1/2蛋白在PA和PA+C5aR拮抗剂处理组中的表达。采用RIPA buffer裂解法对细胞进行裂解,提取总蛋白。BCA法测定蛋白浓度。对不同试验组中的蛋白样品进行SDS⁃PAGE电泳:4%的浓缩胶和10%的分离胶,样品与5×SDS上样缓冲液按4:1比例混合,混匀后沸水中煮5 min使蛋白变性。80 V跑过浓缩胶后转换电压至120 V,待溴酚兰跑到胶板底部即可。电泳结束后采用PVDF膜进行转膜实验,将电流调整到恒流200 mA,转移约1 h。
用封闭液将对应的一抗稀释成一定的浓度(1∶500),内参一抗的稀释终浓度为1∶3 000,然后温育1.5 h。用TBST清洗3次,每次5 min。用封闭液将二抗稀释成一定的浓度(1∶3 000),然后温育1.5 h。用TBST清洗4次,每次5 min。将A和B两种试剂在试管内等体积混合,然后加在PVDF膜的正面,温育大概2 min。进入暗室,PVDF膜上盖一层保鲜膜,擦去多余的发光剂。依照发光的强度选择不同的曝光时间将胶片放入显影液中,出现条带后,立即放入定影液中,流水冲洗胶片后晾干。对胶片进行扫描,用UVP凝胶图象处理系统Labworks 4.6软件分析目的条带的灰度值。
1.6 ELISA检测TNF⁃α的表达 采用ELISA试剂盒检测小鼠TNF⁃α的表达水平。首先制作各细胞因子的标准曲线,然后根据测定的各样品OD值算出细胞因子数值。
1.7 统计学方法 采用GraphPad Prism5对结果进行统计学分析,数据以均数±标准差表示,多组之间总体均数比较使用one⁃way ANOVA,两组间比较采用 Student⁃t检验。
2 结果
2.1 小鼠小胶质细胞的原代培养及鉴定 本研究成功构建小鼠小胶质细胞的原代培养(图1A),可用于后续实验。免疫组化结果显示,Iba1蛋白广泛分布于小鼠原代小胶质细胞中(图1B中棕色颗粒部分),表明小胶质细胞增殖状态良好。
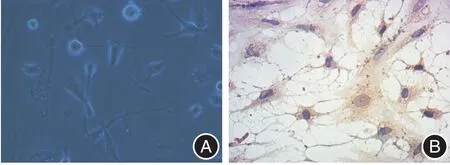
图1 小胶质细胞原代培养及鉴定(×400)Fig.1 Microglia primary culture and identification(× 400)
2.2 PA及PA+PMX53干预后小胶质细胞Iba1表达情况 200 μmol/L PA干预后,小胶质细胞Iba1蛋白表达较对照组明显提高(t=33.46,P<0.001);PA+PMX53组较PA组Iba1蛋白表达均有所下降(t=53.11,P<0.001)。见图2。
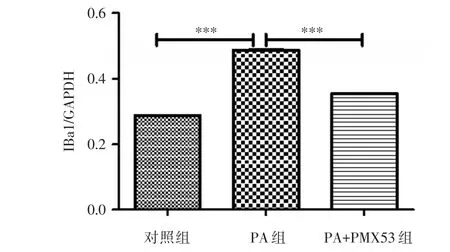
图2 各组Iba1蛋白表达Fig.2 The expression of Iba1 protein
2.3 PA及PA+PMX53干预后小胶质细胞ERK1/2 mRNA及蛋白表达情况 PA组较对照组ERK1/2 mRNA表达明显增加(t=13.3,P=0.005 6);PA+PMX53组较PA组ERK1/2 mRNA表达下降(t=16.78,P<0.001)。见图3A。各组ERK1/2蛋白表达均无差异,见图3B及3D。PA干预后,p⁃ERK1/2蛋白表达较对照组明显升高(t=204.1,P<0.001);PA+PMX53组较PA组p⁃ERK1/2蛋白表达下降(t=147.9,P<0.001)。见图3C及3D。
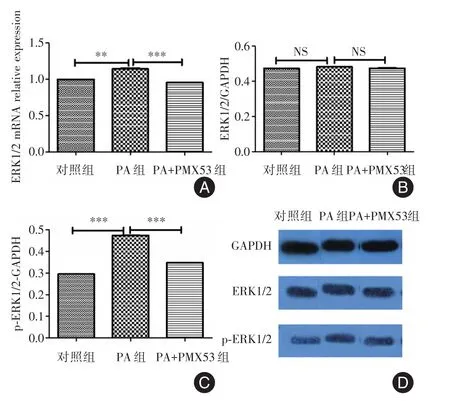
图3 各组ERK1/2 mRNA及蛋白表达Fig.3 The expression of ERK1/2 mRNA and protein
2.4 PA及PA+PMX53干预后小胶质细胞炎性因子表达情况 PA干预后,TNF⁃α表达均较对照组明显升高(t=26.69,P<0.001);PA+PMX53组较PA组TNF⁃α表达均有所下降(t=9.55,P=0.000 7)。见图4。

图4 各组TNF⁃α浓度Fig.4 The concentration of TNF⁃α in different groups
3 讨论
孕前期及孕期高脂饮食致母亲肥胖可以导致儿童及青少年认知功能异常、注意力缺陷多动障碍和精神异常等[7]。关于母亲长期高脂饮食导致子代神经系统发育异常的潜在机制并不清楚。有研究[8-9]认为与激发子代脑内与认知功能密切相关的部位如海马及大脑皮质炎症反应有一定关系。从侧脑室注射饱和脂肪酸后,脑组织中炎性细胞因子TNF⁃α、IL⁃6及IL⁃1β表达明显增加[10]。表明饱和脂肪酸可以诱导脑组织炎症反应。本研究采用体外细胞实验的方法,体外培养的小胶质细胞中加入PA干预后,小胶质细胞Iba1蛋白表达较对照组明显增加,相应的炎性因子TNF⁃α浓度也显著增加,表明PA诱导了小胶质细胞活化及炎症反应。
近年来,通过对C5aR特异性拮抗剂PMX205及C5aR基因敲除模型(C5aR-/-)在中枢神经系统炎性疾病中的研究,更进一步证实C5a⁃C5aR信号在中枢神经系统病变中起着重要的作用。在宫内炎性暴露的早产儿脑损伤及缺血性中风模型中,C5aR基因敲除的小鼠和使用C5aR拮抗剂的小鼠则显示神经元凋亡明显减少,脑组织病变减轻[6,11]。用PMX205治疗阿尔茨海默病12周后胶质细胞活化程度降低、Aβ聚集减少,记忆力改善[12]。PMX53是人工合成的环肽片段,也是C5aR的特异性拮抗剂,可阻断C5a的主要生物学效应,在许多损伤及炎症模型中被证实可减轻脑损伤、内毒素性休克、败血症、炎性肠病等多种炎症性损伤,取得了比较肯定的效果[13-14]。本研究也观察到,PMX53干预后,小胶质细胞Iba1蛋白表达及炎性因子TNF⁃α浓度均较PA组明显降低,表明PA可能通过C5a⁃C5aR诱导的小胶质细胞活化及炎症。
在中枢神经系统脱髓鞘病变中,C5a可通过激活星形胶质细胞和小胶质细胞的MAPK信号途径中的ERK1/2通路,诱导炎性细胞因子和趋化因子释放[15]。ERK是MAPK家族的重要成员,也是介导和调控细胞外信号到细胞内反应的重要激酶。ERK信号通路不仅与细胞的增殖和分化密切相关[16],而且在炎症反应中也具有重要作用[17]。总ERK1/2包括磷酸化ERK1/2(p⁃ERK1/2)和非磷酸化 ERK1/2,p⁃ERK1/2是 ERK1/2的活性形式。ERK通路是否参与了PA诱发的C5a⁃C5aR激活及小胶质细胞炎症反应?本研究结果显示PA干预后,尽管ERK1/2蛋白表达较对照组无明显差异,但ERK1/2 mRNA及p⁃ERK1/2蛋白表达较对照组明显升高;而给予C5aR拮抗剂后ERK1/2 mRNA及p⁃ERK1/2蛋白表达较PA组有所下降,表明ERK信号的活化与C5a⁃C5aR激活有一定关系,但C5a⁃C5aR激活是否通过ERK信号活化来诱导小胶质细胞炎症,尚需进一步研究如加用ERK的抑制剂。
综上所述,本研究表明PA可诱发小胶质细胞炎症反应,其作用机制可能通过C5a⁃C5aR,激活ERK1/2使其磷酸化,启动ERK1/2MAPK信号转导,进而激活小胶质细胞炎症。C5aR拮抗剂在炎症性损伤疾病具有神经保护作用。由于疾病的发展受很多条件影响,且在体内还有很多未知因素参与,所以仅通过体外实验不能很好地解释发病机制,在后期的实验中,笔者一方面在体外实验中增加ERK的抑制剂进一步阐明C5a⁃C5aR与ERK信号的关系,另一方面将通过体内实验着手C5a⁃C5aR在孕前期及孕期高脂饮食母亲子代脑组织炎症中的作用及机制研究,从而为代谢性炎症所致脑损伤性疾病研究提供策略与指导。
参考文献
[1]TOZUKA Y,WADA E,WADA K.“Bio⁃communication”be⁃tween mother and offspring:lessons from animals and new per⁃spectives for brain science[J].J Pharmacol Sci,2009,110(2):127⁃132.
[2]ZHU MJ,MA Y,LONG N M,et al.Maternal obesity marked⁃ly increases placental fatty acid transporter expression and fetal blood triglycerides at midgestation in the ewe[J].Am J Physiol Regul Integr Comp Physiol,2010 ,299(5):R1224⁃1231.
[3]ROY C,GUPTA A,CIANFLONE K,et al.C5a Receptor defi⁃ciency alters energy utilization and fat storage[J].PLos One,2013,8(5):e62531.
[4]PHIELER J,CHUNG K J,CHATZIGEORGIOU A,et al.The complement anaphylatoxin C5a receptor contributes to obese ad⁃ipose tissue inflammation and insulin resistance[J].J Immu⁃nol,2013,191(8):4367⁃4374.
[5]GUPTA S,KNIGHT A G,GUPTA S,et al.Saturated long⁃chain fatty acids activate inflammatory signaling in astrocytes[J].J Neurochem,2012 ,120(6):1060⁃1071.
[6]PAVLOVSKI D,THUNDYIL J,MONK P N,et al.Generation of complement component C5a by ischemic neurons promotes neuronal apoptosis[J].FASEB J,2012 ,26(9):3680⁃3690.
[7]VAN LIESHOUT R J.Role of materal adiposity prior to and dur⁃ing pregnancy in cognitive and psychiatric problems in offspring[J].Nutr Rev,2013,71(Suppl 1):S95⁃101.
[8]BILBO S D,TSANG V.Enduring consequences of maternal obesity for brain inflammation and behavior of offspring[J].FASEB J,2010 ,24(6):2104⁃2015.
[9]WHITE C L,PISTELL P J,PURPERA M N,et al.Effects of high fat diet on Morris maze performance,oxidative stress and inflammation in rats:Contributions of maternal diet[J].Neuro⁃biol Dis,2009 ,35(1):3⁃13.
[10] INGERSOLL S A,MARTIN C B,BARNUM S R,et al.CNS⁃specific expression of C3a and C5a exacerbate demyelination severity in the cuprizone model[J].Mol Immunol,2010 ,48(1⁃3):219⁃230.
[11] PEDRONI S M,GONZALEZ J M,WADE J,et al.Comple⁃ment inhibition and statins prevent fetal brain cortical abnormal⁃ities in a mouse model of preterm birth[J].Biochim Biophys Acta,2014 ,1842(1):107⁃115.
[12] FONSECA M I,AGER R R,CHU S H,et al.Treatment with a C5aR antagonist decreases pathology and enhances behavioral performance in murine models of Alzheimer′s disease[J].J Im⁃munol,2009 ,183(2):1375⁃1383.
[13] PROCTOR L M,STRACHAN A J,WOODRUFF T M,et al.Complement inhibitors selectively attenuate injury following ad⁃ministration of cobra venom factor to rats[J].Int Immunophar⁃macol,2006,6(8):1224⁃1232.
[14] RICKLIN D,LAMBRIS J D.Complement⁃targeted therapeu⁃tics[J].Nat Biotechnol,2007,25(11):1265⁃1275.
[15] MILANSKI M,DEGASPERI G,COOPE A,et al.Saturated fatty acids produce an inflammatory response redominantly through the activation of TLR4 signaling in hypothalamus:im⁃plications for the pathogenesis of obesity[J].J Neurosci,2009 ,29(2):359⁃370.
[16] 袁罡,刘勇,曾宏,等.晚期糖基化终末产物激活ERK1/2信号通路参与人主动脉血管平滑肌细胞增殖[J].实用医学杂志,2016,32(15):2430⁃2433.
[17] 张凡喜,张健民,陈鹏,等.丝裂原激活蛋白激酶/细胞外信号调节激酶1/2信号通路在大鼠蛛网膜下腔出血后早期脑损伤中的作用[J].中国脑血管病杂志,2015,12(4):192⁃198.
