猪瘟病毒E2蛋白在大肠杆菌中的表达及免疫原性分析
2018-05-17王冬雨刘运超崔颖磊张改平
王冬雨,魏 蔷,刘运超,刘 畅,3,杨 棋,崔颖磊,张改平,4*
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省农业科学院 动物免疫学重点实验室/河南省动物免疫学重点实验室/农业部动物免疫学重点实验室,河南 郑州 450002; 3.吉林大学 动物医学学院,吉林 长春 130012;4.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种严重危害养猪业的高度接触性传染病[1]。CSFV属于黄病毒科(Flaviridae)瘟病毒属(Pestivirus),是单股正链RNA病毒。基因组长约12.3 kb,仅含1个开放阅读框(ORF),编码4种结构蛋白(C、E0、E1、E2)和8种非结构蛋白(Npro、P7、NS2、NS3、NS4A、NS4B、NS5和NS5B)[2]。其中,E2蛋白是猪瘟的主要保护性抗原,含有约370个氨基酸,其常以同源或异源二聚体形式存在于感染细胞的表面以及病毒粒子的表面,可以刺激猪体内产生针对猪瘟病毒的中和抗体,是CSFV吸附和进入敏感细胞的必需蛋白[3]。CSFV中和抗体能够直接和E2蛋白抗原表位发生反应,阻止CSFV侵入细胞[4]。因此,E2蛋白成为研究各种CSFV基因工程疫苗的首要候选蛋白。
我国因疾病死亡的猪中有30%以上是猪瘟造成的,造成大量的经济损失以及巨大的人力和资源的浪费[5]。规范猪瘟疫苗接种能有效预防其发生,降低发病率和死亡率,最常用的是猪瘟弱毒疫苗[6]。但近年来,猪瘟发生情况由大流行转化为无规律散发流行,其免疫剂量的增加和免疫频率的加快,并未能有效及时地控制猪瘟疫情,反而有全国蔓延的趋势[7-8]。猪瘟兔化弱毒疫苗的普遍使用使得CSFV野毒株及猪瘟兔化弱毒株抗原发生变异,出现慢性感染、隐性感染等非典型流行形式[9],很难区分开猪群中疫苗免疫猪和野毒感染猪,导致疫情难以控制和免疫失败。因此,研制安全且可以进行鉴别诊断的新型基因工程亚单位疫苗是全世界养猪行业的迫切需求[10]。
有学者使用昆虫表达系统及酵母表达系统进行蛋白质表达[11],但存在周期长以及成本高、产量低等缺陷。我国学者涂长春等[12]构建了一系列DNA疫苗,动物试验结果表明,这些疫苗虽具有一定效果,但免疫效力有待提高。大肠杆菌系统表达目的蛋白具有操作简单、成本较低而表达量较高等特点。使用大肠杆菌表达E2蛋白,其目的蛋白主要以包涵体形式存在[13-14],从包涵体获得目的蛋白需要先将其变性再复性,过程繁琐易损耗目的蛋白,降低目的蛋白活性[15]。鉴于此,本研究通过表达条件的优化实现E2蛋白在大肠杆菌中的可溶性表达,从而获得大量具有较高活性的可溶性E2蛋白,最大程度还原目的蛋白天然结构,保持良好的反应原性和免疫原性,使用分子筛一步纯化有效节约了纯化成本和时间,以期为进一步研究基因工程亚单位疫苗及血清学诊断等奠定基础。
1 材料和方法
1.1 材料
1.1.1 质粒和菌株 pUC57-E2由上海生工生物工程股份有限公司合成;原核表达载体pET-28a、大肠杆菌JM109菌种和BL21(DE3)菌种购自大连宝生物公司;猪瘟HCLV株、猪瘟阳性血清、ST细胞等均由河南省动物免疫学重点实验室保存。
1.1.2 试剂 限制性内切酶NdeⅠ和XhoⅠ以及T4连接酶、质粒回收试剂盒、DNA胶回收试剂盒购自大连宝生物公司;IPTG购自北京索莱宝科技公司;羊抗猪IgG-HRP、BCA蛋白质定量试剂盒购自天根生物技术有限公司;PG200凝胶层析柱购自GE公司;AEC显色试剂盒购自中杉金桥公司;纳米材料(纳米二氧化钛,nano-TiO2)购自北京德科岛金科技有限公司;猪瘟商品疫苗购自广东永顺生物制药有限公司;gel 01佐剂购自法国SEPPIC公司;弗氏佐剂购自美国Sigma公司。
1.1.3 供试动物 30只6 周龄雌性BALB/C小鼠购自郑州大学实验动物中心。
1.2 重组表达载体的构建
合成pUC57通用引物,上游引入NdeⅠ酶切位点,下游引入XhoⅠ酶切位点,以重组质粒pUC57-E2为模板进行PCR扩增。PCR反应条件:95 ℃ 10 min;95 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 90 s,30个循环;72 ℃充分延伸10 min。PCR产物经NdeⅠ、XhoⅠ双酶切后回收,定向插入表达载体pET-28a中,构建重组质粒,转化JM109感受态细胞后经酶切及测序鉴定,将重组质粒命名为pET-28a-E2。
1.3 E2蛋白的诱导表达及鉴定
将重组质粒pET-28a-E2转化大肠杆菌BL21(DE3)后,将测序结果正确的阳性单个菌落按照1︰1 000比例接种在含有100 mg/L卡那霉素的LB液体培养基中,37 ℃、220 r/min条件下培养至OD600值约为0.6,加入终浓度为0.1 mmol/L的IPTG诱导表达6 h。收集菌体进行SDS-PAGE及Western blot鉴定。半干转膜法转移到PVDF膜上,50 g/L的脱脂奶粉封闭4 ℃过夜,加入400倍稀释的猪瘟阳性血清作为一抗,37 ℃孵育1 h,PBST洗涤6次,加入500倍稀释的羊抗猪IgG-HRP二抗,37 ℃孵育1 h,PBST洗膜后使用AEC显色液显色,去离子水终止后观察特异性条带。
1.4 E2蛋白的诱导表达条件优化
收集经IPTG诱导的菌体,超声裂解后12 000 r/min离心30 min,取上清和沉淀,进行 SDS-PAGE电泳。再对诱导表达温度、IPTG浓度及诱导时间进行优化。
1.4.1 诱导温度 挑取阳性克隆至含有卡那霉素的液体LB培养基中培养,当OD600值为0.6时进行诱导,IPTG终浓度为0.3 mmol/L,诱导温度分别为18、25、37 ℃,诱导时间为12 h,分别收集3个温度条件下的菌体,超声破碎后离心分离上清和沉淀,取样后进行SDS-PAGE鉴定,确定最佳温度。
1.4.2 IPTG浓度 挑取阳性克隆至含有卡那霉素的LB液体培养基中培养,当OD600值为0.6时,分别加入IPTG,使其终浓度为0.1、0.3、0.5、0.7 mmol/L,18 ℃诱导12 h,超声破碎后分别收集蛋白质上清和沉淀,取样后进行SDS-PAGE鉴定,确定IPTG的最佳诱导浓度。
1.4.3 诱导时间 挑取阳性克隆至含有卡那霉素的液体LB培养基中培养,当OD600值为0.6时,加入0.1 mmol/L的IPTG,18 ℃进行诱导,分别在诱导后12、16、20、24 h收集菌液并进行超声破碎,之后分离诱导蛋白上清和沉淀,分别进行SDS-PAGE鉴定,确定最佳诱导时间。
1.5 E2蛋白的纯化和鉴定
在IPTG终浓度为0.1 mmol/L时,18 ℃诱导16 h后,收集培养后的菌液8 000 r/min离心5 min,弃去上清收集菌体,菌体用Tris-HCl(pH=7)平衡液重悬,超声波破碎后4 ℃条件下12 000 r/min离心20 min,收集蛋白质上清。将5 mL样品载入PG200凝胶层析柱进行凝胶过滤分析,流速为0.5 mL/min,收集蛋白质组分,以猪瘟阳性血清为一抗、羊抗猪IgG-HRP为二抗进行Western blot鉴定。
1.6 E2蛋白活性检测
将经分子筛纯化过的重组蛋白包被酶标板,50 g/L的脱脂奶粉封闭。加入倍比稀释的猪瘟阳性血清,同时设置阴性血清对照,37 ℃孵育1 h,PBST洗涤6次,加入1 000倍稀释的羊抗猪IgG-HRP,37 ℃孵育45 min,PBST洗涤6次,显色后测定OD450值,分析目的蛋白的活性。
1.7 动物试验
将30只BALB/C小鼠随机分成5组,每组6只。A组:Tris-HCl阴性对照组; B组:阳性对照组,1/10头剂量的猪瘟商品疫苗;C组:E2蛋白加弗氏佐剂;D组:E2蛋白加弗氏佐剂加纳米材料;E组:E2蛋白加gel 01佐剂。分别采用皮下注射的方式进行免疫,在第1天进行一免和第28天进行二免,每7 d进行尾缘静脉采血。
1.8 中和抗体试验
采用免疫过氧化物酶单层试验(IPMA)检测小鼠血清猪瘟中和抗体水平。猪瘟HCLV株在ST细胞中培养3代使其毒力返强。血清用DMEM倍比稀释,加入等体积100TCID50病毒,37 ℃温箱中孵育1 h。PK-15细胞长至50%时弃上清加入血清病毒混合液,37 ℃孵育48 h;每孔加入100 μL预冷的无水乙醇-20 ℃固定30 min,弃去乙醇,用5%的脱脂奶粉4 ℃封闭过夜,PBST清洗5次;加入400倍稀释的猪瘟阳性血清作为一抗,37 ℃孵育1 h,PBST清洗5次;加入500倍稀释的羊抗猪IgG-HRP作为二抗,37 ℃孵育1 h,PBST清洗5次;每孔加入70 μL的AEC显色液,通过荧光显微镜观测细胞,计算猪瘟特异性中和抗体滴度。
2 结果与分析
2.1 pET-28a-E2重组载体的构建
以重组质粒pUC57-E2为模板进行PCR扩增,得到大小约为1 580 bp的目的片段。目的片段与载体pET-28a经NdeⅠ、XhoⅠ双酶切,回收酶切产物,连接后转化至JM109感受态细胞,挑取单克隆,提取重组质粒,经NdeⅠ、XhoⅠ双酶切鉴定,得到载体(约5 800 bp)和目的基因(约1 580 bp)2个片段(图1)。将鉴定的阳性克隆进行测序,结果表明,克隆得到阅读框序列正确的重组质粒pET-28a-E2。

M.DL2000 DNA Marker; 1.酶切产物图1 重组表达质粒pET-28a-E2酶切鉴定结果
2.2 E2蛋白的诱导表达结果
将鉴定正确的重组质粒转化至BL21(DE3)感受态细胞,在IPTG浓度为0.1 mmol/L的条件下诱导表达E2蛋白,收集菌液进行SDS-PAGE检测,在分子质量约63 ku处有明显可见的表达条带(图2),与E2蛋白预期大小一致。以猪瘟阳性血清为一抗、以羊抗猪IgG-HRP为二抗对表达产物进行Western blot鉴定,结果显示,63 ku处表达条带能够被猪瘟阳性血清识别,表明该条带为E2蛋白条带,E2蛋白在大肠杆菌中成功表达(图3)。
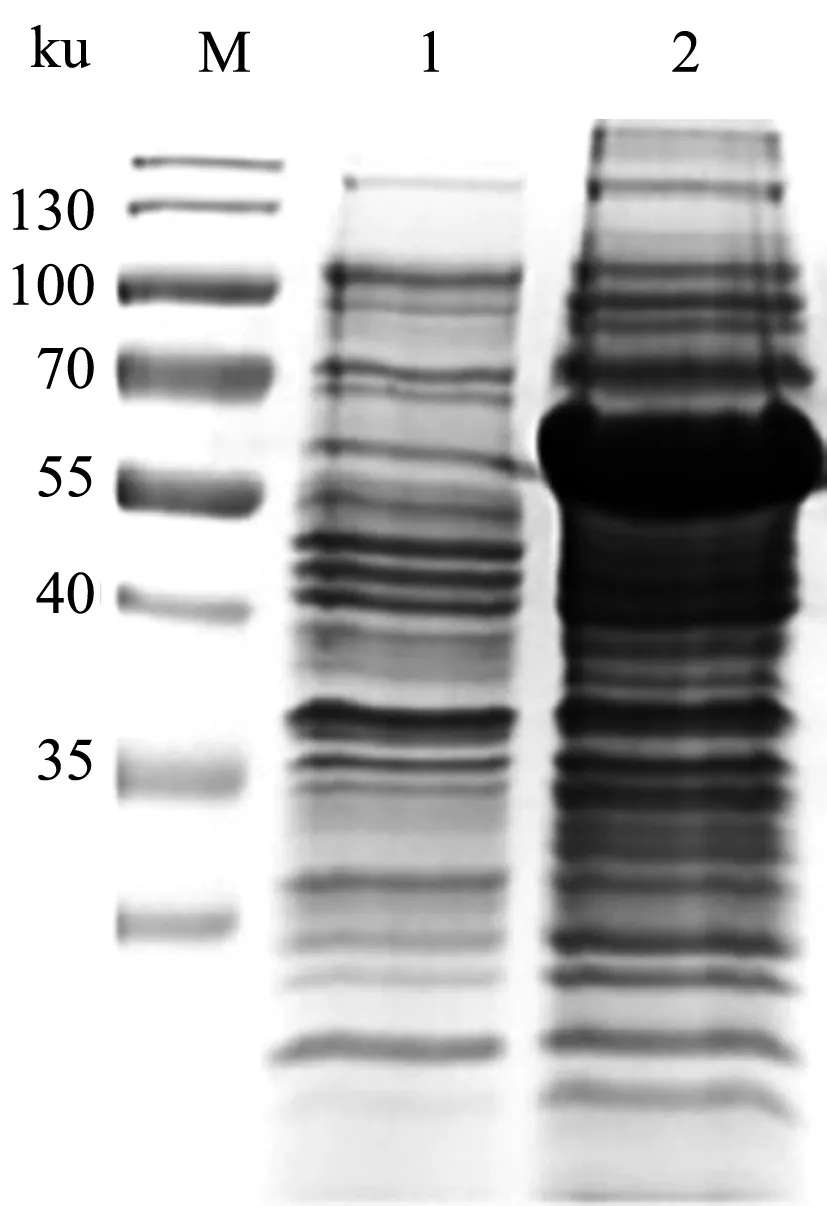
M.蛋白质Marker;1.诱导前菌液;2.IPTG诱导菌液图2 E2蛋白诱导表达结果
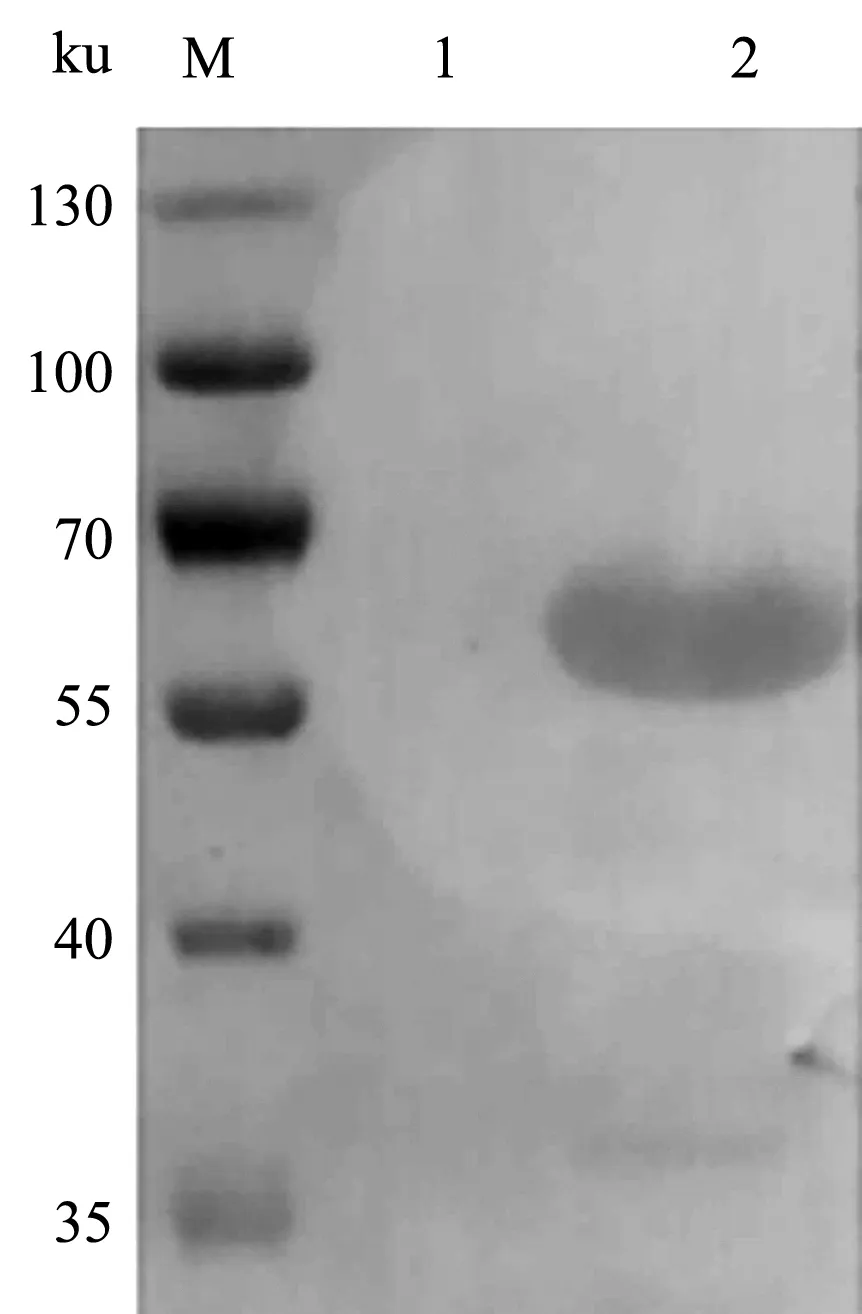
M.蛋白质Marker;1.诱导前菌液;2.IPTG诱导菌液图3 E2蛋白Western blot分析结果
2.3 E2蛋白诱导表达优化结果
对转化重组质粒的BL21(DE3)阳性克隆菌进行诱导温度的优化,IPTG终浓度为0.3 mmol/L,诱导时间12 h,诱导温度分别为18、25、37 ℃,收集菌体超声后进行SDS-PAGE,随着诱导温度的升高,上清中目的蛋白的含量减少,诱导温度在18 ℃时E2蛋白在上清中的含量最高(图4)。故选择18 ℃为最佳诱导温度。
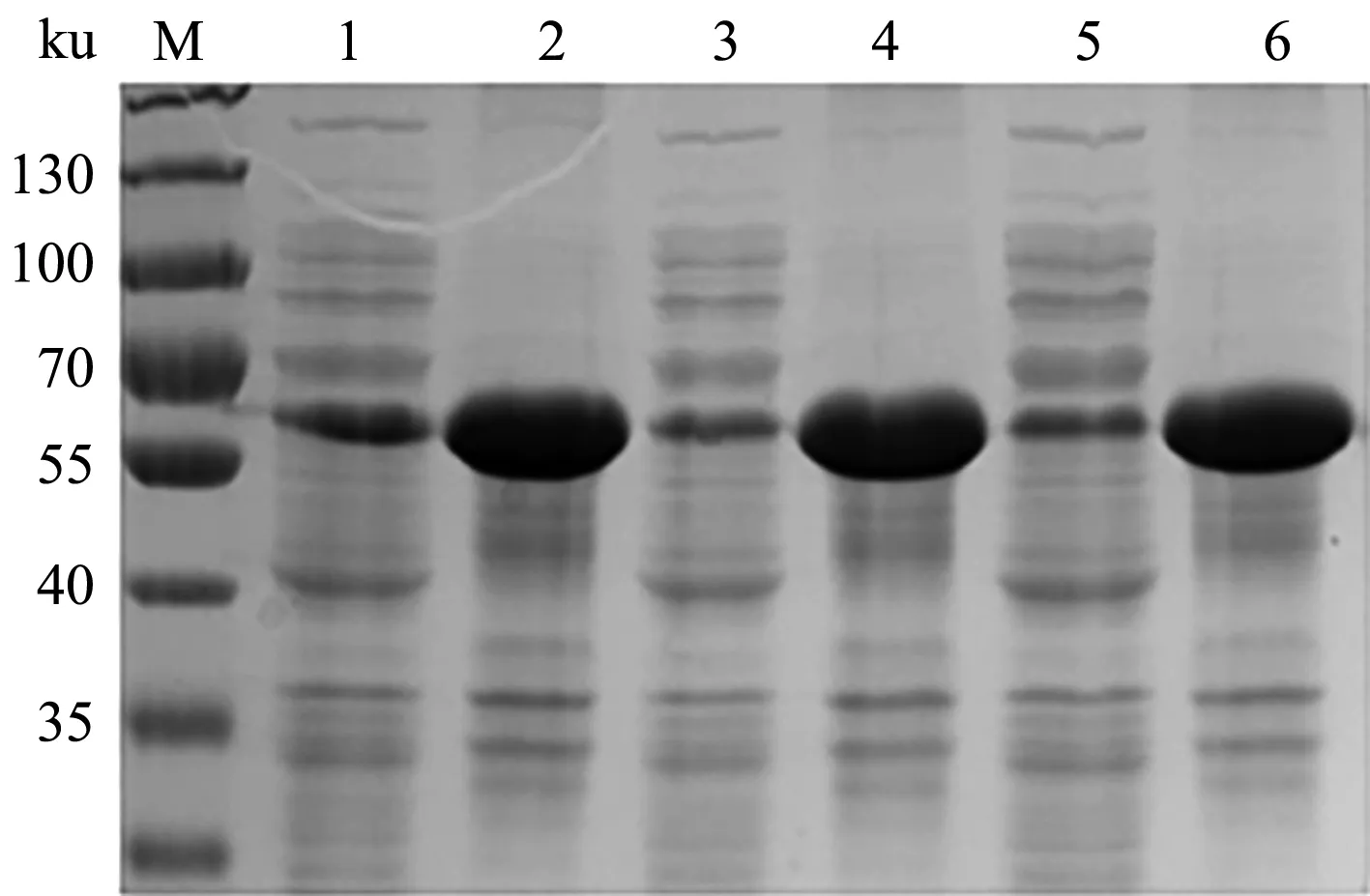
M.蛋白质Marker;1—6分别为在18、25、37 ℃诱导pET-28a-E2表达的菌体超声破碎上清和沉淀图4 E2蛋白诱导温度优化结果
18 ℃条件下,诱导时间12 h,IPTG浓度0.1、0.3、0.5、0.7 mmol/L,收集菌体超声后进行SDS-PAGE,结果显示,随着IPTG浓度的增加,E2蛋白表达量以及在上清中的含量并无明显变化(图5)。故选择IPTG浓度0.1 mmol/L为最佳诱导浓度。
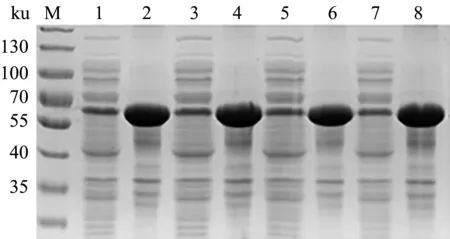
M.蛋白质Marker;1—8分别为IPTG浓度为0.1、0.3、0.5、0.7 mmol/L时pET-28a-E2诱导表达的菌体超声破碎上清和沉淀图5 E2蛋白诱导IPTG浓度优化结果
IPTG浓度为0.1 mmol/L,18 ℃条件下分别诱导12、16、20、24 h,收集菌体超声后进行SDS-PAGE,结果发现,随着诱导时间延长,上清中E2蛋白含量增加,在诱导时间为16 h时上清中E2蛋白的含量达到最高,之后随时间延长,E2蛋白含量减少(图6)。故选择16 h为最佳诱导时间。

M.蛋白质Marker;1—8分别为诱导时间为12、16、20、24 h的pET-28a-E2诱导表达菌体超声破碎上清和沉淀图6 E2蛋白诱导时间优化结果
2.4 E2蛋白的纯化和鉴定结果
E2蛋白纯化结果显示,经过凝胶过滤层析纯化后,杂蛋白得到有效的去除,E2蛋白纯度达到80%以上(图7)。以猪瘟阳性血清作为一抗,以羊抗猪IgG-HRP为二抗进行Western blot鉴定,结果表明,纯化的E2蛋白可以被猪瘟阳性血清特异性识别(图8)。

M.蛋白质Marker;1.E2蛋白纯化前上清;2.E2蛋白纯化后上清图7 E2蛋白纯化结果
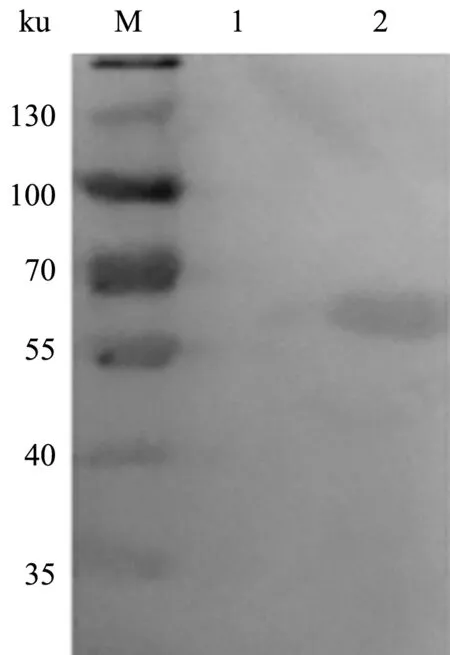
M.蛋白质Marker;1.诱导前菌液;2.E2蛋白纯化后上清图8 纯化E2蛋白Western blot鉴定结果
2.5 E2蛋白活性检测结果
将纯化后的E2蛋白以2 μg/孔的量包被酶标板,检测重组蛋白的活性。随着血清稀释度的增加,OD值呈下降趋势,当血清1∶3 200稀释时,阳性值仍在阴性值2.1倍以上(图9),表明纯化所得E2蛋白活性良好。

图9 E2蛋白活性检测结果
2.6 E2蛋白免疫原性检测结果
第1天和第28天对供试鼠分组进行免疫,并将每周采集的血清进行中和抗体检测。结果显示,Tris-HCl组未检测到中和抗体,3种不同佐剂组均能检测到中和抗体,E2加弗氏佐剂及纳米材料组中和抗体滴度最高,效果最佳,并在一免后56 d达到峰值(图10)。可见,纯化后的E2蛋白免疫原性良好。

图10 E2蛋白免疫原性检测结果
3 结论与讨论
虽然猪瘟弱毒苗在世界范围内已经得到了广泛应用,但猪瘟疫情仍有发生[16]。近年来,猪瘟弱毒苗免疫失败的报道频率持续增加,不当的免疫进度导致母源抗体干扰和免疫耐受造成猪瘟疫情的发生[17-18],以福建省福安县甘棠公社为例,全公社共发生猪瘟482头,患猪均经猪瘟兔化弱毒苗免疫[19]。此外,自然感染的毒株和接种疫苗感染的毒株是很难区分的,这些问题导致目前可用的减毒疫苗急需优化[20]。
E2亚单位疫苗具有安全性高、稳定性强的特点,是新型猪瘟疫苗的重点研究方向。E2蛋白是猪瘟病毒结构蛋白中最主要的保护性抗原[21-22],可以诱导机体产生高滴度的中和抗体,已成为研究猪瘟病毒基因工程亚单位疫苗的重要标靶[23]。前人用毕赤酵母表达系统、杆状病毒系统表达猪瘟E2蛋白,与猪瘟阳性血清均有反应,但效果均明显弱于C株弱毒苗。大肠杆菌遗传背景清晰,表达蛋白质具有操作简单方便、研究周期短、易于纯化、表达量高等特点[24],并且大肠杆菌表达系统对于蛋白质的分析和表达的干扰很少,是工业生产中比较理想的表达方式[25]。周景明等[26]在大肠杆菌中表达E2蛋白,但表达的E2蛋白均以包涵体形式存在,通过变性和复性则会损失大量目的蛋白和破坏蛋白质天然结构。本研究将pET-28a-E2重组质粒转化至大肠杆菌BL21(DE3)中表达,通过对诱导表达条件优化,成功实现E2蛋白在大肠杆菌中的可溶性表达,最大程度还原了蛋白质的天然结构。
传统纯化E2蛋白多采用Ni柱或阴阳离子交换柱,纯化中存在样品回收率和试验重复率不高等不利因素。本试验采用凝胶过滤层析纯化目的蛋白,利用具有网状结构的凝胶分子筛作用,根据被分离的蛋白质大小不同有效进行分离。凝胶过滤层析具有样品回收率高、试验重复率高和操作简便等多种优势,可以高效稳定地分离出目的蛋白。此外,本试验采用分子筛一步纯化得到纯度较高的E2蛋白,大大简化了纯化过程。
此前有研究表明,纳米二氧化钛作为一种典型的低毒纳米材料,对主要免疫细胞显示出免疫调节作用,其能刺激免疫细胞释放更多细胞因子,显著增强免疫反应[27-28]。本试验将大肠杆菌表达的E2蛋白与纳米二氧化钛材料和弗氏佐剂结合制成的基因工程亚单位疫苗进行动物试验,发现其具有良好的免疫原性。
猪瘟弱毒疫苗在我国应用广泛,其毒力返强现象客观存在,新型基因工程亚单位疫苗将有效解决这一问题。本研究利用大肠杆菌成功表达了可溶性良好的E2蛋白,且经过纯化的E2蛋白能够诱导产生较高水平的中和抗体,免疫原性良好,为下一步进行猪瘟病毒基因工程亚单位疫苗的研制和诊断方法建立奠定了基础。
参考文献:
[1] Moennig V, Floegel-Niesmann G, Greiser-Wilke I. Clinical signs and epidemiology of classical swine fever: A review of new knowledge[J]. The Veterinary Journal,2003,165(1):11-20.
[2] 许信刚,王丹,童德文.表达猪瘟病毒E2蛋白重组减毒鼠伤寒沙门氏菌活载体疫苗株的构建及动物免疫试验[J].中国兽医科学,2011,41(9):901-906.
[3] 范学政,徐璐,赵启祖,等.猪瘟兔化弱毒E2基因重组杆状病毒的构建及抗体制备[J].中国兽药杂志, 2015,49(1): 6-9.
[4] Hammond J M,Mccoy R J,Jansen E S,etal.Vaccination with a single dose of a recombinant porcine adenovirus expressing the classical swine fever virusgp55(E2) gene protects pigs against classical swine fever[J].Vaccine,2000,18(11/12):1040-1050.
[5] Sun S Q,Yin S H,Guo H C,etal.Genetic typing of classical swine fever virus isolates from China[J].Transboundary and Emerging Diseases,2013,60(4):370-375.
[6] Sun Y,Liu D F,Wang Y F,etal.Generation and efficacy evaluation of a recombinant adenovirus expressing the E2 protein of classical swine fever virus[J].Research in Veterinary Science,2010,88(1):77-82.
[7] Moormann R J,Van Gennip H G,Miedema G K,etal.Infectious RNA transcribed from an engineered full-length cDNA template of the genome of a pestivirus[J].Journal of Virology,1996,70(2):763-770.
[8] Lin M,Trottier E,Mallory M.Enzyme-linked immunosorbent assay based on a chimeric antigen bearing antigenic regions of structural proteins Erns and E2 for serodiagnosis of classical swine fever virus infection[J].Clinical and Diagnostic Laboratory Immunology,2005,12(7):877-881.
[9] 范学政,王琴,陈振海,等.猪瘟兔化弱毒株E2基因的原核表达及间接ELISA的初步建立[J].中国病毒学,2005,20(3):253-256.
[10] 李丽,陈弟诗,张毅等.猪瘟病毒及猪瘟疫苗的研究进展[J].当代畜牧,2014(24):48-49.
[11] Lee N H,Lee J A,Park S Y,etal.A review of vaccine development and research for industry animals in Korea[J].Clinical and Experimental Vaccine Research,2012,1(1):18-34.
[12] 涂长春,王文成,余兴龙,等.猪瘟病毒DNA疫苗的田间免疫试验及环境生物安全评价[C]//中华预防医学会.2005全国第二届核酸疫苗研讨会论文集.北京:[出版者不详],2005.
[13] 郭鹤.猪瘟病毒囊膜E2蛋白原核表达及初步应用研究[D].长春:吉林大学,2013.
[14] 刘伯华.猪瘟病毒E2基因在大肠杆菌中的高效表达及其表达产物的制备[D].长春:中国人民解放军军需大学,2002.
[15] 白羊,章永垒,邹有土,等.重组人βNGF在大肠杆菌中的可溶表达、纯化及活性鉴定[J]. 生物技术通报,2016,32(11):202-207.
[16] 唐红慧.猪瘟兔化弱毒苗抗原量测定方法的探索及不同免疫程序的差异性比较研究[D].扬州:扬州大学, 2010.
[17] Sorensen H P,Mortensen K K.Advanced genetic strategies for recombinant protein expression inEscherichiacoli[J].Journal of Biotechnology,2005,115(2):113-128.
[18] 杜立中,马霞,刘永录,等.黄芪多糖对猪瘟活疫苗免疫应答的佐剂作用[J].河南农业科学,2014,43(9):156-159.
[19] 郑旭升.乳猪用猪瘟兔化苗免疫失败原因浅探[J].畜牧与兽医,1982(2):88.
[20] Yu X,Tu C,Li H,etal.DNA-mediated protection against classical swine fever virus[J].Vaccine,2001,19(11):1520-1525.
[21] Wang Z,Nie Y,Wang P,etal.Characterization of classical swine fever virus entry by using pseudotyped viruses:E1 and E2 are sufficient to mediate viral entry[J].Virology,2004,330(1):332-341.
[22] 赵天生,张悦之,夏燕华.猪瘟病毒E(rns)蛋白RNase活性与免疫抑制功能的相关性研究[J].河南农业科学,2014,43(3):124-127,138.
[23] 田宏.猪水疱病和猪瘟基因工程亚单位疫苗的研究[D].杨凌:西北农林科技大学, 2006.
[24] Wensvoort G.Topographical and funcitional mapping of epitopes on hog cholera virus with monoclonal antibodies [J].Journal of General Virology,1989,70(11):2865-2876.
[25] Dong X N,Chen Y H.Candidate peptide-vaccines induced immunity against CSFV and identified sequential neutralizing determinants in antigenic domain A of glycoprotein E2[J].Vaccine,2006,24(11):1906-1913.
[26] 周景明,李鹏飞,张改平,等.猪瘟病毒E2蛋白在大肠杆菌中的表达及其可溶性分析[J].西北农业学报, 2015,24(11):24-28.
[27] 汪雪峰,董利阳,王钧,等.纳米材料与免疫系统的相互作用[J].江苏大学学报(医学版),2015,25(1):85-87,92.
[28] 姚晨婕. 纳米二氧化钛细胞毒性及免疫毒性机理研究[D].上海:上海大学,2016.
