干旱胁迫对桂花幼苗生长及生理生化特性的影响
2018-05-16廖亮吴家胜吴江尤民其
廖亮,吴家胜,吴江,尤民其
(1.乐清市雁荡山林场,浙江 乐清 325614;2.浙江农林大学,亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;3.台州市黄岩区农业林业局,浙江 黄岩 318020)
桂花(Osmanthusfragrans)是中国传统名花之一,有金桂、银桂、四季桂和丹桂四大品系,在我国有2 000多年的栽培历史[1-2],广泛分布在淮河流域及长江流域。而目前,对桂花的研究主要集中于桂花资源[2]、分类[3]、香味[4]、园林利用[5]等方面。水分是影响植物生长发育的重要环境因素之一,而干旱胁迫对植物造成的损失则是较为严重的[6-7]。桂花在生长过程中经常受季节性干旱的影响,而有关桂花在干旱胁迫下生长、生理生化响应及适应性调节等方面的研究尚未见报道,本文研究干旱环境下桂花幼苗对干旱胁迫的生理生化响应,为桂花的栽培提供科学的理论依据。
1 材料与方法
1.1 试验地自然概况
试验地点位于浙江农林大学智能大楼后面的试验大棚内,该地属亚热带季风气候,年平均气温16℃,极端最高气温42.1℃,极端最低气温-13.4℃,≥10℃年活动积温5 000℃左右,年均降水量1 600mm,年平均无霜期为237d,年日照时间1 774h。
1.2 试验材料
试验材料为一年生桂花实生幼苗,苗木生长基本一致,平均苗高24.8cm,平均地径为4.17mm,培养基质为沙壤土(每盆放3.5kg),置于加仑盆中(直径为18cm,高为20cm),下面垫1个塑料托盘(直径为20cm,高为2cm),以防止水肥的流失。2016年3月底定植于盆内,4月初和5月初各施肥1次,分2次施入。施肥量为每盆施尿素1.64g(含氮46%),过磷酸钙3.12g(含P2O512%),氯化钾0.94g(含K2O 60%)[8]。
1.3 试验方法
干旱试验设置5个干旱梯度,设置基质饱和含水量的75%作为对照(CK),饱和含水量的60%为W1处理,饱和含水量的45%为W2处理,饱和含水量的30%为W3处理,饱和含水量的15%为W4处理,每个梯度重复3次,各重复5盆。干旱处理于2016年7月5日开始,7月8日达到上述5个处理要求,利用称重法测量土壤水分含量,并于每天上午8点,补足其蒸发的水量。
1.4 指标测定方法
2016年8月8日时采集桂花苗木叶片的混合样(每株取3-4轮功能叶1片,作为混合样),每个处理测定3次。
超氧化物歧化酶(SOD)采用氮蓝四唑光化还原法测定,过氧化物酶(POD)采用愈创木酚法测定,可溶性糖(SS)采用蒽酮比色法测定,脯氨酸(SP)采用酸性茚三酮法测定,细胞膜透性用电导率法测定,丙二醛(MDA)采用硫代巴比妥酸含量的测定方法,叶绿素采用浸提法测定[9-10],苗高采用皮尺测定,地径采用电子游标卡尺测定,生物量采用称重法测定,所有指标重复测定3次。
1.5 数据分析
利用DPS软件对数据进行方差和主成分分析。
2 结果与分析
2.1 干旱胁迫对桂花生长的影响
从表1可以看出,桂花幼苗在干旱胁迫下生长受到不同程度的影响,经分析,干旱胁迫对桂花苗高、地径、根生物量和总生物量均有显著影响(W1处理下苗高除外),W4处理下,苗高、地径、根生物量和总生物量分别比对照下降了12.0%、25.7%、34.4%和36.0%。

表1 不同干旱胁迫程度对桂花幼苗生长的影响Tab.1 The changes of growth indexes after different treatments
2.2 干旱胁迫对桂花幼苗叶片酶活性和丙二醛含量的影响
表2表明,干旱胁迫下SOD活性和POD活性随着干旱加剧呈现先升后降的趋势,分别在W3和W2处理下达到峰值,各处理均显著高于对照;而丙二醛含量则随着干旱胁迫加剧一直处于增长的趋势,各个处理间差异显著。W4处理下,SOD活性、POD活性和丙二醛含量分别比对照上升21.3%、8.0%和108.2%。
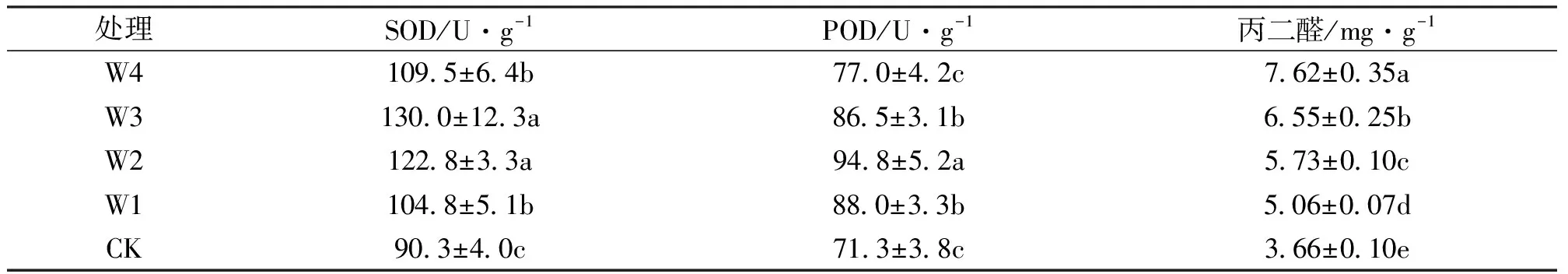
表2 不同干旱胁迫程度对桂花幼苗叶片酶活性和丙二醛含量的影响Tab.2 The changes of enzymatic activity and MDA content after different treatments
2.3 干旱胁迫对桂花幼苗叶片渗透调节物质及相对电导率的影响
由表3可知,随着干旱胁迫加剧,桂花幼苗叶片游离脯氨酸、可溶性糖及相对电导率呈现上升趋势,W4处理下,桂花幼苗叶片游离脯氨酸、可溶性糖及相对电导率分别比对照上升了117.9%、56.5%和91.3%,且和对照差异显著。
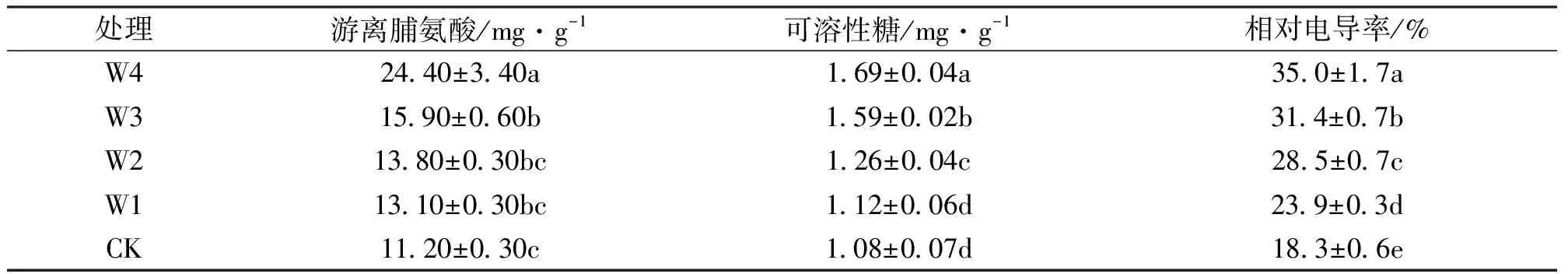
表3 不同干旱胁迫程度对桂花幼苗叶片渗透调节物质及相对电导率的影响Tab.3 The changes of osmotic adjustment and relative conductivity after different treatments
2.4 干旱胁迫对桂花幼苗叶片叶绿素含量的影响
从表4可以看出,随着干旱胁迫加剧,叶绿素a、叶绿素b和总叶绿素含量呈现下降的趋势,W4处理下,叶绿素a、叶绿素b和总叶绿素含量分别比对照下降了31.4%、30.6%和30.8%,且和对照差异显著。
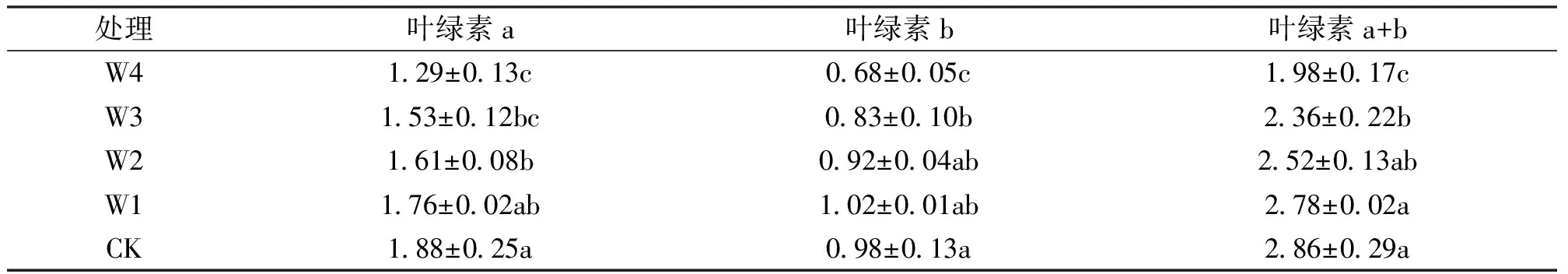
表4 不同干旱胁迫程度对桂花幼苗叶片叶绿素含量的影响Tab.4 The changes of chlorophyll content after different treatments mg/g
2.5 主成分分析
通过DPS软件对桂花幼苗叶片的13个指标进行主成分分析,得到样本相关矩阵的特征向量、特征值和累积贡献率(表5),前2个成分共累积贡献率为96.07%(第1主成分81.96%,第2 主成分14.11%)。第1主成分中,各项系数差异不大,能基本反映各指标的综合情况。第2主成分与POD、SOD值密切相关。
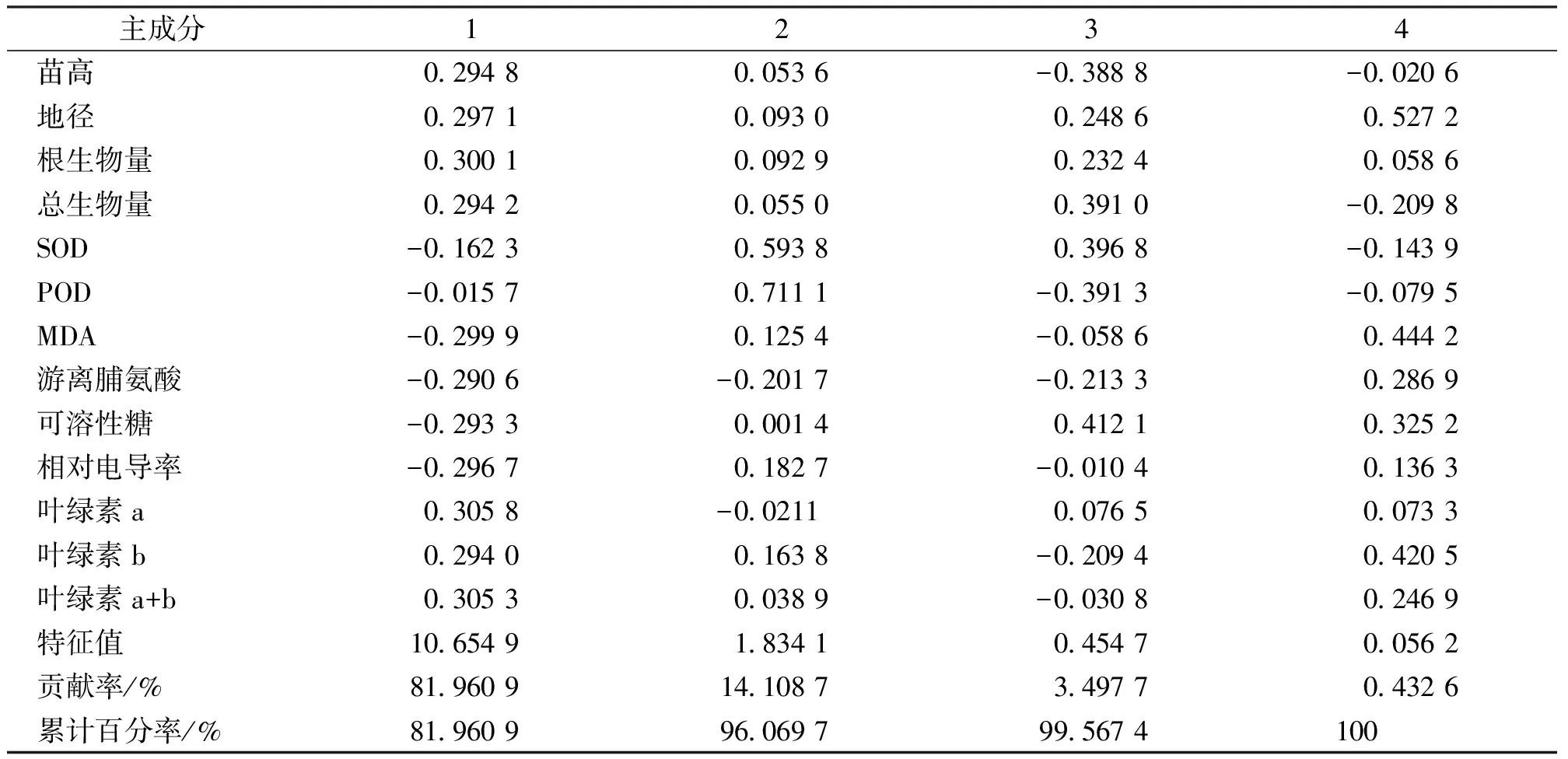
表5 干旱主成分特征向量、特征值及贡献率Tab.5 Characteristic vector,eigenvectors and percentages of accumulated contribution of principal components
3 结论与讨论
植物对干旱胁迫的响应表现在多方面,其中最直观的表现为干旱胁迫引起植物水分亏缺,影响植物的正常生长[11-12],使植物的各种生化活性受到影响,从而加快其组织、器官和个体的衰老[13],进一步影响植物的生长发育。本试验结果表明,不同干旱胁迫条件下,桂花生长(苗高、地径、根生物量、总生物量)受到不同程度的抑制,这与曹昀等[14]对芦苇(Phragmitesaustralis)幼苗的研究结果一致,表明桂花幼苗通过个体变小、生长速率减缓等策略来适应干旱胁迫。
干旱胁迫造成植物的伤害主要是导致细胞脱水,从而破坏细胞膜结构和功能。渗透调节是植物适应干旱胁迫的一种重要生理机制,植物细胞通过脯氨酸和可溶性糖的积累进行渗透调节,稳定细胞结构和功能,防止细胞脱水,从而维持细胞正常的生理过程[15-16]。脯氨酸是水溶性最大的氨基酸,Smirnoff证实外源脯氨酸对活性氧具有清除作用[17]。本研究中,干旱胁迫下,脯氨酸含量及可溶性糖显著高于对照,说明桂花通过脯氨酸及可溶性糖的积累来调节内渗透势以提高抗旱能力。可见,脯氨酸和可溶性糖是重要的渗透调节物质,这与吴敏等[18]对栓皮栎(Quercusvariabilis)的研究结果一致。
膜伤害学说认为,细胞中清除自由基保护酶系统的存在,是细胞免于伤害和抗性增强的主要原因之一[19-20]。SOD能将活性氧自由基清除而形成H2O2,而POD和CAT可把H2O2变为H2O[21]。因此,对活性氧的清除能力是决定细胞对胁迫抗性的关键因素[22]。MDA是脂质过氧化作用的产物之一,是检测细胞膜损伤程度的指标[18,23]。丙二醛的积累会引起蛋白质、核酸分子发生交联反应和变性、破坏膜和生物大分子物质[24]。本试验表明,随着胁迫的加剧,桂花幼苗体内SOD和POD活性呈现先升后降的趋势,但均高于对照,说明桂花在抵御干旱胁迫过程中,SOD、POD起到了积极的作用,同时,W1干旱胁迫条件下桂花叶片MDA和叶片相对电导率较对照显著升高(P<0.05),这可能与桂花耐旱性和长时间受到干旱胁迫有关。
植物抗旱机理较为复杂,植物通过多条途径抵御干旱对植物的伤害,不能采用单一指标对其进行抗旱评价。本试验对13个与抗旱相关指标进行主成分分析,发现2个主成分贡献了96.07%,这为抗旱指标筛选提供理论指导。
参考文献:
[1]臧德奎,向其柏.中国桂花品种分类研究[J].中国园林,2004(11):41-49.
[2]陈洪国,汪华.我国桂花种资资源的研究和利用及咸宁桂花发展现状[J].咸宁学院学报,2004,24(3):116-122.
[3]施远,施新程,黄旺志,等.豫南地区桂花品种园林应用价值综合评价[J].信阳师范学院学报(自然科学版),2017,30(2):224-227.
[4]杨秀莲,施婷婷,文爱林,等.不同桂花品种香气成分的差异分析[J].东北林业大学学报,2015,43(1):83-87.
[5]臧德奎,马燕,向其柏.桂花的文化意蕴及其在苏州古典园林中的应用[J].中国园林,2011(10):66-69.
[6]郭京衡,李尝君,曾凡江,等.2种荒漠植物根系生物量分布与土壤水分、养分的关系[J].干旱区研究,2016,33(1):166-171.
[7]孙琪,蔡年辉,陈诗,等.干旱胁迫对云南松苗木生理特征的影响[J].西南林业大学学报,2016,36(3):18-22.
[8]李梅,吴江,吴家胜,等.杨桐苗期施磷效应研究[J].浙江林学院学报,2010,27(2):223-227.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001.
[10]汤章城.现代植物生理学实验指南[M].北京:科学出版社,1999.
[11]王飞,刘世增,康才周,等.干旱胁迫对沙地云杉光合、叶绿素荧光特性的影响[J].干旱区资源与环境,2017,31(1):142-147.
[12]武燕奇,郭素娟.5个板栗品种对干旱胁迫的生理响应及抗旱性评价[J].东北林业大学学报,2017,45(1):20-29.
[13]邹春静,韩士杰,徐文铎,等.沙地云杉生态型对干旱胁迫的生理生态响应[J].生态学报,2003,14(9):1446-1450.
[14]曹昀,王国祥,张聃.干旱对芦苇幼苗生长和叶绿素荧光的影响[J].干旱区地理,2008,31(6):962-969.
[15]孙存华,李扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561.
[16]吴强盛,夏仁学,张琼华.果树对水分胁迫反应研究进展[J].亚热带植物科学,2003,32(2):72-76.
[17]Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation[J].New Phytol,1993,25(1):27-58.
[18]吴敏,张文辉,周建云,等.干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响[J].生态学报,2014,34(15):4223-4233.
[19]Zhu J K.Salt and drought stress signal transduction in plants[J].Annual Review of Plant Biology,2002,53:247-273.
[20]张丹,任洁,王慧梅.干旱胁迫及复水对红松针叶和树皮绿色组织光合特性及抗氧化系统的影响[J].生态学杂志,2016,35(10):2606-2614.
[21]应叶青,郭璟,魏建芬,等.干旱胁迫对毛竹幼苗生理特性的影响[J].生态学杂志,2011,30(2):262-266.
[22]夏新莉,郑彩霞,尹伟伦.土壤干旱胁迫对樟子松针叶膜脂过氧化、膜脂成分和乙烯释放的影响[J].林业科学,2000,36(3):3-12.
[23]苏寒之,金建邦,祝遵凌.干旱胁迫对北美红栎幼苗生理特性的影响[J].东北林业大学学报,2014,42(8):34-39.
[24]蔡永萍,陶汉之,张玉琼.土壤渍水对小麦开花后叶片几种生理特性的影响[J].植物生理学通讯,2000,36(2):110-113.
