干旱胁迫下烟草脯氨酸杂种优势及相关基因差异表达分析
2018-05-14孟军吴迪夏志林喻奇伟王军刘双陈倩田茂竹李显航汪志威刘仁祥
孟军 吴迪 夏志林 喻奇伟 王军 刘双 陈倩 田茂竹 李显航 汪志威 刘仁祥


摘 要:為探讨干旱胁迫下烟草脯氨酸杂种优势的分子遗传基础,以抗旱性差异较大的7个烟草品种及其组配的10个杂交组合为材料,采用盆栽试验设置干旱胁迫处理,进行了烟草脯氨酸杂种优势及其相关基因差异表达分析。结果表明,干旱胁迫下烟草脯氨酸含量在胁迫早期持续增加,第14天后开始下降;杂交组合间脯氨酸含量性状杂种优势差异明显,中亲优势最高40.35、最低?51.66;强优势组合中脯氨酸合成关键酶基因P5CS和δ-OAT相对表达量明显高于弱优势组合,分别是弱优势组合的2.10倍、1.87倍;脯氨酸杂种优势与P5CS基因相对表达量在旺长期持续干旱7 d时存在显著正相关关系,与δ-OAT基因相对表达量在伸根期持续干旱14 d、旺长期持续干旱7 d和14 d呈显著或极显著的相关关系,相关系数分别为0.93、0.98和?0.96。结果显示,脯氨酸合成关键酶基因δ-OAT和P5CS的时序性上调或下调表达是相应时期烟草脯氨酸含量性状杂种优势形成的分子基础。
关键词:烟草;干旱胁迫;脯氨酸;杂种优势;基因差异表达
中图分类号:S572.03 文章编号:1007-5119(2018)02-0001-07 DOI:10.13496/j.issn.1007-5119.2018.02.001
Analysis of Proline Heterosis and Differential Expression of Relate Genes in Tobacco under Drought Stress
MENG Jun1, WU Di1, XIA Zhilin2, YU Qiwei3, WANG Jun2, LIU Shuang1, CHEN Qian1,
TIAN Maozhu1, LI Xianhang1, WANG Zhiwei1, LIU Renxiang1*
(1. Guizhou Key Laboratory for Tobacco Quality Research, Guiyang 550025, China; 2. Zunyi Tobacco Company, Zunyi, Guizhou 564000, China; 3. Bijie Tobacco Company, Bijie, Guizhou 551700, China)
Abstract: In order to explore the molecular genetic basis of proline heterosis in tobacco under drought stress, 7 tobacco varieties with different drought resistance and 10 hybrid combinations were used as materials, and drought stress treatments were set up to analyze proline heterosis and differential expression of related genes in tobacco by pot experiments. The results showed that the content of tobacco proline under drought stress increased continuously at the early stage and decreased after the 14th day. The heterosis of proline content in hybrid combinations was significantly different, and the proline content had the mid-parent heterosis with the highest value of 40.35 and the lowest of -51.66. The relative expression levels of the proline synthesis key enzyme genes P5CS and δ-OAT were significantly higher in the strong-dominant combinations, being 2.10 times and 1.87 times of those of the weak-dominant combinations, respectively. There was a significant positive correlation between the proline heterosis and P5CS gene relative expression after persistent drought for 7d at the vigorous growth stage. The correlations between the proline heterosis and δ-OAT gene relative expression were significant or extremely significant after persistent drought for 14d at the root extension stage and persistent drought for 7d and 14d at the vigorous growth, with correlation coefficients of 0.93, 0.98 and -0.96, respectively. Therefore, the up-regulation or down-regulation of δ-OAT and P5CS was the molecular basis for the formation of heterosis of tobacco proline content during the corresponding growth periods.
Keywords: Nicotiana tabacum; drought stress; proline; heterosis; gene differential expression
基金项目:贵州省科技厅人才团队建设项目“贵州省烟草品质遗传改良与生物转化科技创新人才团队”{黔科合人才团队[2015]4011号},贵州省高
层次创新型人才培养计划——百层次人才{黔科合平台人才[2016]5663号};贵州省烟草公司重大专项“优质烤烟品种选育关键技术研究
与品种选育”(黔烟科201602);贵州省烟草公司遵义市公司项目“遵义烟区烤烟品种筛选布局与后备品种选育研究”{遵烟计[2016]07号}
作者简介:孟 军(1993-),男,在读硕士研究生,研究方向:作物遗传育种。E-mail:1012506570@qq.com。*通信作者,E-mail:rxliu@gzu.edu.cn
收稿日期:2017-10-07 修回日期:2018-01-31
干旱胁迫是制约植物生长发育、影响作物产量和质量的主要逆境因素之一[1]。烟草对水分有较高的要求,其生长季节田间持水量低于50%,产量和品质会受到影响[2]。西南地区是我国烟叶的主产区,因其独特的生态环境,旱灾频发,且缺乏必要的灌溉条件,因此,降低烟草自身对水分缺乏的敏感性,选育利用抗旱品种已成为抵御干旱逆境的重要研究方向和有效途徑。干旱胁迫条件下,植物会迅速合成和积累大量的脯氨酸、甜菜碱等一系列的渗透调节物质,以游离状态存在于植物细胞中,以抵御干旱逆境;前人对抗旱性的研究主要集中在脯氨酸含量与抗旱性的关系、脯氨酸合成酶相关基因的鉴定克隆和转化方面[3-5],从大豆[6]、豌豆[7]、菜豆[8]、甘蔗[9-10]、拟南芥[11]、罗布麻[12]等植物中克隆出二氢吡咯-5-羧酸合成酶(P5CS)、Δ1-二氢吡咯羧酸还原酶(P5CR)和鸟氨酸-δ-氨基转移酶(δ-OAT)等多个与脯氨酸合成酶相关的基因;P5CS基因转化烟草[13]、冰草[14]、拟南芥[15],转基因植株中脯氨酸含量比野生型对照高几倍,对干旱逆境胁迫的抗逆性及耐受性显著增强;ROOSENS等[16]在烟草中超量表达δ-OAT基因,转δ-OAT烟草在非胁迫条件下合成脯氨酸能力是对照的4倍,对干旱等水分胁迫的耐受性显著提高。而有关烟草脯氨酸含量性状杂种优势的分子遗传基础研究未见报道,本研究以耐旱品种K326、南江三号、韭菜坪2号及干旱敏感品种毕纳一号、红花大金元、NC82、TN90及其组配的杂交组合为材料[17],采用盆栽试验,于烟草生长对水分敏感的伸根期和旺长期进行干旱胁迫处理,通过研究干旱胁迫条件下烟草脯氨酸含量累积的动态变化、脯氨酸性状的杂种优势表现、脯氨酸合成关键酶基因的表达及其与杂种优势的关系,旨在阐明脯氨酸性状杂种优势形成的分子遗传基础,为抗旱性烟草杂交种的选育提供理论依据。
1 材料与方法
1.1 材料
本研究选用耐旱品种K326、南江三号、韭菜坪2号及干旱敏感品种毕纳一号、红花大金元、NC82、TN90为亲本,同时以NC82、K326为母本,TN90、韭菜坪2号、毕纳一号、南江三号和红花大金元等5个品种为父本,组配了10个组合,共17个试验材料。
1.2 试验方法与设计
本试验在贵州大学烟草科研基地塑料大棚里进行,采用盆栽试验。试验用盆高45 cm、底径25 cm、口径35 cm。供试土壤为0~20 cm的烟田表层土(黄壤),土壤pH 5.53,有机质25.36 g/kg,全氮1.52 g/kg,有效磷17.35 mg/kg,速效钾190.26 mg/kg;经自然风干后过0.5 cm筛后装盆,每盆装土15 kg。每盆施烟草专用复合肥[m(N)∶m(P2O5)∶m(K2O)=10∶11∶25] 60 g,于2015年4月7日统一移栽,待生长到适宜处理时期进行干旱胁迫处理。干旱处理采用称重法控制土壤相对含水量,伸根期干旱处理的土壤相对含水量为田间最大持水量的30%~35%,连续干旱21 d;旺长期干旱处理的土壤相对含水量为田间最大持水量的35%~40%,连续干旱21 d。3次重复,每重复255盆。
1.3 测定项目及方法
1.3.1 取样方法 于持续干旱处理第7天、第14天和第21天上午7:00—8:00取中部叶片,每个重复随机取3株混合,保存于超低温冰箱中用于脯氨酸测定和提取RNA。
1.3.2 脯氨酸测定方法 参照苏州科铭生物技术有限公司脯氨酸(proline,pro)试剂盒说明书测定烟草植株中Pro活性。
1.3.3 样品总RNA提取与cDNA合成 参照OMIGA E.Z.N.A.TM Plant RNA Protocol II(for difficult samples)提取总RNA,cDNA合成的20 ?L反应体系按(High-Capacity cDNA Reverse Transcription Kit,ABI)试剂盒说明书进行。
1.3.4 Real-time PCR 根据NCBI数据库中报道的烟草脯氨酸相关基因P5CS、δ-OAT的基因序列,利用primer 5软件设计各基因表达引物,P5CS上游引物:5'- TGGGCATCAACTGGAGAGATAGG -3'、5'-CCTGAAGCCGCCTGGAACAT-3'; δ-OAT上游引
物:5'- ACAGCTCTTAAGCTGGCAAGGA -3'、下游引物:5'-ACAACTCATGGAGATTGCAGCCA-3'。以烟草Actin基因(上游引物:5'-GGTAGCTC CACCTGAGAGGAAGT-3'、下游引物:5'-GCCTTT GCAATCCACATCTGT-3')为内参基因。
实时定量PCR操作根据ABI Power SYBR?Green PCR Master Mix使用操作说明进行。Real-time PCR的反应体系为:Power SYBR Green PCR Master Mix(2×)10 ?L,引物1 1.0 ?L,引物2 1.0 ?L,cDNA 4.0 ?L,ddH2O 4.0 ?L。扩增条件为:95 ℃ 10 min;95 ℃ 15 s;60 ℃ 1 min,40个循环。每个样品取样3次,每次设置3个重复。根据Actin基因的表达量,以2-ΔΔCt法计算各基因相对表达量。
1.3.5 统计分析方法 本研究采用比较阈值法(2-ΔΔCt)对强弱优势组合中P5CS、δ-OAT基因的Real-time PCR测定结果进行相对定量分析,2-ΔΔCt=2-(杂交组合ΔCt-双亲平均ΔCt),其中:ΔCt=目的基因Ct-内参ActinCt,双亲平均ΔCt=(父本ΔCt-母本ΔCt)/2。采用SPSS 20.0、Excel 2013和DPS 14.10统计软件对脯氨酸含量性状的杂种优势、脯氨酸合成关键酶基因的表达量及其与脯氨酸含量和杂种优势的相关性进行统计分析。其中杂种优势计算公式为:
超亲优势=(F1-HP)/HP×100
中亲优势=(F1-MP)/MP×100
式中,MP为双亲平均值;HP为高亲值;F1为杂种一代性状平均值。
2 结 果
2.1 干旱胁迫下不同材料脯氨酸含量差异分析
由不同亲本间脯氨酸含量测定结果(表1)看出,亲本间烟叶脯氨酸含量差异极显著,且在两个处理时期的表现趋势基本一致;K326和南江三号品种的脯氨酸含量最高,且差异不显著,但极显著高于其他5个亲本。结果说明改良烟草脯氨酸含量的现有品种资源较为丰富。
由不同组合间脯氨酸含量测定结果(表1)看出,组合间烟叶脯氨酸含量差异极显著,在两个处理时期的表现趋势不完全一致;K326×南江三号、NC82×南江三号组合在两个处理时期的脯氨酸含量均较高。结果说明,采用优势育种可以选育出脯氨酸含量高的杂交种。
表1 7个亲本和10个杂交组合脯氨酸含量
Table 1 Proline content of 7 parents and 10 cross combinations μg/g
亲本
Parent 伸根期
Root extension stage 旺长期
Vigorous growth stage
南江三号Nanjiang No.3 812.40aA 924.53aA
K326 752.65aA 867.87aA
毕纳一号Bina No.1 489.66bB 544.98bB
韭菜坪2号Jiucaiping No.2 477.71bcB 542.24bB
红花大金元
Honghuadajinyuan 389.66bcB 451.14bB
TN90 365.14cB 498.02bB
NC82 364.24cB 424.66bB
K326×TN90 523.33aA 499.38eC
NC82×毕纳一号
NC82×Bina No.1 521.21aA 533.40deC
K326×韭菜坪2号
K326×Jiucaiping No.2 507.56aA 565.09cdeC
K326×南江三號
K326×Nanjiang No.3 505.16aA 871.93aA
NC82×TN90 505.16aA 647.47bcBC
NC82×红花大金元
NC82×Honghuadajinyuan 496.92aA 544.88cdeC
NC82×南江三号
NC82×Nanjiang No.3 492.68aA 721.62bB
NC82×韭菜坪2号
NC82×Jiucaiping No.2 447.16aA 539.22deC
K326×毕纳一号
K326×Bina No.1 454.51aA 640.02bcdBC
K326×红花大金元
K326×Honghuadajinyuan 276.08bB 546.33cdeC
注:表中数值为干旱胁迫第7天、第14天、第21天的平均值,分别对亲本和组合进行差异分析,小写和大写字母不同分别表示在5%和1%水平差异显著性。
Note: The values in the table are the mean values of the 7th, 14th, and 21st days of drought stress. The differences between the parent and the combination are respectively analyzed. The difference between Lowercase and uppercase letters indicates that the difference is significant at the level of 5 % and 1 %, respectively.
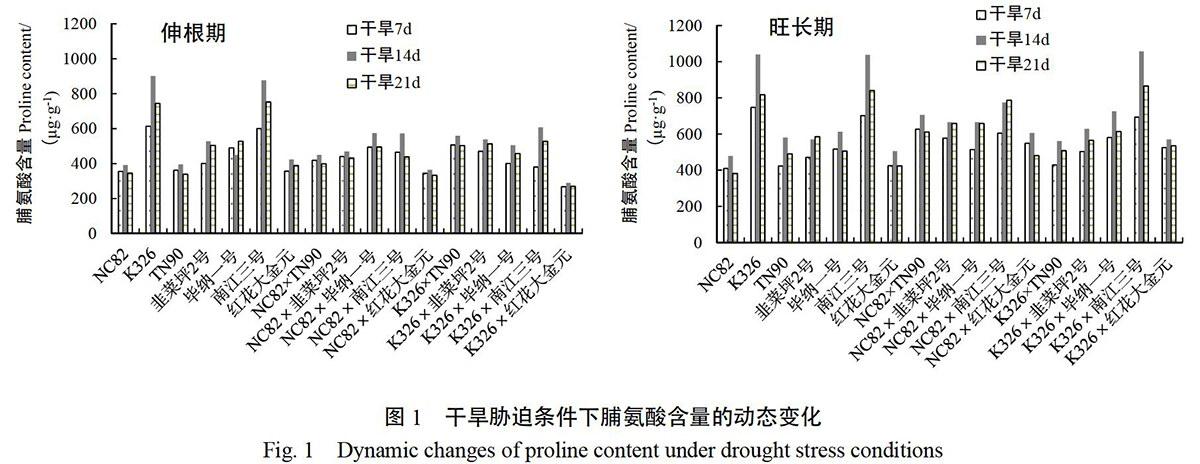
2.2 干旱胁迫条件下脯氨酸含量的动态变化
由不同时期干旱胁迫处理参试材料不同天数的脯氨酸含量测定结果(图1)看出,所有参试材料的烟叶脯氨酸含量动态变化基本一致,在干旱胁迫处理初期随着干旱的持续而增加,除韭菜坪2号、NC82×南江三号等材料外,其余14个参试材料在干旱胁迫持续14 d后开始下降。结果说明14 d是
图1 干旱胁迫条件下脯氨酸含量的动态变化
Fig. 1 Dynamic changes of proline content under drought stress conditions
烟株对干旱反应的转折点,干旱胁迫初期,烟株通过增加脯氨酸含量来增加细胞的持水力,维持细胞正常代谢;干旱持续14 d后,烟株生理机能受到严重伤害导致脯氨酸的合成能力下降;抗旱性强的材料抵御生理伤害持续的时间长,脯氨酸含量下降的时间延后。
2.3 干旱胁迫条件下烟叶脯氨酸含量性状的杂种优势表现
由杂交组合脯氨酸含量性状的杂种优势计算结果(表2)看出,各杂交组合间脯氨酸含量性状的杂种优势差异较大,NC82×红花大金元、NC82×TN90组合脯氨酸含量性状的杂种优势较高,K326×TN90、K326×红花大金元组合脯氨酸含量性状的杂种优势较低,可作为强、弱优势代表组合用于脯氨酸含量性状杂种优势的基因差异表达分析。
2.4 干旱胁迫条件下脯氨酸合成关键酶基因表达分析
由干旱胁迫下脯氨酸合成关键酶基因相对表达量测定结果(图2)看出,脯氨酸合成关键酶基因在不同优势组合间的相对表达量有明显差异,P5CS和δ-OAT基因在强优势组合中的相对表达量明显高于弱优势组合,分别是弱优势组合的2.10倍、1.87倍。不同脯氨酸合成关键酶基因在不同组合内的相对表达量和表达时序有差异,NC82×红花大金元组合中P5CS和δ-OAT基因的相对表达量均是伸根期持续干旱14 d达到最高,分别是亲本平均表达量的6.46倍、5.37倍,且66.7%的时序点超过双亲平均表达量;NC82×TN90组合中P5CS基因的相对表达量在旺长期干旱14 d时最高,为亲本平均表达量的13.9倍,而δ-OAT基因的相对表达量在不同时期的变化较小,且83.3%的时序点超过双亲平均表达量;在K326×红大和K326×TN90弱优势组合中,
表2 各杂交组合脯氨酸含量性状的杂种优势
Table 2 Heterosis of proline content in different hybrid combinations
杂交组合 Hybrid combination 中亲优势Mid-parent heterosis 超亲优势Over-parent heterosis
伸根期干旱处理
Drought treatment
at root extension stage 旺长期干旱处理
Drought treatment
at vigorous growth stage 伸根期干旱处理
Drought treatment
at root extension stage 旺長期干旱处理
Drought treatment
at vigorous growth stage
NC82×TN90 38.52 40.35 38.35 30.01
K326×TN90 ?6.36 ?26.88 ?30.47 ?42.46
NC82×韭菜坪2号 NC82×Jiucaiping No.2 6.22 11.54 ?6.40 ?0.56
NC82×毕纳一号 NC82×Bina No.1 22.08 10.02 6.44 ?2.13
NC82×南江三号 NC82×Nanjiang No.3 ?16.26 6.97 ?39.35 ?21.95
NC82×红花大金元 NC82×Honghuadajinyuan 31.83 24.43 27.53 20.78
K326×毕纳一号 K326×Bina No.1 ?26.83 ?9.40 ?39.61 ?26.25
K326×韭菜坪2号 K326×Jiucaiping No.2 ?17.49 ?19.85 ?32.56 ?34.89
K326×红花大金元 K326×Honghuadajinyuan ?51.66 ?17.16 ?63.32 ?37.05
K326×南江三号 K326×Nanjiang No.3 ?35.44 ?2.71 ?37.82 ?5.69
图2 干旱胁迫下脯氨酸合成关键酶基因相对表达量
Fig. 2 Relative expression of pronline synthase genes under drought stress
P5CS、δ-OAT的表达量均在旺长期持续干旱14 d时达到最高,分别是亲本平均表达量的5.57倍、6.48倍,但仅有41.7%和33.3%的时序点超过双亲平均表达量。结果说明脯氨酸合成关键酶基因P5CS、δ-OAT的相对表达量高低和持续表达时间影响了脯氨酸含量性状杂种优势的形成。
2.5 脯氨酸合成关键酶基因表达与脯氨酸杂种优势的相关分析
由脯氨酸合成关键酶基因相对表达量与脯氨酸含量性状杂种优势的相关性分析结果(表3)看出,脯氨酸含量性状杂种优势与P5CS基因相对表达量在旺长期持续干旱7 d呈显著的正相关关系;脯氨酸含量性状杂种优势与δ-OAT基因相对表达量在伸根期持续干旱14 d、旺长期持续干旱7 d呈显著或极显著的正相关关系,与δ-OAT基因相对表达量在旺长期持续干旱14 d呈极显著的负相关关系,与δ-OAT基因相对表达量的相关系数大于与P5CS基因相对表达量的相关系数;同时,δ-OAT基因相对表达量与P5CS基因相对表达量在伸根期整个处理时间和旺长期持续干旱7 d呈显著或极显著的正相关关系。结果说明烟草脯氨酸含量性状杂种优势主要是由于脯氨酸合成关键酶基因δ-OAT和P5CS的高效表达引起的,δ-OAT基因的作用强于P5CS基因,且两个基因间存在显著的互作,因此,在烟草抗旱性优势育种中,应首先选择δ-OAT基因高效表达类型材料,同时要兼顾P5CS基因高效表达类型材料的选择。
3 讨 论
植物细胞在遭受干旱胁迫时都会主动积累大量脯氨酸,降低植物体内的水势来维持体内的水分平衡,起着保护植物免受干旱胁迫的伤害。植物体内脯氨酸含量在一定程度上反映了植物的抗旱性强弱,抗旱性强的品种往往积累较多的脯氨酸。本研究对7个亲本及其组配的10个杂交组合材料进行干旱胁迫处理,结果表明不同亲本间和杂交组合间的脯氨酸含量存在明显差异,材料间脯氨酸含量的不同体现了各自抗旱性强弱差异,现有可用于抗旱性育种的品种资源较为丰富,采用优势育种方法有可能选育出脯氨酸含量高的杂交种。
前人关于脯氨酸与抗旱性方面的研究注重短时期干旱的脯氨酸含量变化,没有持续观察脯氨酸含量的动态变化趋势[18-20],本文采取持续干旱处理7、14和21 d研究干旱胁迫下烟草脯氨酸含量动态变化,结果表明脯氨酸含量在伸根期至旺长期有明显的上升趋势,同一生育时期随干旱胁迫的持续而增加,第14天后开始下降。崔保伟等[21]研究发现,不同生育时期水分胁迫处理的烤烟叶片中游离脯
表3 干旱胁迫下脯氨酸合成关键酶基因表达与脯氨酸杂种优势的相关分析
Table 3 Correlation analysis of gene expression of proline synthesis key enzymes and heterosis of
auxiliary ammonia under drought stress
相关系数
Correlation
coefficient 伸根期干旱处理
Drought treatment at root extension stage 旺长期干旱处理
Drought treatment at vigorous growth stage
δ-OAT 杂种优势Heterosis δ-OAT 杂种优势Heterosis
7d 14d 21d 7d 14d 21d 7d 14d 21d 7d 14d 21d
P5CS 0.89* 0.97** 0.98** 0.67 0.81 0.64 0.88* -0.10 0.30 0.92* 0.30 0.23
δ-OAT — — — 0.42 0.93* 0.75 — — — 0.98** -0.96** 0.83
注:*和**分别表示在5%和1%水平上显著相关。
Note: * and * * respectively indicate a significant correlation at 5% and 1% levels.
氨酸的含量均以中度干旱(50%处理)最高,就整个生育期来看,游离脯氨酸含量从团棵期到旺长期有明显的上升趋势,以旺长期上升幅度最大,说明水分胁迫对脯氨酸的含量变化的影响比较明显,脯氨酸含量的高低随干旱程度的不同而有所变化,这与本试验结果相吻合。因此脯氨酸含量可作为烟草抗旱能力的一个指标,为脯氨酸与烟草抗旱性关系研究提供依据。
杂交种基因全部来自于双亲,并没有新的基因出现,但基因差异表达研究表明,杂交种相对于亲本而言,基因表达不仅存在质的差异,还存在量的差异,导致了表型的变化[22-23]。基因表达量的差异与杂种优势形成的关系密切[24-25],TSAFTARIS等[26]通过比较杂种与亲本间若干基因的表达量发现,有优势杂种的平均表达量高于无优势的杂种。植物体内脯氨酸的合成有两条途径,分别为谷氨酸(Glu)途径和鸟氨酸(Orn)途径,前人研究认为,干旱胁迫条件下植物体内脯氨酸积累主要依靠Glu途径,Δ1-吡咯啉-5-羟酸合成酶(P5CS)是脯氨酸合成途径的关键酶[27]。本研究筛选强、弱优势组合,在伸根期和旺长期干旱胁迫下研究了P5CS、δ-OAT基因的相对表达量与杂种优势大小的关系,结果显示烟草脯氨酸含量性状杂种优势主要是由于脯氨酸合成关键酶基因δ-OAT和P5CS的高效表达引起的,δ-OAT基因的作用强于P5CS基因,说明脯氨酸含量性状杂种优势与烟草脯氨酸积累的主要调控基因有差异,脯氨酸含量性状杂种优势的关键 调控基因是δ-OAT。
4 结 论
杂种优势的形成是一个动态的、复杂的过程,烟草在不同时期不同强度的干旱胁迫下脯氨酸合成关键酶基因的表达具有特异性和时序性。伸根期持续干旱14 d时δ-OAT上调表达、旺长期持续干旱7 d时δ-OAT和P5CS基因上调表达以及旺长期持续干旱14 d时δ-OAT基因下调表达是相应时期烟草脯氨酸含量性状杂种优势形成的分子基础。
参考文献
[1]段淑辉,杨亿军,刘建利,等. 煙草需水规律研究进展[J]. 中国烟草科学,2012,33(4):99-105.
DUAN S H, YANG Y J, LIU J L, et al. Advance in water requirement of tobacco[J]. Chinese Tobacco Science, 2012, 33(4): 99-105.
[2]龚婷,刘善丽,尹国瞩,等. 烟草生长、光合特性及品质对水分胁迫的响应研究[J]. 西南师范大学学报(自然科学版)2017,42(8):64-69.
GONG T, LIU S L, YIN G Z, et al. Effects of water stress on growth, photosynthetic characteristics and quality of tobacco[J]. Journal of Southwest China Normal University(Natural Science Edition), 2017, 42(8): 64-69.
[3]黄强,王津津,侯学文. 烟草抗非生物逆境分子育种研究进展[J]. 生物技术通报,2010(5):34-37.
HUANG Q, WANG J J, HOU X W. The advancements of tobacco molecular breeding of anti-abiotic stresses[J]. Biotechnology Bulletin, 2010(5): 34-37.
[4]焦蓉. 普通烟草脯氨酸合成酶基因NtP5CS和Ntδ-OAT的克隆与表达分析[D]. 北京:中国农业科学院,2011.
JIAO R. Cloning and expression analysis of proline synthetase gene NtP5CS and Ntδ-OAT in Nicotiana tabacum[D]. Beijing: Chinese Academy of Agriculture Sciences, 2011.
[5]全先庆,张渝洁,单雷,等. 高等植物脯氨酸代谢研究进展[J]. 生物技术通报,2007(1):14-18.
QUAN X Q, ZHANG Y J, SHAN L, et al. Advances in proline metabolism researches of higher plants[J]. Biotechnology Bulletin, 2007(1): 14-18.
[6]张春宝,赵洪锟,李启云,等. 野生大豆Δ′-吡咯琳-5-羧酸合成酶(P5CS)基因的克隆与序列分析[J]. 大豆科学,2008,27(6):915-920.
ZHANG C B, ZHAO H K, LI Q Y, et al. Molecular Cloning and Sequence Analysis of Δ′-pyrroline-5- Carboxylate Synthetase[J]. Soybean Science, 2008, 27(6): 915-920.
[7]STR?NSK? J, TYLICHOV? M, KOPECN? D, et al. Biochemical characterization of pea ornithine-δ- aminotransferase: Substratespecifity and inhibition by di-and polyamines[J]. Biochimie, 2010(3): 1-9.
[8]陈吉宝. 普通菜豆P5CS基因的克隆、功能验证及单核苷酸多态性[D]. 北京:中国农业科学院,2008.
CHEN J B. Cloning, function analysis and single nucleotide polymorphism of common bean (Phaseoleae vnlgaris L.) P5CS gene[D]. Beijing: Chinese Academy of Agriculture Sciences, 2008.
[9]谭秦亮,潘成列,周全光,等. 甘蔗基因克隆的研究进展[J]. 农业研究与应用,2016(6):46-52.
TAN Q L, PAN C L, ZHOU Q G, et al. Research advances in gene cloning of sugarcane[J]. Agricultural
Research and Application, 2016(6): 46-52.
[10]黄诚梅. 甘蔗脯氨酸积累与Δ′-吡咯啉-5-羧酸合成酶(ScP5CS)基因克隆及转化研究[D]. 广西:广西大学,2007.
HUANG C M. Proline Accumulation, Cloning and Transformation of Δ′-pyrroline-5-Carboxy late SynthetaseGene in Sugarcane (Saccharum officionaruml)[D]. Guangxi: Guangxi University, 2007.
[11]李大红,刘宏伟,秦兰娟,等. 拟南芥P5CS1基因转化羽衣甘蓝增强耐盐性分析[J]. 南方农业学报,2017,48(5):768-773.
LI D H, LIU H W, QIN L J, et al. Salt tolerance strengthening of Brassica oleracea var. acephala f. tricolor genetically modified by P5CS1 gene from Arabidopsis thaliana[J]. Journal of Southern Agriculture, 2017, 48(5): 768-773.
[12]郭旭. 羅布麻、胡杨P5CS基因的克隆及其功能初步分析[D]. 北京:中国农业科学院,2007.
GUO X. Cloning and functional analysis of P5CS from apocynum venetum L and populus euphratica oliv[D]. Beijing: Chinese Academy of Agriculture Sciences, 2007.
[13]支立峰,余涛,朱英国,等. 过量表达脯氨酸的转基因烟草细胞对毒性重金属的抗性增强[J]. 湖北师范学院学报(自然科学版),2006(2):14-19.
ZHI L F, YU T, ZHU Y G, et al. Overexpression of Δ′-pyrroline-5-carboxylate synthetase enhanced tolerance to toxic heavy metals in transgenic tobacco cells[J]. Journal of Hubei Normal University (Natural Science), 2006(2): 14-19.
[14]王桂花,米福贵,刘娟,等. P5CS基因在蒙农杂种冰草植株中的表达及耐盐性研究[J]. 华北农学报,2007(4):33-36.
WANG G H, MI F G, LIU J, et al. Studies on the expression of exogenous P5CS gene in transgenic wheatgrasses (agropyron cristatum×A. desertorumcv.
′Hycrest-Mengnong′) and Drought Resistance[J]. Acta Agriculturae Boreali-Sinica, 2007(4): 33-36.
[15]王翠平,華学军. 拟南芥脯氨酸合成关键酶P5CS1的功能鉴定及原核表达[J]. 扬州大学学报(农业与生命科学版),2017,38(3):90-95.
WANG C P, HUA X J. Characterization of P5CS1 gene involving in proline biosynthesis in Arabidopsis and its prokaryotic expression[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2017, 38(3): 90-95.
[16]ROOSENS N H, BITAR F A, LOENDERS K, et al. Overexpression of ornithine-δ-aminotransferase increases proline biosynthesis and confersosmotolerance in transgenic plants[J]. MolecBreedi, 2002, 9: 73-80.
[17]汪志威. 烟草抗旱性状配合力研究及抗性材料的筛选[D]. 贵阳:贵州大学,2016.
WANG Z W. Study on combining ability of drought resistant characters of tobacco and screening of resistant materials[D]. Guiyang: Guizhou University, 2016.
[18]李晓青,荆月婷,冯全福,等. PEG模拟干旱胁迫对不同烤烟品种生理特性的影响[J]. 中国烟草科学,2016,37(3):15-21.
LI X Q, JING Y T, FENG Q F, et al. Effects of drought stress simulated by PEG on physiological characteristics in different flue-cured tobacco cultivars[J]. Chinese Tobacco Science, 2016, 37(3): 15-21.
[19]袁有波,李继新,丁福章,等. 不同干旱胁迫对烟草叶片保护酶活性的影响[J]. 中国烟草科学,2009,30(5):10-13.
YUAN Y B, LI J X, DING F Z, et al. Effects of drought stress on activity of cell defense enzymes in flue-cured tobacco leaves[J]. Chinese Tobacco Science, 2009, 30(5): 10-13.
[20]周炎,丁松爽,赵莉,等. 烤烟品系LY1306在PEG干旱胁迫下的生理响应及转录组学分析[J]. 中国烟草学报,2017,23(6):36-44.
ZHOU Y, DING S S, ZHAO L, et al. Physiological responses and transcriptome analysis of flue-cured tobacco line LY1306 under drought stress of PEG[J]. Acta Tabacaria Sinica, 2017, 23(6): 36-44.
[21]崔保伟,陆引罡,张振中,等. 不同生育期水分胁迫对烤烟生理特性及化学品质的影响[J]. 中国烟草科学,2009,30(3):19-23.
CUI B W, LU Y G, ZHANG Z Z, et al. Effect of water stress on physiological characteristic and chemical quality during different growth stage of flue-cured tobacco[J]. Chinese Tobacco Science, 2009, 30(3): 19-23.
[22]王国琴. 烟草烟碱杂种优势表现及其基因差异表达分析[D]. 贵阳:贵州大学,2015.
WANG G Q. Studies on tobacco nicotine trait of heterosis and related gene differential expression analysis[D]. Guiyang: Guizhou University, 2015.
[23]許晨璐,孙晓梅,张守攻. 基因差异表达与杂种优势形成机制探讨[J]. 遗传,2013,35(6):714-726.
XU C L, SUN X M, ZHANG S G. Mechanism on differential gene expression and heterosis formation[J]. Hereditas (Beijing), 2013, 35(6): 714-726.
[24]YAO Y Y, NI Z F, ZHANG Y H, et al. Identification of differentially expressed genes in leaf and root between wheat hybrid and its parental inbreds using PCR-based cDNA subtraction[J]. Plant Molecular Biology, 2005, 58(3): 367-384.
[25]STUPAR R M, SPRINGER N M. Cistranscriptional variation in maize inbred lines B73 and Mo17 leads to additive expression patterns in the F1 hybrid[J]. Genetics, 2006, 173(4): 2199-2210.
[26]TSAFTARIS S A, KAFKA M. Mechanisms of heterosis in crop plants[J]. J Crop Prod, 1998, 1(1): 95-111.
[27]焦蓉,刘好宝,刘贯山,等. 论脯氨酸累积与植物抗渗透胁迫[J]. 中国农学通报,2011,27(7):216-221.
JIAO R, LIU H B, LIU G S, et al. Discussion of accumulation of proline and its relationship with osmotic stress tolerance of plants[J]. Chinese Agricultural Science Bulletin, 2011, 27(7): 216-221.
