血管生成素样蛋白4对M2型巨噬细胞分化的影响
2018-05-11吴丹丹丁时桢路国涛肖炜明龚卫娟
吴丹丹, 丁时桢, 路国涛, 肖炜明, 龚卫娟
(1. 扬州大学医学院 免疫学教研室, 江苏 扬州, 225001;2. 扬州大学附属医院 消化科, 江苏 扬州, 225001)
血管生成素样蛋白(ANGPTL)是由Kim等于2000年首先发现的具有多功能的信号蛋白,与人血管生成素结构具有相似性。ANGPTL 4是ANGPTL家族重要成员之一,又被称为禁食诱导脂肪因子(FIFA)、过氧化物酶体增殖物激活型受体(PPAR)调节靶标等[1], ANGPTL 4以寡聚体、糖基化及各种亚型的形式存在,经细胞分泌后可直接进入血循环,在糖脂代谢、动脉粥样硬化、调节血管发生、细胞分化、肾脏损伤等方面具有重要作用[2-3]。
巨噬细胞可分为2个亚群,即M1型和M2型。M1型巨噬细胞介导炎症反应,在宿主防御细菌和病毒感染中发挥核心作用。M2型巨噬细胞参与抗炎反应、寄生虫感染、组织重构、纤维化以及肿瘤疾病发展相关。肿瘤组织相关的M2型巨噬细胞主要通过分泌精氨酸酶、IL-10、血管内皮生长因子(VEGF)及金属基质蛋白酶等促进肿瘤的生长和转移[4-5]。ANGPTL 4已经被发现与结直肠癌、肝癌、乳腺癌、肾癌及头颈癌等多种肿瘤的发病有关[6-8]。为探讨ANGPTL 4是否通过调控M 2型巨噬细胞的分化而参与肿瘤免疫逃逸过程,本文利用ANGPTL 4特异性基因敲除小鼠及重组ANGPTL 4蛋白,观察ANGPTL 4是否具备调节M 2型巨噬细胞分化的作用。
1 材料与方法
1.1 实验材料
LPS购自Sigma-Aldrich公司, RPMI-1640培养基购自Invitrogen公司,胎牛血清购自杭州四季青公司。重组ANGPTL 4蛋白来源于(R&D Systems), F4/80抗体(T45-2342)、CD4抗体(RM4-5)购自BD公司。CD206抗体(C068C2)、IL-4抗体(11B11)购自eBioscience公司。ANGPTL 4-/-鼠自美国NIH隶属的突变小鼠资源和研究中心(MMRRC)引进, C 57BL/6小鼠来自扬州大学比较医学中心。
1.2 方法
1.2.1 小鼠脾脏单细胞悬液的分离: 分别取8~12周ANGPTL 4-/-小鼠和对照C 57BL/6小鼠,颈椎脱臼法处死小鼠,浸泡于75%的酒精,在无菌操作台中提取小鼠脾脏,加入预冷的无菌PBS中,研磨小鼠脾脏,去除血渍和外膜,于200目无菌滤网中过滤小鼠脾脏细胞,所得滤液移入50 mL离心管中。以4 ℃、1 500 转/min离心5 min, 去除上清,加入1 mL红细胞裂解液,吹打均匀,静置10 min, 加入9 mL PBS终止裂解, 4 ℃、1 500 转/min离心5 min, 去上清,根据实验需求,进行下一步操作。
1.2.2 流式细胞术检测和分选细胞: 按1.2.1方法制备脾脏单细胞悬液,用细胞计数板计数,按照每个EP管1×106个细胞分管,加PBS至每管100 μL, 按说明书要求剂量加入相应的荧光抗体F4/80, 4 ℃避光孵育30 min。加入800 μL PBS洗涤抗体, 4 ℃、1 500转/min离心10 min, 弃上清,用400 μL PBS缓冲液重悬细胞,充分混匀,利用流式细胞仪检测和分选F4/80+巨噬细胞。将分选所得F4/80+巨噬细胞移入胎牛血清封闭的50 mL离心管中保存,进行下一步操作。
1.2.3 巨噬细胞与T细胞共培养: 按1.2.2方法分选的巨噬细胞,于37 ℃、5% CO2培养箱中孵育,加入LPS(1 μg/mL)刺激48 h, 收集巨噬细胞,用细胞计数板计数。将巨噬细胞和CD4+T细胞按1∶2细胞数比例加入24孔板中, 37 ℃、5% CO2培养箱中共培养48 h。
1.2.4 胞内染色法检测IL-4的分泌: 检测前5 h, 将共培养于24孔板中的细胞,每孔加入2 μL cell stimulation cocktail(500×), 1 h后,加入BFA。4 h后,收集细胞移入EP管, 4 ℃、1 500转/min离心5 min, 弃上清。1 mL PBS重新洗涤细胞, 4 ℃、1 500转/min离心5 min, 弃上清,加入50 μL PBS, 以及CD4(0.5 mg/mL)抗体,充分混匀, 4 ℃避光孵育30 min, PBS洗涤,离心弃上清。每管加200 μL IC Fixation Buffer(eBioscience)重悬, 4 ℃避光孵育30~45 min, 每管加入1 mL 1×Permeabilization Buffer洗涤,离心弃上清。加入IL-4(0.2 mg/mL)抗体, 4 ℃避光孵30~45 min, 1 mL 1×Permeabilization Buffer再次洗涤,离心去上清。加入300 μL 1×Permeabilization Buffer重悬,待流式细胞仪(FACS Calibur)检测。
1.2.5 重组ANGPTL 4蛋白刺激巨噬细胞: 按照1.2.2方法分选巨噬细胞,按照每孔5×105细胞数铺至24孔板,加入重组ANGPTL 4蛋白(250 ng/mL), 在37 ℃、5% CO2培养箱中培养48 h后,收集细胞移入EP管, 4 ℃、1 500转/min离心5 min, 弃上清。加入F4/80、CD206(0.5 mg/mL)抗体,充分混匀, 4 ℃避光孵育30 min, PBS洗涤,离心弃上清。流式细胞术检测脾脏中M2型(F4/80+CD206+)巨噬细胞的频率。
1.2.6 统计学分析: 不同处理组之间的差异采取ANOVA分析方法,两组之间的比较采取团体T检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1 ANGPTL 4-/-小鼠脾脏M2型巨噬细胞频率的检测
取8~12周生理状态下的ANGPTL 4-/-小鼠和对照C 57BL/6小鼠,制备小鼠脾脏单细胞悬液,利用流式细胞术检测脾脏中M2型(F4/80+CD206+)巨噬细胞的频率。结果显示,与对照组相比较, ANGPTL 4-/-小鼠脾脏M2型巨噬细胞频率无明显变化。见图1。
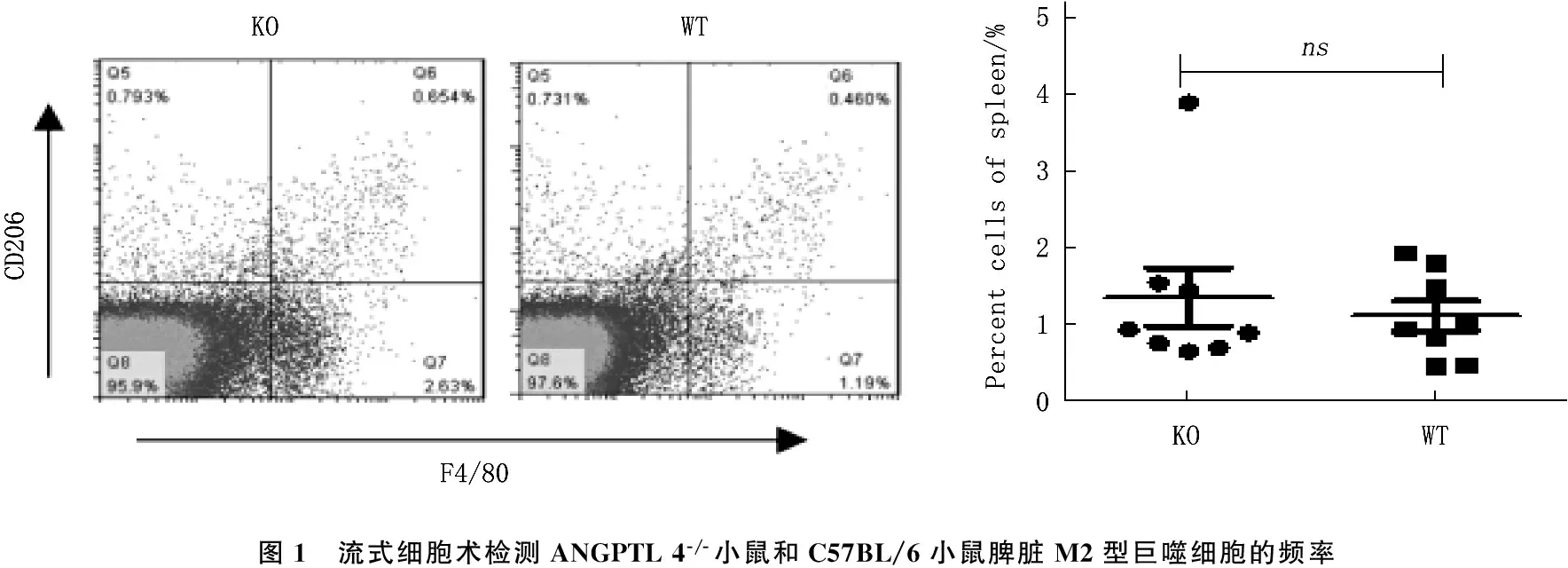
图1 流式细胞术检测ANGPTL4-/-小鼠和C57BL/6小鼠脾脏M2型巨噬细胞的频率
2.2 LPS对ANGPTL 4-/-小鼠脾脏M2细胞分化的影响
分离ANGPTL 4-/-小鼠和C57BL/6小鼠脾脏单细胞悬液,体外培养, LPS(1 μg/mL)刺激48 h, 通过流式细胞术检测M2型(F4/80+CD206+)巨噬细胞的频率。结果表明,与对照组相比, LPS刺激后, ANGPTL 4-/-小鼠脾脏M2型巨噬细胞的表达无明显差异。见图2。
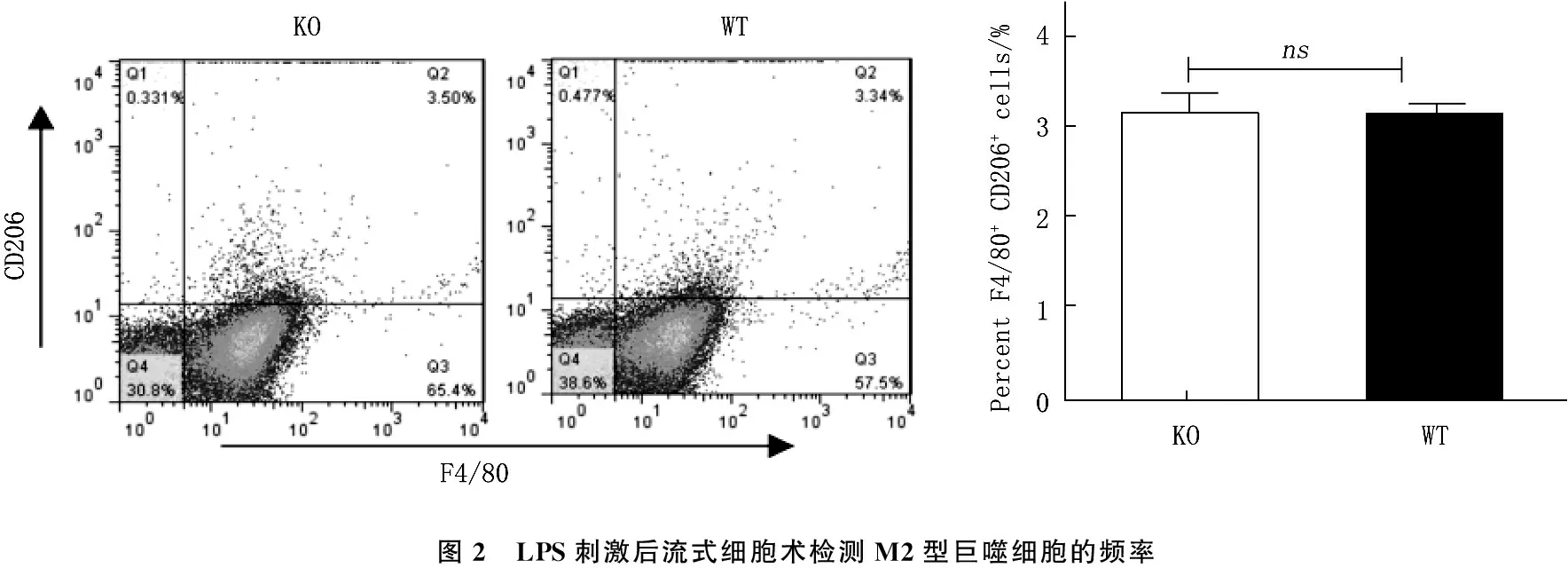
图2 LPS刺激后流式细胞术检测M2型巨噬细胞的频率
2.3 ANGPTL 4-/-小鼠巨噬细胞对Th2细胞分化的影响
分离ANGPTL 4-/-小鼠和C57BL/6小鼠脾脏巨噬细胞,体外培养, LPS (1 μg/mL)刺激48 h, 将上述LPS刺激的巨噬细胞与CD4+T细胞按照1∶2的效靶比例共培养48 h, 流式细胞仪胞内染色法检测CD4+T细胞IL-4的分泌。结果表明, ANGPTL 4-/-小鼠和C 57BL/6小鼠脾脏M2型巨噬细胞的内在活性无显著性差异, ANGPTL 4-/-小鼠巨噬细胞对Th2细胞分化无明显影响。见图3。
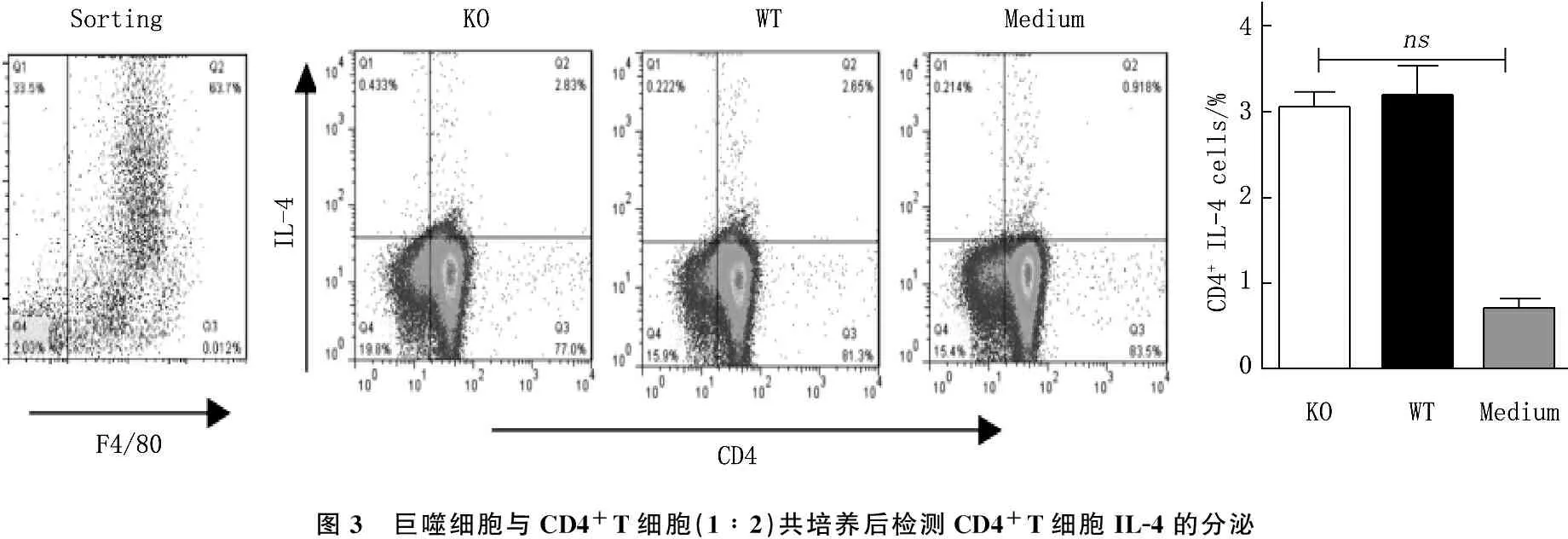
图3 巨噬细胞与CD4+T细胞(1∶2)共培养后检测CD4+T细胞IL-4的分泌
2.4 重组ANGPTL 4蛋白对M2细胞分化的影响
取C 57BL/6小鼠脾脏单细胞悬液,分别加入PBS和重组ANGPTL 4蛋白,用LPS(1 μg/mL)刺激48 h, 流式细胞术检测M2型巨噬细胞表达频率。结果显示,与PBS组相比,加入重组ANGPTL 4蛋白后, M2型巨噬细胞频率无明显变化(图4)。分选C 57BL/6小鼠脾脏巨噬细胞,分别用PBS和重组ANGPTL 4(rANGPTL 4)蛋白处理, LPS(1 μg/mL)刺激48 h, 将巨噬细胞与CD4+T细胞按照1∶2的效靶比例共培养48 h, 利用流式细胞术胞内染色法检测CD4+T细胞IL-4的分泌。结果显示,与PBS组相比,加入重组ANGPTL 4蛋白后, CD4+T细胞IL-4分泌无明显差异(图5)。
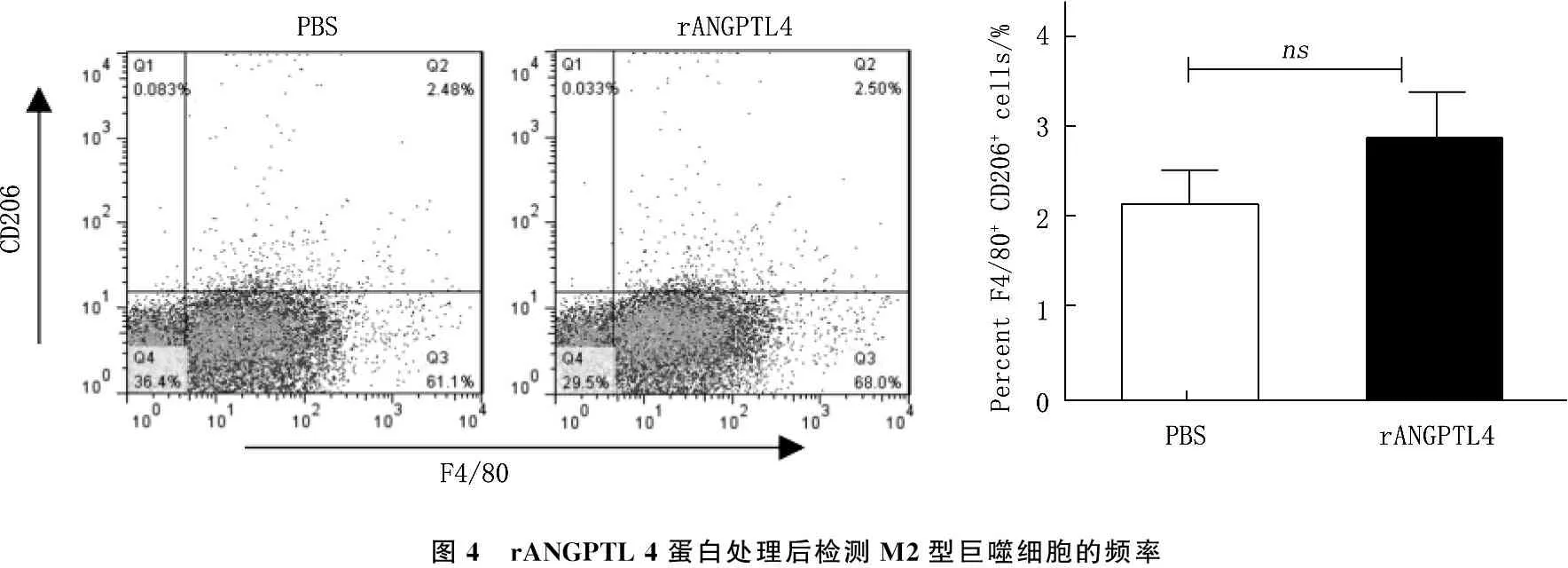
图4 rANGPTL4蛋白处理后检测M2型巨噬细胞的频率
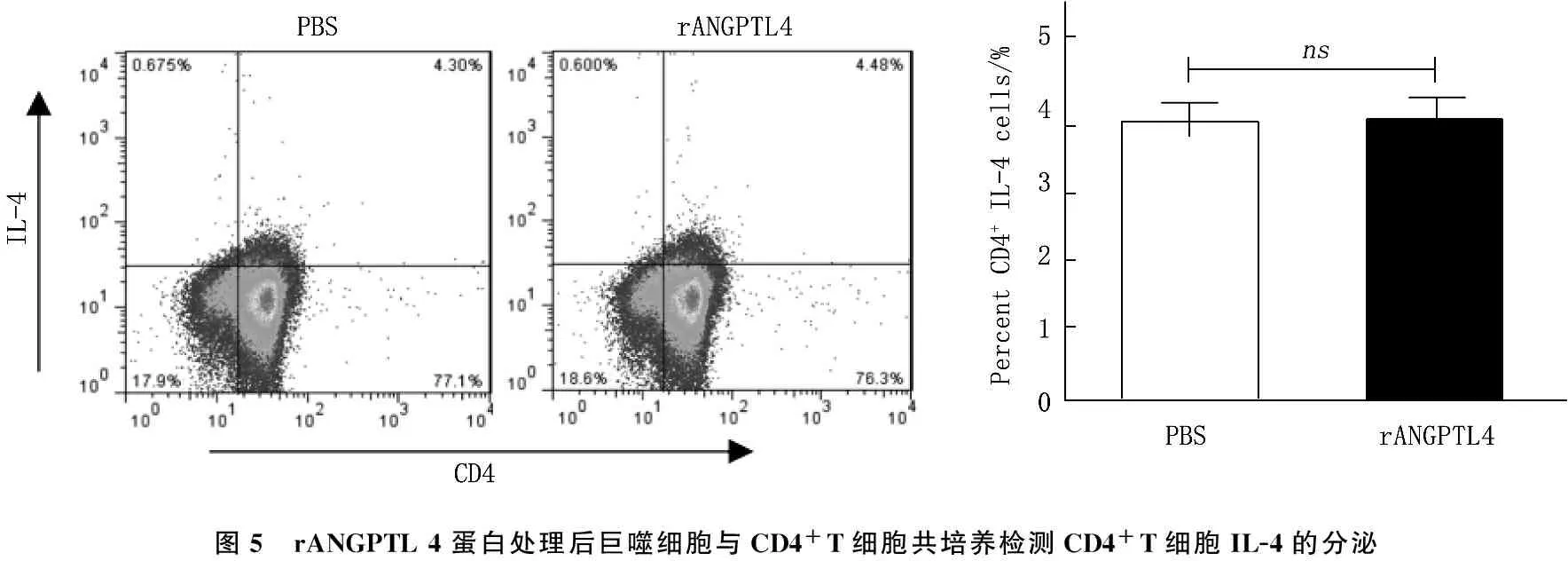
图5 rANGPTL4蛋白处理后巨噬细胞与CD4+T细胞共培养检测CD4+T细胞IL-4的分泌
3 讨 论
本研究首先对生理状态下ANGPTL 4-/-小鼠和C 57BL/6小鼠脾脏M2型巨噬细胞的频率进行初步分析,发现M2型(F4/80+CD206+)巨噬细胞频率无明显变化; 经LPS刺激,发现ANGPTL 4-/-小鼠脾脏M2型巨噬细胞的表达无明显差异; 同时,对M2型巨噬细胞的内在活性进行了探讨,将经LPS刺激的ANGPTL 4-/-小鼠巨噬细胞与T细胞共培养,发现T细胞IL-4的分泌无明显差异,说明ANGPTL 4-/-小鼠脾脏内的M2型巨噬细胞不能诱导Th2分化; 继而又用重组ANGPTL 4蛋白对C 57BL/6小鼠脾脏的巨噬细胞进行处理,将小鼠巨噬细胞与T细胞共培养,检测M2型巨噬细胞表达频率,以及T细胞IL-4的分泌情况,结果发现,与对照组相比,均无明显差异,证实ANGPTL 4对M2型巨噬细胞的分化及其内在活性无关。
巨噬细胞分为M1型和M2型,其中M1型细胞以糖酵解供能为主,而M2型细胞则主要利用脂肪酸氧化磷酸化供能[9-10]。抑制巨噬细胞脂肪酸氧化磷酸化反应促进向M1细胞分化,如在脂肪组织维持和脂质代谢中发挥关键作用的Trib 1分子,对M2类巨噬细胞的分化具有重要影响[11]。ANGPTL 4已经被认为是能量稳态的各个方面的中心参与者,可以通过卷曲螺旋结构域抑制脂蛋白脂肪酶(LPL)调节脂肪分解,而LPL可促进血浆富含TG的脂蛋白的清除[12], 从而升高ATP/AMP的比值。有研究[13]表明,通过激活PKC对ANGPTL 4的诱导可能在气道重塑和脂质体内平衡的调节中起重要作用。同时, ANGPTL 4可能通过抑制下丘脑AMPK(AMP激活的蛋白激酶)活性作为厌食症因子[14]。LKB1在T细胞活化,活力和代谢中起重要作用,并表明LKB 1-AMPK信号通过调节mTOR活性负调节效应T细胞功能[15]。前期,作者研究了ANGPTL 4-/-小鼠中M2型巨噬细胞表型及其内在生物学活性,以及ANGPTL 4是否影响M2型巨噬细胞分化。但ANGPTL 4基于哪条途径影响AMPK的内在活性,从而参与糖脂代谢,以及ANGPTL 4是否通过能量代谢调节巨噬细胞活性的分子机制,仍有待进一步的研究。
ANGPTL 4被发现与多种肿瘤相关,如胃癌、肠癌、肺癌、肝癌、乳腺癌、黑色素瘤、脑胶质细胞瘤等[16]。其纤维蛋白原样结构域相互作用并激活特异性整联蛋白以促进伤口愈合,调节血管通透性,并调节ROS(活性氧物质)水平以促进肿瘤发生[17]。此外, M2型巨噬细胞的极化在结肠肿瘤的发生和骨肉瘤的转移中发挥着至关重要的作用[18-21]。作者目前只证实生理状态ANGPTL 4对M2型巨噬细胞分化无影响,但在肿瘤微环境下, ANGPTL 4是否影响M2型巨噬细胞分化参与肿瘤免疫逃逸过程,尚待进一步研究。本研究证实血管生成素样蛋白4(ANGPTL 4)不能调节M2型巨噬细胞的分化。
[1] Santulli G. Angiopoietin-like proteins: a comprehensive look[J]. Front Endocrinol (Lausanne), 2014, 5: 4-11.
[2] Morrison A C, Fu YP, O′Donnell C J, et al. Variants in ANGPTL 4 and the Risk of Coronary Artery Disease[J]. N Engl J Med, 2016, 375(23): 2303-2309.
[3] Goulbourne C N, Gin P, Tatar A, et al. The GPIHBP1-LPL complex is responsible for the margination of triglyceride-rich lipoproteins in capillaries[J]. Cell Metab, 2014, 19(5): 849-860.
[4] Porta C, Riboldi E, Ippolito A, et al. Molecular and epigenetic basis of macrophage polarized activation[J]. Semin Immunol, 2015, 27(4): 237-248.
[5] Elliott L A, Doherty G A, Sheahan K, et al. Human Tumor-Infiltrating Myeloid Cells: Phenotypic and Functional Diversity[J]. Front Immunol, 2017, 8: 86-95.
[6] El-Shal A S, Zidan H E, Rashad N M, et al. Angiopoietin-like protein 3 and 4 expression 4 and their serum levels in hepatocellular carcinoma[J]. Cytokine, 2017, 96: 75-86.
[7] Kubo H, Kitajima Y, Kai K, et al. Regulation and clinical significance of the hypoxia-induced expression of ANGPTL 4 in gastric cancer[J]. Oncol Lett, 2016, 11(2): 1026-1034.
[8] Liao Y H, Chiang K H, Shieh J M, et al. Epidermal growth factor-induced ANGPTL 4 enhances anoikis resistance and tumour metastasis in head and neck squamous cell carcinoma[J]. Oncogene, 2017, 36(16): 2228-2242.
[9] Huang Y J, Yang C K, Wei P L, et al. Ovatodiolide suppresses colon tumorigenesis and prevents polarization of M2 tumor-associated macrophages through YAP oncogenic pathways[J]. J Hematol Oncol, 2017, 10(1): 60-68.
[10] Covarrubias A J, Aksoylar H I, Horng T. Control of macrophage metabolism and activation by mTOR and Akt signaling[J]. Semin Immunol, 2015, 27(4): 286-296.
[11] Satoh T, Kidoya H, Naito H, et al. Critical role of Trib1 in differentiation of tissue-resident M2-like macrophages[J]. Nature, 2013, 495(7442): 524-528.
[12] Chi X, Shetty S K, Shows H W, et al. Angiopoietin-like 4 Modifies the Interactions between Lipoprotein Lipase and Its Endothelial Cell Transporter GPIHBP1[J]. J Biol Chem, 2015, 290(19): 11865-11877.
[13] Stapleton C M, Joo J H, Kim Y S, et al. Induction of ANGPTL 4 expression in human airway smooth muscle cells by PMA through activation of PKC and MAPK pathways[J]. Exp Cell Res, 2010, 316(4): 507-516.
[14] Kim H K, Youn B S, Shin M S, et al. Hypothalamic Angptl4/Fiaf is a novel regulator of food intake and body weight[J]. Diabetes, 2010, 59(11): 2772-2780.
[15] MacIver N J, Blagih J, Saucillo D C, et al. The liver kinase B1 is a central regulator of T cell development, activation, and metabolism[J]. J Immunol, 2011, 187(8): 4187-4198.
[16] Hu K, Babapoor-Farrokhran S, Rodrigues M, et al. Hypoxia-inducible factor 1 upregulation of both VEGF and ANGPTL 4 is required to promote the angiogenic phenotype in uveal melanoma[J]. Oncotarget, 2016, 7(7): 7816-7828.
[17] Shafik N M, Mohamed D A, Bedder A E, et al. Significance of Tissue Expression and Serum Levels of Angiopoietin-like Protein 4 in Breast Cancer Progression: Link to NF-κB/P65 Activity and Pro-Inflammatory Cytokines[J]. Asian Pac J Cancer Prev, 2015, 16(18): 8579-8587.
[18] Zhou Q, Xian M, Xiang S, et al. All-Trans Retinoic Acid Prevents Osteosarcoma Metastasis by Inhibiting M2 Polarization of Tumor-Associated Macrophages[J]. Cancer Immunol Res, 2017, 5(7): 547-559.
[19] 刘静, 殷俊, 陈晓岚, 等. 特发性膜性肾病中抗M型磷脂酶A2受体抗体、血管生成素样蛋白-4及可溶性尿激酶型纤溶酶原激活物受体的临床意义[J]. 南通大学学报: 医学版, 2017, 37(3): 196-202.
[20] 吴贵福, 高珊, 董春萍. 2型糖尿病血清血管生成素样蛋白2、4水平与颈动脉斑块性质的相关性研究[J]. 海南医学院学报, 2016, 22(21): 2605-2608.
[21] 李文娜, 崔静, 于晓, 等. 2型糖尿病肾病患者血清及尿液血管生成素样蛋白4的表达变化及意义[J]. 山东医药, 2016, 56(29): 47-49.
